化学选修四考前清理.docx
《化学选修四考前清理.docx》由会员分享,可在线阅读,更多相关《化学选修四考前清理.docx(13页珍藏版)》请在冰豆网上搜索。
化学选修四考前清理
第一部分理解原理
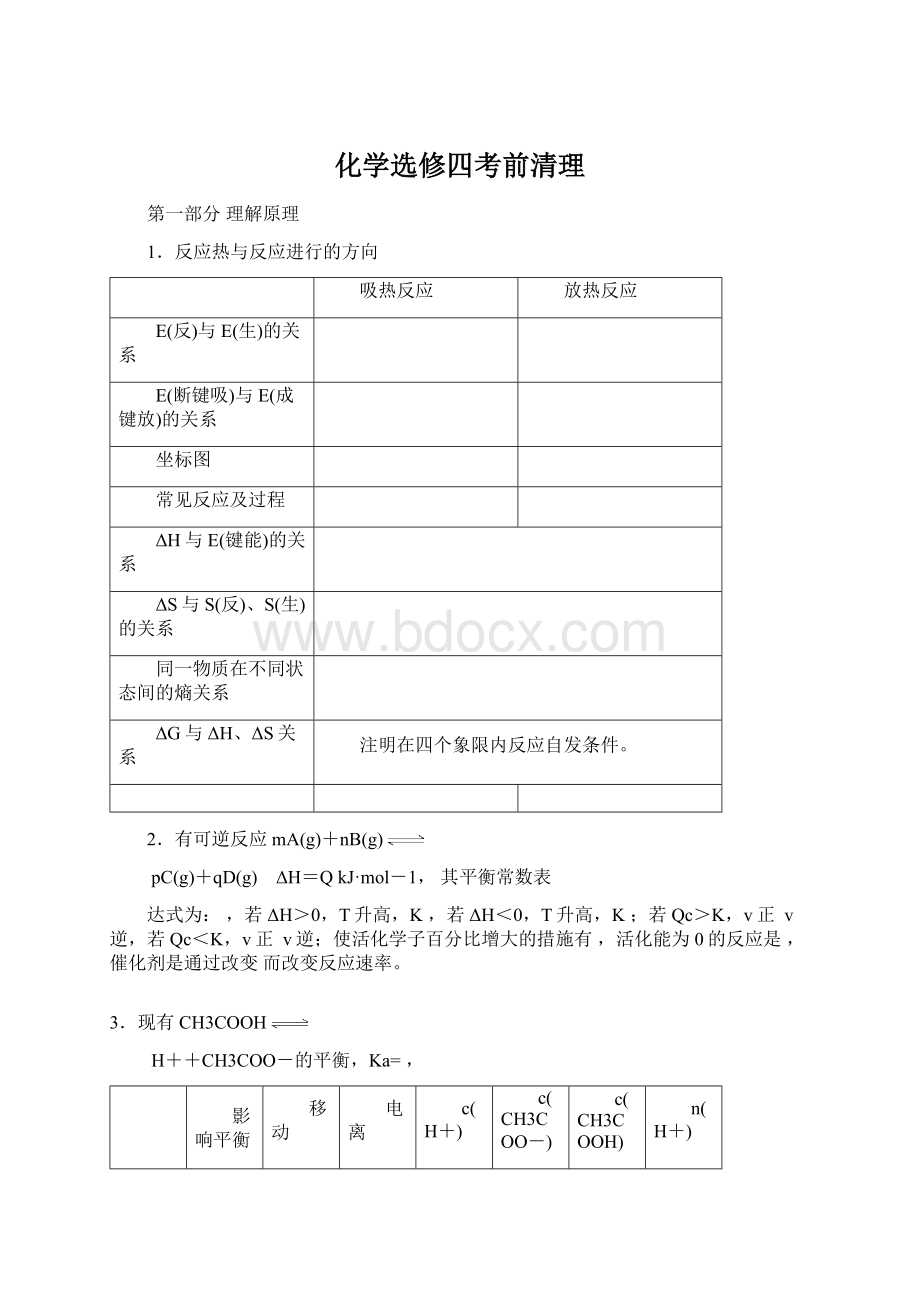
1.反应热与反应进行的方向
吸热反应
放热反应
E(反)与E(生)的关系
E(断键吸)与E(成键放)的关系
坐标图
常见反应及过程
ΔH与E(键能)的关系
ΔS与S(反)、S(生)的关系
同一物质在不同状态间的熵关系
ΔG与ΔH、ΔS关系
注明在四个象限内反应自发条件。
2.有可逆反应mA(g)+nB(g)
pC(g)+qD(g) ΔH=QkJ·mol-1,其平衡常数表
达式为:
,若ΔH>0,T升高,K,若ΔH<0,T升高,K;若Qc>K,v正v逆,若Qc<K,v正v逆;使活化学子百分比增大的措施有,活化能为0的反应是,催化剂是通过改变而改变反应速率。
3.现有CH3COOH
H++CH3COO-的平衡,Ka=,
影响平衡移动因素
移动
方向
电离
程度
c(H+)
c(CH3COO-)
c(CH3COOH)
n(H+)
升温
加水
加冰醋酸
通入HCl
加入固体
醋酸钠
加入Zn粒等与H+反应的物质
比较同c、V时,一元强酸与一元弱酸:
c(H+)
pH
中和NaOH的能力
与金属反应放出H2
与金属反应开始时速率
一元强酸
一元弱酸
比较同c(H+)、V时,一元强酸与一元弱酸:
c(酸)
pH
中和NaOH的能力
与金属反应放出H2
与金属反应开始时速率
一元强酸
一元弱酸
4.H2O
H++OH-,ΔH0,K=,Kw=,
影响平衡移动的因素
移动
方向
Kw
c(H+)
c(OH-)
c(H+)水
c(OH-)与c(H+)关系
溶液
酸碱性
25℃→100℃
通入HCl
加入固体
NaOH
加入Na
加入固体
醋酸钠
加入CaO
5.FeCl3+3H2O
Fe(OH)3+3HClΔH0,K=,
Kh=,Kh与Ka、Kb的关系。
现象
影响平衡
移动的因素
移动
方向
水解
程度
c(H+)
n(H+)
pH
c(Fe3+)
加热
加水
加入固体FeCl3
加入固体NaHCO3
通入HCl
(1)下列盐溶液蒸干,分别得到什么固体:
Al2(SO4)3________;FeCl3________;FeCl2________;FeSO4________;
Na2SO3__________;NaHCO3________;CH3COONH4_________.
(2)指出下列各组哪些离子间不能大量共存,并写出离子间的反应式。
①Al3+、K+、Cl-、AlO2-、HCO3-_____________________________________________
②Al3+、Na+、SO42+、S2-____________________________________________________
③Mg2+、NH4+、SO42-、CO32-______________________________________________
④H+、NH4+、Fe2+、NO3-___________________________________________________
⑤H+、NH4+、Fe2+、SCN-、CN-____________________________________________
⑥Fe3+、NH4+、I-、S2-、ClO-____________________________________________________
⑦加入Al放H2的溶液:
Mg2+、NH4+、SO42-、NO3-.___________________________
⑧在C(H+)/C(OH-)=10-10的溶液中:
Mg2+、Na+、HCO3-、Cl-____________________
⑨在某无色溶液中:
MnO4-、HS-、K+、Cu2+、CO32-_____________________________
6.在固体溶液中:
AmBn(s)
mAn+(aq)+nBm-(aq),ΔH0,
Ksp=_______________________。
AgCl(s)
Ag+(aq)+Cl-(aq)
现象
移动方向
m(AgCl)
S(AgCl)
c(Ag+)
c(Cl-)
Ksp
升温
加水
加入固体AgCl
加入固体AgNO3
加入固体NaCl
加入固体NaI
加入固体Na2S
7.电化学
原电池
判断方法
电解池
正极
负极
阴极
阳极
电极材质
反应类型
电子流向
电解质离子移动方向
电流流向
电极反应现象
本质
第二部分基础落实
一、写出下列电池的电极反应和电池反应式
电池反应式(离子反应)
负极材料及反应式
正极材料及反应式
Mg-Al/
HCl
Mg-Al/
NaOH
Al-Cu/
稀HNO3
Al-Cu/
浓HNO3
H2-O2/H+
CH3OH
-O2/H+
C3H8-O2
/OH-
CO-O2/
熔融Na2CO3
二、写出下列电解池的电极反应式及总反应式(离子方程式)
电解质溶液
阴极反应式
阳极反应式
电解池总反应式
CuBr2
HCl
Ba(OH)2
KCl
AgNO3
在Zn上镀铜
冶炼金属镁
冶炼金属铝
三、写出下列溶液中的三个守恒式
电荷守恒
元素守恒
质子守恒
NH4Cl溶液
NaAc溶液
Na2CO3溶液
NaHCO3溶液
AlCl3溶液
NH4Ac溶液
四、把下列溶液中的离子浓度按由大到小的顺序排列.
CH3COOH:
___________________________________________________________
CH3COONa:
__________________________________________________________
NH4Cl:
______________________________________________________________
Na2CO3:
_____________________________________________________________
NaHCO3:
_____________________________________________________________
NaHSO3:
_____________________________________________________________
等浓度的NH3·H20—NH4Cl:
____________________________________________
等浓度的HCN—NaCN:
_________________________________________________
五、写出下列离子方程式,是氧化还原反应的找出两剂两产物,并标出电子转移的方向与数目。
1.草酸与酸性高锰酸钾:
2.硫代硫酸钠与稀硫酸:
3.Fe3++SCN-=
相应试剂颜色:
4.亚铁盐与铁氰化钾:
离子方程式:
相应试剂颜色:
高二化学选四第一、二章复习训练题
1.下列各关系式中能说明反应N2+3H2
2NH3已达平衡状态的是( )
A.3v正(N2)=v正(H2)B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3)D.v正(N2)=3v逆(H2)
2.可逆反应aA(s)+bB(g)
cC(g)+dD(g) ΔH=QkJ·mol-1,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如下图所示,据图分析,以下正确的是(双选)( )
A.T1>T2,Q>0
B.T1<T2,Q<0
C.p1>p2,a+b=c+d
D.p1<p2,b=c+d
3.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)
NH3(g)+HI(g);②2HI(g)
H2(g)+I2(g)。
达到平衡时,c(H2)=0.5mol/L,c(HI)=4mol/L,则此温度下反应①的平衡常数为( )
A.9B.16C.20D.25
4.红磷在氯气中的燃烧反应有一步化合反应PCl3(g)+Cl2(g)
PCl5(g),对该反应进行研究:
当温度为437K时,PCl3的转化率为62%,当温度为573K时,PCl3的转化率为42%。
则关于此反应正确的说法是(双选)( )
A.正反应为吸热反应B.正反应为放热反应
C.温度升高,此反应的K增大D.温度升高,此反应的K减小
5.将2molSO2和2molSO3气体混合于某固定体积的密闭容器中,在一定条件下反应:
2SO2(g)+O2(g)
2SO3(g),平衡时SO3为Wmol。
相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于Wmol的是( )
A.2molSO2+1molO2B.4molSO2+1molO2
C.2molSO2+1molO2+2molSO3D.3molSO2+1molSO3
6.关于化学平衡常数的叙述正确的是(双选)( )
A.温度一定,一个化学反应的平衡常数是一个常数
B.两种物质反应,不管怎样书写化学方程式,平衡常数不变
C.温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数
D.浓度商Q<K时,v正<v逆
7.下列关于反应热的表述正确的是()
A.当ΔH为“-”时,表示该反应为吸热反应
B.已知C(s)+1/2O2(g)=CO(g)的反应热为110.5kJ·mol-1,说明碳的燃烧热为110.5kJ
C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D.1molNaOH分别和1molCH3COOH、1molHNO3反应,放出的热量:
CH3COOH<HNO3
8.在四个不同的容器中,在不同的条件下进行合成氨反应。
根据在相同时间内测定的结果判断,生成氨气的最快的是()
A.v(H2)=0.3mol·L-1·min-1B.v(N2)=0.2mol·L-1·min-1
C.v(NH3)=0.25mol·L-1·min-1D.v(H2)=0.4mol·L-1·min-1
9.下列有关滴定操作的顺序正确的是()
①用标准溶液润洗滴定管②往滴定管内注入标准溶液③检查滴定管是否漏水④滴定⑤洗涤
A.⑤①②③④B.③⑤①②④
C.⑤②③①④D.②①③⑤④
10.自由能的变化(ΔG)是反应方向判断的复合判据:
ΔG=ΔH-TΔS,ΔG<0时反应正向自发进行。
已知某化学反应其ΔH=-122kJ·mol-1,ΔS=231J·mol-1·K-1,则此反应在下列哪种情况下可自发进行( )
A.在任何温度下都能自发进行B.在任何温度下都不能自发进行
C.仅在高温下自发进行D.仅在低温下自发进行
11.N2H4是一种高效清洁的火箭燃料。
0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。
则下列热化学方程式中正确的是( )
A.N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH=+267kJ·mol-1
B.N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH=-534kJ·mol-1
C.N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH=+534kJ·mol-1
D.N2H4(g)+O2(g)===N2(g)+2H2O(l)ΔH=-133.5kJ·mol-1
12.对于A2+3B2
2C的反应来说,以下化学反应速率的表示中,反应速率最快的是
A.v(A2)=0.4mol·L-1·s-1B.v(B2)=0.8mol·L-1·s-1
C.v(C)=0.6mol·L-1·s-1D.v(B2)=42mol·L-1·min-1
13.升高温度,下列数据不一定同时增大的是( )
A.化学反应速率vB.弱电解质的电离平衡常数Ka
C.化学平衡常数KD.水的离子积常数KW
14.可逆反应mA(g)
nB(g)+pC(s) ΔH=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )
A.m>n,Q>0
B.m>n+p,Q>0
C.m>n,Q<0
D.m<n+p,Q<0
15.将氨水缓缓地滴入盐酸中至中性,下列有关的说法:
①盐酸过量 ②氨水过量 ③恰好完全反应 ④c(NH4+)=c(Cl-) ⑤c(NH4+)<c(Cl-)正确的是( )
A.①⑤B.③④C.②⑤D.②④
16.(12分)某实验小组拟定用pH试纸验证醋酸是弱酸。
甲、乙两同学的方案分别是:
甲:
①称取一定量的冰醋酸准确配制0.1mol/L的醋酸溶液100mL;
②用pH试纸测出该溶液的pH,即可证明醋酸是弱酸。
乙:
①称取一定量的冰醋酸准确配制pH=1的醋酸溶液100mL;
②取醋酸溶液10mL,加水稀释为100mL;
③用pH试纸测出该溶液的pH,即可证明醋酸是弱酸。
(1)两个方案的第①步中,都要用到的定量仪器是___________________________。
简要说明pH试纸的使用方法:
___________________________________________
______________。
(2)甲方案中,说明醋酸是弱酸的理由是测得醋酸溶液的pH_____1(选填“>”“<”“=”,下同);乙方案中,说明醋酸是弱酸的理由是测得醋酸溶液的pH______2。
(3)请你评价:
乙方案中的不妥之处。
___________________________________________
______________。
(4)请你再提出一个用pH试纸证明醋酸是弱酸的合理而比较容易进行的方案(药品可任取)作简明扼要的表述。
___________________________________________
______________。
17.(8分)对可逆反应aA(g)+bB(g)
cC(g)+dD(g)达到平衡时,各物质的物质的量浓度满足以下关系:
=K(为一常数),K称为化学平衡常数,其反应的K值与温度有关。
现有反应:
CO(g)+H2O(g)
CO2(g)+H2(g) ΔH<0。
在850℃时,K=1。
(1)若升高温度到950℃,达到平衡时K________1(填“大于”“小于”或“等于”)。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0molCO、3.0molH2O、1.0molCO2和xmolH2,则:
①当x=5.0时,上述平衡向________(填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________
________。
③在850℃时,若设x=5.0和x=6.0,其物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a________b(填“>”“<”或“=”)。
18.(2008宁夏理综,13)已知H2(g)、C2H4(g)和C2H5OH
(1)的燃烧热分别是285.8kJ·mol-1、1411.0kJ·mol-1和1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为()
A.-44.2kJ·mol-1B.+44.2kJ·mol-1
C.-330kJ·mol-1D.+330kJ·mol-1
19.(8分)(2011·银川高二检测)化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热。
由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列ΔH表示物质燃烧热的是________;表示物质中和热的是________。
(填ΔH1、ΔH2和ΔH3等)
A.2H2(g)+O2(g)===2H2O(l) ΔH1
B.C(s)+
O2(g)===CO(g) ΔH2
C.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH3
D.C(s)+O2(g)===CO2(g) ΔH4
E.C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l) ΔH5
F.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH6
G.2NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+2H2O(l) ΔH7
(2)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。
键能可以简单地理解为断开1mol化学键时所需吸收的能量。
下表是部分化学键的键能数据:
化学键
P—P
P—O
O===O
P===O
键能kJ/mol
197
360
499
x
已知白磷(P4)的燃烧热为2378.0kJ/mol,白磷完全燃烧的产物(P4O10)的结构如图所示,则上表中x=________。