专题14 铁及其化合物.docx
《专题14 铁及其化合物.docx》由会员分享,可在线阅读,更多相关《专题14 铁及其化合物.docx(11页珍藏版)》请在冰豆网上搜索。
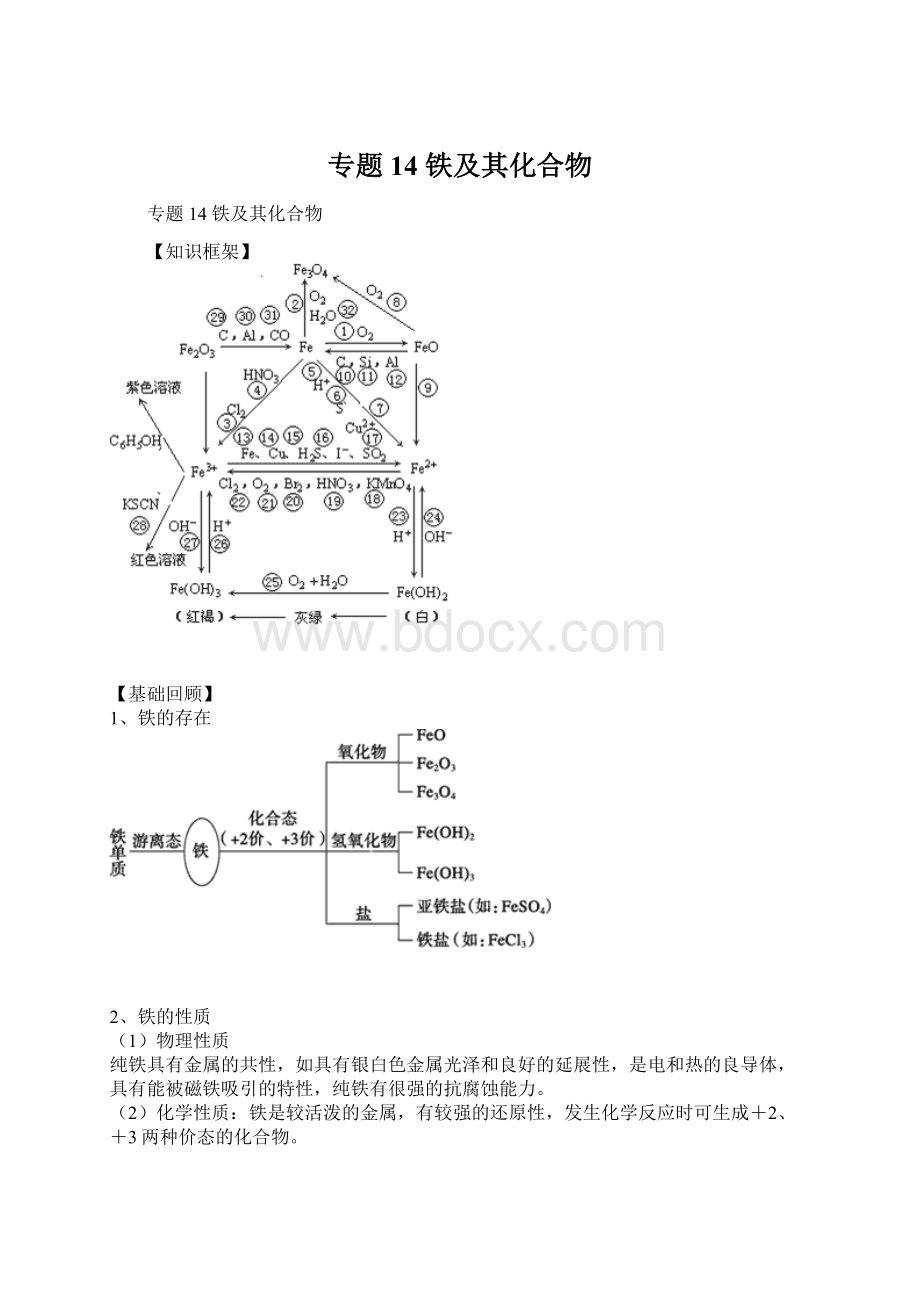
专题14铁及其化合物
专题14铁及其化合物
【知识框架】
【基础回顾】
1、铁的存在
2、铁的性质
(1)物理性质
纯铁具有金属的共性,如具有银白色金属光泽和良好的延展性,是电和热的良导体,具有能被磁铁吸引的特性,纯铁有很强的抗腐蚀能力。
(2)化学性质:
铁是较活泼的金属,有较强的还原性,发生化学反应时可生成+2、+3两种价态的化合物。
用化学方程式或离子方程式表示下列变化
Fe+H2O(g)
④3Fe+4H2O(g)=====高温Fe3O4+4H2
3、铁的氧化物的比较
4、Fe2+ 和Fe3+ 的比较
5、Fe(OH)2与Fe(OH)3的比较
【技能方法】
铁的变价及Fe2+、Fe3+的性质、检验
1、铁与硝酸反应
一是明确哪种物质过量,二是根据两种物质的量分析讨论判断,根据反应方程式:
HNO3过量:
Fe+4HNO3===Fe(NO3)3+NO↑+2H2O,
Fe过量时:
Fe+2Fe(NO3)3===3Fe(NO3)2,
两者相加得总方程式:
3Fe+8HNO3===3Fe(NO3)2+2NO↑+4H2O,可以用数轴表示:
解题时需注意量的范围。
即:
①
,产物仅有Fe(NO3)3,HNO3可能有剩余;
②:
,产物仅有Fe(NO3)2,Fe可能有剩余;
③:
①
,产物为Fe(NO3)3和Fe(NO3)2,Fe和HNO3都反应完全。
2、+2、+3价铁的化学性质
(1)Fe2+的氧化性和还原性
Fe2+处于铁的中间价态,既有氧化性,又有还原性。
在中学阶段接触Fe2+的氧化还原反应中其主要表现还原性,如:
Fe2+遇Br2、Cl2、H2O2、NO3-(H+)等均表现还原性。
(2)Fe3+的氧化性
Fe3+处于铁的高价态,表现较强的氧化性,如:
它能氧化Fe、Cu、HI、H2S等。
(3)Fe2+与Fe3+的相互转化
用离子方程式实现下列转化:
①2Fe2++Cl2===2Fe3++2Cl-;
②3Fe2++4H++NO3-===3Fe3++2H2O+NO↑;
③2Fe3++Fe===3Fe2+;
④Cu+2Fe3+===Cu2++2Fe2+。
3、+2铁和+3价铁的检验
(1)溶液颜色
含有Fe2+的溶液显浅绿色
含有Fe3+的溶液显黄色
(2)用KSCN溶液和氯水
①流程:
②有关反应:
Fe3++3SCN-
Fe(SCN)3(血红色)
2Fe2++Cl2===2Fe3++2Cl-
(3)用NaOH溶液
①流程:
②有关反应:
Fe3++3OH-===Fe(OH)3↓(红褐色沉淀)
Fe2++2OH-===Fe(OH)2↓(白色沉淀)
4Fe(OH)2+O2+2H2O===4Fe(OH)3
【基础达标】
1.向盛有氯化铁溶液的烧杯中加入过量的铜粉,反应结束后,溶液中大量存在的金属阳离子是( )
A.Fe2+ 、Cu2+
B.Fe2+、Fe3+
C.Fe3+、Cu2+
D.只有Cu2+
【答案】A
【解析】
试题分析:
氯化铁能溶解铜,反应的化学方程式为2FeCl3 +Cu=2FeCl2 +CuCl2,由于铜粉是过量的,且铜不能置换出铁,因此溶液中含有的金属离子是Cu2+、Fe2+,答案选A。
考点:
考查铁离子的化学性质
2.下列有关铁及其化合物的说法中正确的是( )
A.磁铁矿的主要成分是Fe2O3
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加过量铁粉,然后过滤
D.Fe3+与KSCN反应产生血红色沉淀
【答案】C
【解析】
试题分析:
赤铁矿的主要成分是Fe2O3,A错误;
铁与水蒸气高温条件下反应生成Fe3O4和H2,B错误;
C项中2FeCl3+Fe===3FeCl2,过滤可除去过量的铁粉,C正确;
Fe3+与SCN-反应形成血红色溶液而不是血红色沉淀,D错误。
考点:
铁及其化合物的性质
3.将铁屑溶于过量盐酸后,再加下列物质,会有三价铁生成的是( )
A.稀硫酸 B.氯气
C.氯化锌 D.氯化铜
【答案】B
【解析】
试题分析:
Fe溶于盐酸后发生反应:
Fe+2H+===Fe2++H2↑,而Fe2+遇强氧化剂会生成三价铁。
通过下列思考来分析各选项。
稀硫酸不能把Fe2+氧化成Fe3+,氯气能将溶液中的Fe2+氧化成为Fe3+;氯化锌、氯化铜溶液中的Zn2+、Cu2+有一定的氧化能力,其中Cu2+可以将金属铁氧化成Fe2+,但却不能将Fe2+氧化成Fe3+,Zn2+、Cu2+、Fe2+在溶液中可以大量共存。
考点:
铁的性质
4.Al、Fe、Cu都是重要的金属元素,下列说法正确的是( )
A.三者对应的氧化物均为碱性氧化物
B.三者的单质放置在空气中均只生成氧化物
C.制备AlCl3、FeCl3、CuCl2固体均不能采用将溶液直接蒸干的方法
D.电解AlCl3、FeCl3、CuCl2 的混合溶液时阴极上依次析出Cu、Fe、Al
【答案】C
【解析】
试题分析:
A、Al对应的氧化物是氧化铝,而氧化铝属于两性氧化物,错误;
B、Cu的单质放在空气中,可生成铜绿碱式碳酸铜,属于盐,错误;
C、水解的氯化物中,因为生成生成难溶碱和HCl,加热促进水解,同时HCl的挥发,也使水解正向移动,所以最终得到是难溶碱,不会得到氯化物固体,所以制备AlCl3、FeCl3、CuCl2固体均不能采用将溶液直接蒸干的方法,正确;
D、因为阳离子的氧化性Fe3+>Cu2+>Fe2+ >H+ >Al3+,所以电解AlCl3、FeCl3、CuCl2的混合溶液时,先是铁离子得到电子生成亚铁离子,其次是铜离子得到电子生成单质Cu,然后析出Fe,亚铁离子放电完全后,则是氢离子放电生成氢气,所以阴极上依次析出Cu、Fe、H2,错误,答案选C。
考点:
考查氧化物的类型的判断,盐水解产物的判断,电解产物的判断
5.铁和氧化铁的混合物共2mol,加盐酸后固体全部溶解,共收集到0.5molH2,且溶液中加入KSCN溶液不显红色,则原混合物中铁的物质的量为( )
A.0.5mol B.1.5mol
C.0.75mol D.1.25mol
【答案】D
【解析】
试题分析:
设混合物中铁和氧化铁的物质的量是xmol。
溶液中加入KSCN溶液不显红色,这说明溶液中不存在铁离子。
则有关反应的方程式为Fe+2HCl=FeCl2+H2↑、Fe2O3+6HCl=2FeCl3+3H2O、2FeCl3+Fe=3FeCl2,则x+x+0.5=2,解x=0.75,所以铁的物质的量是2mol—0.75mol=1.25mol,答案选D。
考点:
考查铁、氧化铁与盐酸反应的有关计算
【能力提升】
1.铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述沉淀和残渣分别是( )
A.Fe(OH)3 Fe2O3
B.Fe(OH)2 Fe2O3
C.Fe(OH)2 Fe(OH)3
D.Fe(OH)2 Fe3O4
【答案】B
【解析】
铁与稀硫酸生成FeSO4,再与过量氨水反应生成白色沉淀Fe(OH)2,在空气中加热Fe(OH)2,铁元素被氧化为+3,最后所得红棕色残渣为Fe2O3。
2.常温时,将0.1molFe(NO3)3和2molHCl溶于水得2L混合溶液,然后向该溶液投入m克铁粉使其充分反应后,滴加KSCN溶液不变红色。
下列有关说法正确的是( )
A.由于氧化性Fe3+>H+,首先发生的反应是:
Fe+2Fe3+=3Fe2+
B.当加入16.8g铁粉时,可生成标准状况下6.72L气体
C.在铁粉充分反应后的溶液中,铁元素以Fe2+和Fe3+的形式存在
D.m至少等于28g,反应过程中溶液的质量一直在减小
【答案】B
【解析】
试题分析:
根据题意知常温时,将0.1molFe(NO3)3和2molHCl溶于水得2L混合溶液,然后向该溶液投入m克铁粉发生反应依次为:
Fe+NO3- +4H+==Fe3+ +NO↑+2H2O,Fe+2Fe3+ ==3Fe2+ ,Fe+2H+====Fe2+ +H2↑。
A、由于氧化性HNO3>Fe 3+>H+,首先发生的反应是:
Fe+NO3- +4H+ ==Fe3+ +NO↑+2H2O,错误;
B、当加入16.8g铁粉时,只发生反应Fe+NO3- +4H+ ==Fe3+ +NO↑+2H2O,可生成标准状况下6.72LNO气体,正确;
C、在铁粉充分反应后的溶液中,滴加KSCN溶液不变红色,铁元素以Fe2+的形式存在,错误;
D、根据上述反应和题给数据分析m至少等于28g,反应过程中溶液的质量一直在增加,错误。
考点:
考查铁元素单质及其化合物的性质,根据化学方程式计算。
3.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。
下列说法正确的是( )
A.途径①和途径②都体现了硫酸的酸性和氧化性
B.Y可以是酒精溶液
C.CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体
D.将CuSO4溶液蒸发浓缩、冷却结晶,可制得胆矾晶体
【答案】D
【解析】
试题分析:
A.在Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,中硫酸表现氧化性和酸性;在2Cu+O2+2H2SO4
2CuSO4+2H2O中硫酸表现酸性,二者的作用性质不同,错误;
B.在CuSO4溶液中加入过量的NaOH溶液,发生复分解反应:
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;新制Cu(OH)2与乙醛在加热时发生反应产生Cu2O,错误;
C.CuSO4在1100℃分解产生Cu2O,Cu元素的化合价降低,根据氧化还原反应中电子转移数目可知应该有元素的化合价升高的,因此所得气体X可能含有O2,因此不可能是酯含有SO2和SO3,错误;
D.将CuSO4溶液蒸发浓缩、冷却结晶,可制得胆矾晶体,正确。
考点:
考查CuSO4的性质、应用的知识。
4.把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的物质的量浓度之比为1∶2。
则已反应的Fe3+和未反应的Fe3+的物质的量之比为()
A.1:
1 B.1:
2
C.1:
3 D.2:
3
【答案】C
【解析】
试题分析:
把一定量铁粉放入氯化铁溶液中,发生反应:
Fe+2Fe3+ =3Fe2+。
由于所得溶液中Fe2+和Fe3+的物质的量浓度之比为1∶2。
假设得到Fe2+为1mol,则反应消耗Fe3+的物质的量是2/3mol,所以已经反应的Fe3+和未反应的Fe3+的物质的量之比2/3mol:
2mol=1:
3。
故答案是C。
考点:
考查Fe元素的各种价态的化合物的计算的知识。
5.向某晶体的水溶液中加入Fe2+的溶液后,无明显变化,当滴加几滴溴水后,混合液出现血红色。
那么,由此得出下列的结论错误的是( )
A.该晶体中一定含有SCN-
B.Fe3+的氧化性比Br2的氧化性强
C.Fe2+被Br2氧化为Fe3+
D.Fe2+与SCN-不能形成血红色的化合物
【答案】B
【解析】
试题分析:
向某晶体的水溶液中加入Fe2+的溶液后,无明显变化,当滴加几滴溴水后,由于Br2具有氧化性,可将二价铁氧化为三价铁,而三价铁遇硫氰根离子出现血红色,所以该晶体中一定含有SCN-,Fe2+被Br2氧化为Fe3+ ,Fe3+的氧化性比Br2的氧化性弱,Fe2+与SCN-不能形成血红色的化合物;故本题选择B。
考点:
二价铁、三价铁之间的相互转化。
【终极闯关】
1.【福建省南安一中2015届期中考试】含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入0.1mol铁粉,充分搅拌后,Fe溶解,溶液中不存在Fe3+,同时析出0.1molAg,下列结论错误的是( )
A.溶液质量减轻
B.Fe3+的氧化性大于Cu2+
C.溶液中Cu2+与Fe2+的物质的量比为1∶1
D.Fe位于元素周期表第四周期Ⅷ族,是一种过渡金属
【答案】C
【解析】
试题分析:
A.向混合溶液中加入0.1mol铁粉,析出0.1molAg,铁的相对原子质量小于银的相对原子质量,所以溶液质量减轻,A项正确;
B.因加入Fe后,Fe3+ 、Ag+首先被还原,说明Fe3+氧化能力比Cu2+强,B项正确;
C.由Cu、Fe原子守恒知n(Cu2+)=0.1mol,而n(Fe2+)=n(Fe3+)+n(Fe)=0.2mol,溶液中Cu2+与Fe2+的物质的量比为1∶2,C项错误;
D.Fe位于元素周期表第四周期Ⅷ族,是一种过渡金属,D项正确;选C。
考点:
考查铁及其化合物的性质。
2.【吉林省东北附中2015届高三上学期第二次摸底考试】由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去)。
关于混合粉末的组成判断正确的是( )
A.一定含CuO和C
B.一定含Fe2O3、CuO和C
C.一定含CuO和C,一定不含Al
D.气体Z为纯净物
【答案】A
【解析】
试题分析:
根据实验现象,溶液X中加入过量铁粉得到溶液和两种固体,其中一种为红色,说明红色固体为Cu,则固体中一定含有CuO;加入浓酸后产生两种气体,若不含单质碳,浓酸为浓硫酸或浓硝酸,则Fe、Al与浓酸、加热反应,产生的气体只能是二氧化硫或二氧化氮一种,所以一定含有C单质,C与浓酸反应,浓酸被还原为二氧化硫或二氧化氮,C被氧化为二氧化碳。
所以固体中一定含有CuO和C,其余不能确定,气体Z的成分不能确定,所以答案选A。
考点:
考查物质的检验与鉴别。
3.【湖南省怀化市2015年高三第一次模拟考试理科综合能力测试】粗制的CuSO4•5H2O晶体中含有Fe2+。
提纯时,为了除去Fe2+,常加入少量H2O2,然后再加入少量碱至溶液pH=4,即可以除去铁离子而不损失硫酸铜。
下列说法不正确的是( )
A.溶解CuSO4•5H2O晶体时要加入少量稀H2SO4
B.加入H2O2,除Fe2+的离子方程式:
2Fe2+ +H2O2 +4OH- ==2Fe(OH)3
C.由于CuSO4的催化作用,会使部分H2O2分解而损失
D.调溶液pH=4的依据是当pH=4时Fe(OH)3沉淀完全,而Cu(OH)2还未开始沉淀
【答案】B
【解析】
试题分析:
A、硫酸铜溶解后生成的铜离子会发生水解生成氢氧化铜和硫酸,所以溶解时加入少量的稀硫酸可抑制铜离子的水解,正确;
B、因为氧化亚铁离子时,溶液为酸性,在酸性条件下,不可能生成氢氧化铁沉淀,错误;
C、铜离子对过氧化氢的分解具有催化作用,所以使部分过氧化氢流失,正确;
D、因为该操作的目的是除去铁离子而硫酸铜不损失,所以调节溶液的pH=4时,应是氢氧化铁完全沉淀而氢氧化铜还未沉淀,正确,答案选B。
考点:
考查对物质制备的分析,物质性质的应用
4.【2015新课标Ⅰ卷理综化学】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
【答案】D
【解析】
试题分析:
A、稀硝酸与过量的Fe分反应,则生成硝酸亚铁和NO气体、水,无铁离子生成,所以加入KSCN溶液后,不变红色,现象错误;
B、Cu与硫酸铁发生氧化还原反应,生成硫酸铜和硫酸亚铁,无黑色固体出现,现象错误;
C、铝在空气中加热生成氧化铝的熔点较高,所以内部熔化的铝不会滴落,现象错误;
D、硫酸镁与氢氧化钠溶液反应生成氢氧化镁沉淀(硫酸镁足量是关键信息),再加入硫酸铜,则生成氢氧化铜蓝色沉淀,沉淀的自发转化应该由溶解度小的向溶解度更小的沉淀转化,所以氢氧化铜的溶度积比氢氧化镁的溶度积小,正确,答案选D。
考点:
中学常见实验、常见反应的定性考查;难度为一般等级
5.【2015浙江理综化学】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4•7H2O),设计了如下流程:
下列说法不正确的是( )
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C.从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解
D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O
【答案】D
【解析】
试题分析:
A、流程设计意图是用硫酸把Fe2O3、Al2O3,转化为硫酸盐,除去SiO2,然后用铁粉还原Fe3+得到硫酸亚铁,A正确;
B、固体1为SiO2,分离FeSO4和Al2(SO4)3采用的是调控pH的方法,使Al3+转化为Al(OH)3沉淀从而与FeSO4分离,B不正确;
C、Fe2+容易被氧化,所以在得到FeSO4•7H2O产品的过程中,要防止其被氧化和分解,C正确;
D、在溶液1中直接加过量的NaOH得到的是Fe(OH)2沉淀,但Fe(OH)2不稳定,很容易被氧化为Fe(OH)3,这样的话,最终所得的产品不纯,混有较多的杂质Fe2(SO4)3,D不正确。
答案选D。
考点:
本题以流程图的形式考查离子反应、物质分离、实验流程、实验评价、实验条件控制等。
涉及试剂的选择、溶液pH控制、硫酸亚铁性质、实验条件选择和控制等。