优等生高考化学专题4电化学问题的综合探究.docx
《优等生高考化学专题4电化学问题的综合探究.docx》由会员分享,可在线阅读,更多相关《优等生高考化学专题4电化学问题的综合探究.docx(12页珍藏版)》请在冰豆网上搜索。
优等生高考化学专题4电化学问题的综合探究
优等生�高考化学专题4:
电化学问题的综合探究
学校:
___________姓名:
___________班级:
___________考号:
___________
评卷人
得分
一、综合题
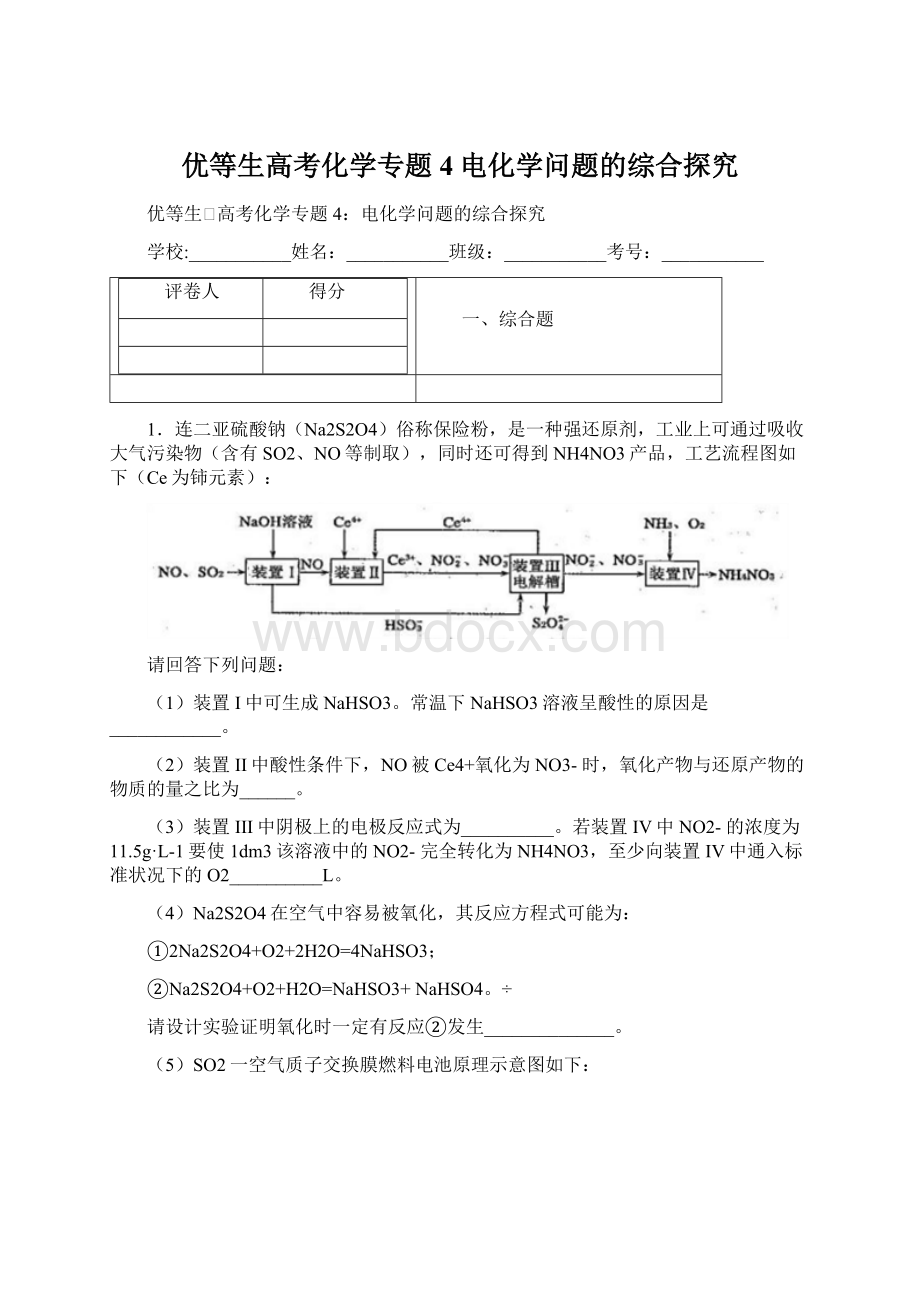
1.连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂,工业上可通过吸收大气污染物(含有SO2、NO等制取),同时还可得到NH4NO3产品,工艺流程图如下(Ce为铈元素):
请回答下列问题:
(1)装置I中可生成NaHSO3。
常温下NaHSO3溶液呈酸性的原因是____________。
(2)装置II中酸性条件下,NO被Ce4+氧化为NO3-时,氧化产物与还原产物的物质的量之比为______。
(3)装置III中阴极上的电极反应式为__________。
若装置IV中NO2-的浓度为11.5g·L-1要使1dm3该溶液中的NO2-完全转化为NH4NO3,至少向装置IV中通入标准状况下的O2__________L。
(4)Na2S2O4在空气中容易被氧化,其反应方程式可能为:
①2Na2S2O4+O2+2H2O=4NaHSO3;
②Na2S2O4+O2+H2O=NaHSO3+NaHSO4。
÷
请设计实验证明氧化时一定有反应②发生______________。
(5)SO2一空气质子交换膜燃料电池原理示意图如下:
质子的流动方向为____________(“从A到B”或“从B到A”),负极的电极反应式为____________________。
2.电镀行业产生的酸性含铬废水对环境有污染,其中所含的Cr(VI)是主要污染物,可采用多种方法处理将其除去。
查阅资料可知:
①在酸性环境下,Cr(VI)通常以Cr2O72-的形式存在,Cr2O72-+H2O
2CrO42-+2H+
②Cr2O72-的氧化能力强于CrO42-
③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
阳离子
Fe3+
Fe2+
Cr3+
开始沉淀的pH
1.9
7.0
4.3
沉淀完全的pH
3.2
9.0
5.6
I.腐蚀电池法
(1)向酸性含铬废水中投放废铁屑和焦炭,利用原电池原理还原Cr(VI)。
下列关于焦炭的说法正确的是________(填字母序号)。
a.作原电池的正极b.在反应中作还原剂c.表面可能有气泡产生
II.电解还原法
向酸性含铬废水中加入适量NaCl固体,以Fe为电极电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。
装置如右图所示。
(2)A极连接电源的________极,A极上的电极反应式是________。
(3)电解开始时,B极上主要发生的电极反应为2H++2e-=H2↑,此外还有少量Cr2O72-在B极上直接放电,该反应的电极反应式为________。
(4)电解过程中,溶液的pH不同时,通电时间(t)与溶液中Cr元素去除率的关系如右图所示。
①由图知,电解还原法应采取的最佳pH范围为________。
a.2~4b.4~6c.6~10
②解释曲线I和曲线IV去除率低的原因:
________。
3.CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。
I、甲醇可以补充和部分替代石油燃料,缓解能源紧张。
利用CO可以合成甲醇。
(1)已知:
CO(g)+1/2O2(g)=CO2(g)△H1=-283.0kJ·mol-1
H2(g)+1/2O2(g)=H2O(l)△H2=-285.8kJ·mol-1
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l)△H3=-764.5kJ·mol-1
则CO(g)+2H2(g)=CH3OH(g)△H=____________kJ·mol-1
(2)一定条件下,在容积为2L的密闭容器中充入1molCO与2molH2合成甲醇平衡转化率与温度、压强的关系如右图所示。
①在2min时测得容器内甲醇的浓度为0.25mol·L-1,则0-2min内CO的平均反应速率为____mol·L-1·min-1,H2的转化率为____。
②由图判断P1_______P2(填“>”、“<”或“=”),理由是____________________________________
③该甲醇合成反应在A点的平衡常数K=____
④下列措施中能够同时满足增大反应速率和提高CO转化率的是____。
(填写相应字母)
A、使用高效催化剂b、降低反应温度c、增大体系压强
D、不断将CH3OH从反应混合物中分离出来
Ⅱ、某学习小组以SO2为原料,采用电化学方法制取硫酸。
(3)原电池法:
该小组设计的原电池原理如右图所示。
该电池中右侧为________极,写出该电池负极的电极反应式____。
(4)电解法:
该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。
原理如右图所示。
写出开始电解时阳极的电极反应式____________________
4.
(1)已知:
2SO2(g)+O2(g)
2SO3(g)△H=-XkJ/mol;
2NO(g)+O2(g)
2NO2(g)△H=-YkJ/mol。
则反应NO(g)+SO2(g)
SO3(g)+NO(g)的△H=______kJ/mol。
(2)甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出热量222.5kJ,则甲烷燃烧的热化学方程式为____________。
(3)以KOH溶液为电解质溶液,依据
(2)中反应设计一个原电池,其负极反应式为_______;以H2SO4溶液为电解质溶液,将甲烷燃料电池中的甲烷改为C2H5OH,其负极反应式为_________。
(4)以上述甲烷燃料电池为电源,用铂电极电解1LCu(NO3)2和KNO3混合溶液,通电一段时间,两极均产生11.2L(标准状况)气体。
则电解后溶液的pH为______(电解过程中溶液体积不变),原混合溶液中Cu2+的物质的量浓度为___________,假设电解过程中能量利用率为80%,在甲烷燃料电池中消耗的甲烷在标准状况下的体积为________L。
5.开发新能源是解决环境污染的重要举措,其中甲醇、乙醇、甲烷都是优质的清洁燃料,可制作燃料电池。
(1)已知:
①C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)ΔH1=-1366.8kJ/mol
②2CO(g)+O2(g)=2CO2(g)ΔH2=-566.0kJ/mol
③H2O(g)=H2O(l)ΔH3=-44kJ/mol。
乙醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:
______________________。
(2)可利用甲醇燃烧反应设计一个燃料电池。
如下图1,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气。
①写出燃料电池负极的电极反应式_________________。
②若利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件应是_______极(填“A”或“B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为________L。
(3)某研究小组将两个甲烷燃料电池串联后如上图2作为电源,进行饱和氯化钠溶液电解实验若每个电池甲烷通入量为1L(标准状况),且反应完全,则理论上通过电解池的电量表达式为_____________(法拉第常数F=9.65×l04C/mol),最多能产生的氯气体积为_____L(标准状况)。
(4)电解法可消除甲醇对水质造成的污染,原理是:
通电将Co2+在阳极氧化成Co3+,生成的Co3+将甲醇氧化成CO2和H+(用石墨烯除去Co2+),现用如图3所示装置模拟上述过程,则Co2+在阳极的电极反应式为________________________除去甲醇的离子方程式为______________________________。
6.金属镁可用于制造合金、储氢材料、镁电池等。
已知:
C(s)+
O2(g)=CO(g)△H=-110.5kJ/mol;
Mg(g)+
O2(g)=MgO(s) △H=-732.7kJ/mol。
(1)一种制备镁的反应为MgO(s)+C(s)=Mg(g)+CO(g),该反应的△H=____________。
(2)一种用水氯镁石(主要成分为MgC12·6H2O) 制各金属镁工艺的关键流程如下:
①为探究MgCl2·6H2O“一段脱水”的合理温度范围,某科研小组将MgCl2·H2O在不同温度下分解,测得残留固体物质的X-射线衔射谱图如下图所示(X-射线衔射可用于判断某晶态物质是否存在)。
测得E中Mg元素质量分数为60.0%,则E 的化学式为_____。
“一段脱水”的目的是制备MgC12·2H2O,温度不高于180℃的原因是_______________。
②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。
生成MgO的化学方程式为_________________。
③该工艺中,可以循环使用的物质有_______________。
(3)Mg2Ni是一种储氢材料。
2.14gMg2Ni在一定条件下能吸收0.896LH2 (标准状况下)生成X,X的化学式为______________。
(4)“镁—次氯酸盐”燃料电池的装置如图所示,该电池反应的总反应方程式为__________。
参考答案
1.HSO3-在溶液中存在电离平衡和水解平衡:
HSO3-
SO32-+H+,HSO3-+H2O
H2SO3+OH-,由于HSO3-的电离程度大于水解程度,故溶液中的c(H+)>c(OH-),溶液呈酸性1:
32HSO3-+2e-+2H+=S2O42-+2H2O2.8取少量固体溶于水中,加入BaCl2溶液,有白色沉淀产生,则证明是②(或取少量固体溶于水中,若闻到刺激性气味,则证明是②)从A到BSO2-2e-+2H2O=SO42-+4H+
【解析】
(1)在NaHSO3溶液中HSO3-即电离又水解:
HSO3-
SO32-+H+,H2O
H2SO3+OH-,由于HSO3-的电离程度大于水解程度,故溶液中的C(H+)>c(OH-),溶液呈酸性
(2)NO被氧化为硝酸根,Ce4+被还原为Ce3+,酸性环境,缺氧补水,缺氢补氢离子,反应的离子方程式为NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,氧化产物NO3-与还原产物Ce3+的物质的量之比为1:
3;
(3)电解槽阴极发生还原反应,SO32-被还原为S2O42-,电极反应式为:
2SO32-+2H2O-2e-═S2O42-+4OH-;NO2-的浓度为11.5g•L-1,要使1dm3该溶液中的NO2-完全转化为NH4NO3,则失去电子数目是:
×2,设消耗标况下氧气的体积是V,则得到电子数目是:
×4,根据电子守恒:
×2=
×4,解得V=2.8L;
(4)取少量固体溶于水中,加人BaCl2溶液,有白色沉淀产生,此沉淀为BaSO4,说明溶液中含有SO42-,即可证明氧化时一定有反应②发生;
(5)二氧化硫发生氧化反应,氧气发生还原反应,所以二氧化硫所在电极为负极,氧气所在电极为正极,原电池中阳离子移向正极,所以质子移动方向为:
从A到B;负极上SO2被氧化为SO42-时发生的电极反应为SO2-2e-+2H2O=SO42-+4H+。
2.ac正Fe–2e-
Fe2+Cr2O72-+6e-+14H+
2Cr3++7H2Ob曲线I的pH较小,此时Cr(IV)被还原生成的Cr3+难以生成Cr(OH)3沉淀,仍以Cr3+存在于溶液中,导致去除率较低;曲线IV的pH较大,铬元素主要以CrO42-存在,其氧化能力弱于Cr2O72-,Cr(IV)难以被还原继而生成沉淀,导致去除率较低
【解析】I.
(1).向酸性含铬废水中投放废铁屑和焦炭,利用原电池原理还原Cr(VI),Fe在反应中失电子作负极,则焦炭为正极,正极材料被保护,Cr2O72-在正极得到电子生成Cr3+,当Cr2O72-完全反应后,溶液中的H+也可能在正极得到电子生成H2,故答案为:
ac;
II.
(2).向酸性含铬废水中加入适量NaCl固体,以Fe为电极电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,因Fe为电极进行电解时,阳极是活性电极,则Fe失电子,由装置图可知,A为阳极,则A连接电源的正极,在A极上发生的反应为:
Fe–2e-=Fe2+,故答案为:
正;Fe–2e-=Fe2+;
(3).根据题目信息可知,Cr2O72-在B极上得电子生成Cr3+,该反应的电极反应式为Cr2O72-+6e-+14H+=2Cr3++7H2O,故答案为:
Cr2O72-+6e-+14H+=2Cr3++7H2O;
(4).①.据图可知,当溶液的pH处于4~6时,Cr元素去除率较高,故答案为:
b;
②.根据题中所给阳离子以氢氧化物形式沉淀时溶液的pH可知,曲线I的pH较小,此时Cr(IV)被还原生成的Cr3+难以生成Cr(OH)3沉淀,仍以Cr3+存在于溶液中,导致去除率较低,曲线IV的pH较大,铬元素主要以CrO42-存在,其氧化能力弱于Cr2O72-,Cr(IV)难以被还原而生成沉淀,导致去除率较低,故答案为:
曲线I的pH较小,此时Cr(IV)被还原生成的Cr3+难以生成Cr(OH)3沉淀,仍以Cr3+存在于溶液中,导致去除率较低;曲线IV的pH较大,铬元素主要以CrO42-存在,其氧化能力弱于Cr2O72-,Cr(IV)难以被还原继而生成沉淀,导致去除率较低。
3.-90.10.12550%<甲醇的合成反应是气体分子数减小的反应,相同温度下,增大压强转化率提高48C正SO2-2e-+2H2O=SO42-+4H+HSO3--2e-+H2O=SO42-+3H+
【解析】I、
(1)已知:
①CO(g)+1/2O2(g)=CO2(g)△H1=-283.0kJ·mol-1
②H2(g)+1/2O2(g)=H2O(l)△H2=-285.8kJ·mol-1
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l)△H3=-764.5kJ·mol-1
由①+②
2-③得CO(g)+2H2(g)=CH3OH(g),所以△H=(-283.0kJ·mol-1)+(-285.8kJ·mol-1)
2-(-764.5kJ·mol-1)=-90.1kJ·mol-1.
(2)①一定条件下,在容积为2L的密闭容器中充入1molCO与2molH2合成甲醇,则CO与H2的起始浓度分别为0.5mol/L和1mol/L。
CO(g)+2H2(g)=CH3OH(g),在2min时测得容器内甲醇的浓度为0.25mol·L-1。
由化学方程式可知,0-2min内CO浓度的变化量与甲醇相同,则用CO表示的平均反应速率为
=0.125mol·L-1·min-1。
反应物的投料比与化学计量为数之比相同,所以H2的转化率与CO相同,均为
.
②由图判断P1③由图像可知,该甲醇合成反应中CO的转化率在A点为0.75,CO与H2、甲醇的浓度变化量分别为0.375mol/L和0.75mol/L、0.375mol/L,CO与H2的平衡浓度分别为0.125mol/L和0.25mol/L,平衡常数K=
48.
④增大体系压强能够同时满足增大反应速率和提高CO转化率,选C。
Ⅱ、(3)由图中信息可知,左侧二氧化硫发生氧化反应生成硫酸根,右侧氧气发生还原反应生成水,总反应为2SO2+O2+2H2O=2H2SO4。
因此,该电池中右侧为正极,该电池负极的电极反应式为SO2-2e-+2H2O=SO42-+4H+。
(4)由图中信息可知,在阳极室中,硫酸氢根被氧化为硫酸根离子;在阴极室中,氢离子放电生成氢气发生还原反应。
所以,开始电解时阳极的电极反应式HSO3--2e-+H2O=SO42-+3H+。
4.
CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=−890kJ/molCH4+10OH−−8e−=
+7H2OC2H5OH−12e−+3H2O=2CO2+12H+00.5mol/L7
【解析】
(1)①2S02(g)+O2(g)
2S03(g)△H=-XkJ/mol;②2NO(g)+O2(g)
2NO2(g)△H=-YkJ/mol。
由(②-①)/2得,NO(g)+SO2(g)
SO3(g)+NO(g),则反应的△H=
kJ/mol。
(2)由0.25mol甲烷完全燃烧生成液态水时放出热量222.5kJ,可以求出1mol甲烷完全燃烧生成液态水时放出热量890kJ,则甲烷燃烧的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=−890kJ/mol。
(3)以KOH溶液为电解质溶液,依据
(2)中反应设计一个原电池,则总反应为CH4+2O2+2OH-=
+3H2O(l),其正极反应为2O2+4e-+4H2O=4OH-,所以负极反应式为CH4+10OH−−8e−=
+7H2O;以H2SO4溶液为电解质溶液,将甲烷燃料电池中的甲烷改为C2H5OH,其负极反应式为C2H5OH−12e−+3H2O=2CO2+12H+。
(4)以上述甲烷燃料电池为电源,用铂电极电解1LCu(NO3)2和KNO3混合溶液,通电一段时间,两极均产生11.2L(标准状况)气体,根据电解原理可知,阳极生成氧气、阴极生成氢气,其物质的量均为0.5mol。
由于阳极只有氢氧根离子放电生成氧气,由阳极的电极反应式2H2O-4e-=O2↑+4H+可知,生成0.5molO2时转移电子2mol。
根据电子转移守恒可知,阴极生成0.5molH2时,转移1mole-,所以阴极一定还析出了0.5molCu。
由析出铜的总反应2Cu2++2H2O=O2↑+2Cu+4H+可知,阴极析出0.5molCu的同时生成1molH+,则电解后溶液中c(H+)=1mol/L,所以溶液的pH为0,原混合溶液中Cu2+的物质的量浓度为0.5mol/L。
因为电解过程中能量利用率为80%,则在甲烷燃料电池中转移电子的物质的量为2mol
80%=2.5mol,消耗的甲烷的物质的量为2.5mol
8=0.3125mol,0.3125mol甲烷在标准状况下的体积为7L。
点睛:
本题考查的燃料电池负极反应式的书写是一个难点,直接书写一般是比较困难的,而正极的电极反应式通常比较简单。
所以,我们通常先写出总反应,然后写正极反应式,最后用总反应减去正极反应式,即可得到负极反应式。
要注意溶液的酸碱性对电极反应极总反应的影响。
对于电解后溶液的pH计算,要根据电解总反应进行,不能仅根据阳极反应或阴极反应进行,因为忽略溶液体积变化,在电解水的过程中,溶液中氢离子和氢氧根离子的物质的量都是不变的。
5.C2H5OH(l)+2O2(g)=2CO(g)+3H2O(l)ΔH1=-932.8kJ/molCH3OH-6e-+8OH-=CO32-+6H2OB1.12
4Co2+-e-=Co3+(或6Co2+-6e-=6Co3+)6Co3++CH3OH+H2O=6Co2++CO2↑+6H+
【解析】
(1)已知:
①C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)ΔH1=-1366.8kJ/mol,②2CO(g)+O2(g)=2CO2(g)ΔH2=-566.0kJ/mol,③H2O(g)=H2O(l)ΔH3=-44kJ/mol。
乙醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:
由盖斯定律方程式①-②+③×3得到C2H5OH(l)+2O2(g)=2CO(g)+3H2O(l)ΔH1=(-1366.8kJ·mol-1)-(-566kJ·mol-1)+(-44kJ·mol-1)×3=--932.8kJ/mol。
(2)①CH3OH作还原剂,失电子,燃料电池负极的电极反应式:
CH3OH-6e-+8OH-=CO32-+6H2O;②若利用该燃料电池提供电源,与图1右边烧杯相连,B与电池的负极相连,是阴极,A是阳极;在铁件表面镀铜,则铁件应是阴极,故选B。
根据得失电子守恒:
2Cu~O2,当铁件的质量增重6.4g时,燃料电池中消耗氧气6.4g/(2×64g·mol-1)==0.05mol,标准状况下体积为22.4L·mol-1×0.05mol=1.12L;(3)根据得失电子守恒,可得:
1molCH4~8mole-~4molCl2,故若每个电池甲烷通入量为1L(标准状况),生成4LCl2;电解池通过的电量为
×8×9.65×l04C·mol-1=3.45×104C(题中虽然有两个燃料电池,但电子的传递量只能用一个池的甲烷量计算)。
(5)通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:
6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。
6.+622.2kJ/molMgO若温度太高,MgCl2转化为MgOHC1或MgO2MgOHC1+Mg=2MgO+MgCl2+H2↑HC1、Cl2Mg2NiH4Mg+C1O-+H2O==Mg(OH)2+C1-
【解析】
(1)①C(s)+
O2(g)=CO(g)△H=-110.5kJ/mol;②Mg(g)+
O2(g)=MgO(s) △H=-732.7kJ/mol。
由①-②得,MgO(s)+C(s)=Mg(g)+CO(g),所以该反应的△H=(-110.5kJ/mol)-(-732.7kJ/mol)=+622.2kJ/mol。
(2)①由题意可知,图中各峰线代表的都是某种纯净物。
因为MgCl2·6H2O在加热过程中可以溶解在其结晶水中并发生水解,而且温度越高其水解程度越大,水解生成的氢氧化镁在受热时会发生分解生成氧化镁。
因为MgO中Mg元素质量分数为60.0%,现测得E中Mg元素质量分数为60.0%,所以E 可确定为MgO。
“一段脱水”的目的是制备MgC12·2H2O,由图中信息及前面推断结果可知,在129℃“一段脱水”的主要产物是MgC12·2H2O,在235℃和415℃脱水的主要产物分别为MgOHC1和MgO,所以温度不高于180℃的原因是:
若温度太高,MgCl2转化为MgOHC1或MgO。
②由题意知,MgOHCl与Mg反应,生成MgO钝化膜,镁的化合价升高了,只有H元素的化合价可以降低,故生成MgO的化学方程式为2MgOHC1+Mg=2MgO+MgCl2+H2↑。
③该工艺中,二段脱水需要HCl气流抑制氯化镁发生水解反应,脱水的产物中含有HCl;HCl是由氯气和氢气合成的,电解熔融的氯化镁可以得到Cl2,所以可以循环使用的物质有HC1、Cl2。
(3)Mg2Ni是一种储氢材料。
2.14gMg2Ni在一定条件下能吸收0.896LH2 (标准状况下)生成X。
2.14gMg2Ni的物质的量为0.02mol,其中含n(Mg)=0.04m