化学必修实验现象总结.docx
《化学必修实验现象总结.docx》由会员分享,可在线阅读,更多相关《化学必修实验现象总结.docx(12页珍藏版)》请在冰豆网上搜索。
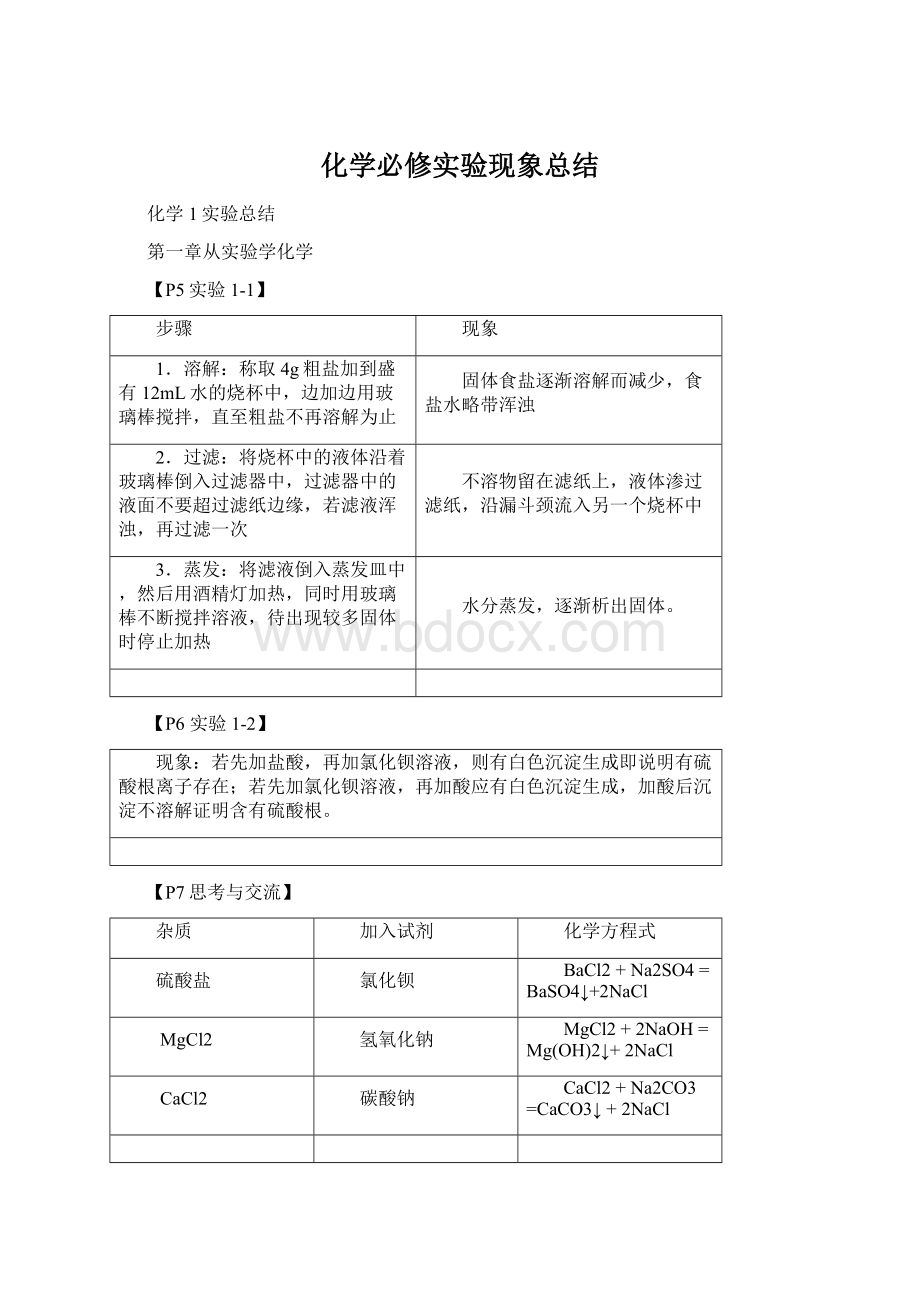
化学必修实验现象总结
化学1实验总结
第一章从实验学化学
【P5实验1-1】
步骤
现象
1.溶解:
称取4g粗盐加到盛有12mL水的烧杯中,边加边用玻璃棒搅拌,直至粗盐不再溶解为止
固体食盐逐渐溶解而减少,食盐水略带浑浊
2.过滤:
将烧杯中的液体沿着玻璃棒倒入过滤器中,过滤器中的液面不要超过滤纸边缘,若滤液浑浊,再过滤一次
不溶物留在滤纸上,液体渗过滤纸,沿漏斗颈流入另一个烧杯中
3.蒸发:
将滤液倒入蒸发皿中,然后用酒精灯加热,同时用玻璃棒不断搅拌溶液,待出现较多固体时停止加热
水分蒸发,逐渐析出固体。
【P6实验1-2】
现象:
若先加盐酸,再加氯化钡溶液,则有白色沉淀生成即说明有硫酸根离子存在;若先加氯化钡溶液,再加酸应有白色沉淀生成,加酸后沉淀不溶解证明含有硫酸根。
【P7思考与交流】
杂质
加入试剂
化学方程式
硫酸盐
氯化钡
BaCl2+Na2SO4=BaSO4↓+2NaCl
MgCl2
氢氧化钠
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
CaCl2
碳酸钠
CaCl2+Na2CO3=CaCO3↓+2NaCl
【P8实验1-3】
实验
现象
1.略
加硝酸银有不溶于稀硝酸的白色沉淀生成
2.略
加热,烧杯中的水温升高至100℃后沸腾。
在锥形瓶中收集到蒸馏水
3.略
加入稀硝酸和硝酸银溶液,蒸馏水中无沉淀生成
【P9实验1-4】
(1)加四氯化碳,四氯化碳不溶于水,密度比水大,在下层。
(2)用力振荡的目的是使水与四氯化碳充分混合
(3)静置后四氯化碳层变紫色,水层黄色变浅或近无色。
【P19归纳与整理】
一、混合物的分离提纯
分离和提纯的方法
分离的物质
应用举例
过滤
从液体中分离出不溶的固体物质
净化食盐水
蒸发
从溶液中分离已溶解的溶质
从海水中提取食盐
蒸馏
从溶液中分离溶剂和非挥发性溶质
从海水中获得纯水
萃取
加入适当溶剂把混合物中某成分溶解及分离
用四氯化碳提取水溶液中的碘
二、离子的检验
离子
检验试剂
实验现象
化学方程式
SO42-
HCl
BaCl2
有不溶于稀盐酸的白色沉淀生成
Ba2++SO42—==BaSO4↓
CO32-
HCl
加入盐酸后,有使澄清石灰水变浑浊的无色无味气体生成
CO32—+2H+==CO2↑+H2O
CO2+Ca2++2OH—==CaCO3↓+H2O
第二章化学物质及其变化
【P26《科学探究》】
光束照射时的现象
1.略
有一条光亮的“通路”
2.略
看不到此现象(没有一条光亮的“通路”)
过滤后的现象
3.略
液体全部透过滤纸,滤液仍为红褐色透明
4.略
有固体小颗粒没有透过滤纸,滤液呈无色透明
【P29习题5、完成下列表格】
分散系
分散质粒子大小
主要特征
举例
浊液
>100nm
不稳定、不均一
泥水
溶液
<1nm
稳定、均一
食盐水
胶体
1~100nm
介稳体系、均一
雾
【P31实验2-1】
实验
现象
1.略
没有白色沉淀产生
2.略
有白色沉淀产生
【P33实验2-3】
现象及离子方程式
1.略
产生蓝色絮状沉淀Cu2++2OH—=Cu(OH)2↓
2.略
溶液变红,红色消失变为无色OH—+H+=H2O
3.略
有无色无味气泡产生CO32—+2H+=H2O+CO2↑
化合反应、分解反应
置换反应、复分解反应
【P40二、物质的化学变化】
1、
离子反应和非离子反应
氧化还原反应和
非氧化还原反应
第三章金属及其化合物
【P46思考与交流】
1.
⑴金属与氧气反应
点燃
3Fe+2O2=====Fe3O4
⑵金属与酸反应
Zn+2HCl=ZnCl2+H2↑
⑶金属与盐溶液反应
Cu+2AgNO3=Cu(NO3)2+2Ag
2.
2Al+3CuSO4=Al2(SO4)3+3Cu
2Mg+O2
2MgO
Cu+2AgNO3=Cu(NO3)2+2Ag
Mg+2HCl=MgCl2+H2↑
3.
最外层电子数都比较少,在化学反应中都较容易失去最外层电子而表现出较强的还原性
【P47实验3-1】
金属钠是银白色、有金属光泽的固体,硬度小。
密度比水小比煤油大,少量金属钠保存在煤油中。
【P49实验3-3】
钠浮在水面,熔成小球在液面上迅速游动;钠球周围有水雾,有时可能有火花,或伴有
爆鸣声;钠球在反应中逐渐变小,最后消失;加有酚酞的溶液变成红色。
P50画出你设计的装置图
【P51实验3-4】
现象
化学方程式
1、加热时试管内铁粉红热
2、点燃肥皂泡可听到爆鸣声
3、反应后,试管内的固体呈黑色
略
【P55实验3-5】
滴入水后有大量气泡产生;气体使带火星的木条复燃;试管外壁发热;向试管里滴入酚酞溶液后,溶液颜色变红。
【P56科学探究】
(1)
步骤
1克Na2CO3
1克NaHCO3
加1mL水
白色粉末,加水结块成晶体;放热
细小白色粉末,加水部分溶解;感受不到热量变化
加10mL水
振荡时间长,可溶解
固体量减小
加1-2滴酚酞溶液
溶液变红(较深)
溶液变微红色
初步结论
加水先变成含结晶水的晶体,溶液碱性比NaHCO3的强
加水部分溶解,溶液碱性比Na2CO3的弱
(2)
现象
发生反应的化学方程式
结论
Na2CO3
澄清的石灰水不浑浊
受热不分解
NaHCO3
澄清的石灰水变浑浊
受热易分解
(3)
CO32-+2H+=H2O+CO2↑
HCO3-+H+=H2O+CO2↑
【P60实验3-9】
FeCl3溶液
FeSO4溶液
加NaOH溶液
生成红褐色的沉淀
先生成白色絮状沉淀,迅速变为灰绿色,最后变红褐色
离子方程式
Fe3++3OH-=Fe(OH)3↓
Fe2++2OH-=Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
【P61实验3-10】
滴入KSCN溶液
FeCl3溶液
溶液呈红色
FeCl2溶液
溶液颜色无变化
【P61科学探究】
现象
反应的离子方程式
FeCl3溶液中加铁粉、KSCN溶液
不显红色
2Fe3++Fe=3Fe2+
向上层清液中加入氯水,振荡
溶液显红色
2Fe2++Cl2=2Fe3++2Cl-
【P62实践活动】
不加试剂
加入明矾
加入硫酸铁溶液
2min
无明显变化
有明显沉降,溶液半透明
有明显沉降,溶液半透明
5min
浑浊,略有沉淀
沉淀沉在底部,溶液接近透明(比加硫酸铁的透明)
沉淀沉在底部,溶液接近透明
第四章非金属及其化合物
【P76思考与交流】
SiO2物理性质:
熔点高、硬度大
SiO2化学稳定性:
化学稳定性好
SiO2的性质主要与它的结构有关:
SiO2是正四面体的空间网状结构,因此性质很稳定
【P77实验4-1】
现象
在Na2SiO3溶液中滴加酚酞溶液呈红色,加入稀盐酸,有透明的硅酸凝胶产生
结论
Na2SiO3溶液显碱性,
化学方程式
略
【P77实验4-2】
放入蒸馏水
放入Na2SiO3饱和溶液
现象
水分蒸发后就燃烧
水分蒸发后不易燃烧(滤纸只起泡)
结论
水分蒸发后失去防火作用
防火效果好,用作防火剂
【P80习题2】
材料
物理性质
化学性质
玻璃
硬度高、耐磨损、耐高温、较脆
化学性质很稳定
陶瓷
硬度高、耐磨损、耐高温
化学性质很稳定
【P83实验4-3】
现象
化学方程式
H2在Cl2中安静的燃烧,发出苍白色的火焰,瓶口有白雾。
H2+Cl2
2HCl
【P84实验4-4】
现象
有色布条褪色
结论与解释
氯气与水反应生成次氯酸,次氯酸有漂白作用。
【P84实验4-5】
现象
有色布条不褪色
结论与解释
干燥的氯气没有漂白性
【P86实验4-6】
实验现象
解释或离子方程式
加入AgNO3溶液后
加入稀硝酸后
稀盐酸
生成白色沉淀
白色沉淀不溶解
Ag++Cl—==AgCl↓
NaCl溶液
生成白色沉淀
白色沉淀不溶解
Ag++Cl—==AgCl↓
Na2CO3
溶液
生成白色沉淀
白色沉淀溶解,有无色无味气体生成
2Ag++CO32—==Ag2CO3↓
Ag2CO3+2H+==2Ag++H2O+CO2↑
自来水
生成白色沉淀
白色沉淀不溶解
Ag++Cl—==AgCl↓
蒸馏水
无明显变化
无明显变化
蒸馏水中没有氯离子
【P87习题2】
现象
解释或离子方程式
滴入AgNO3溶液
有白色沉淀生成
Ag++Cl—==AgCl↓
滴在蓝色石蕊试纸上
试纸先变红后褪色
氯水具有酸性和漂白性
滴入红墨水
红墨水褪色
氯水具有漂白性
【P90实验4-7】
现象:
将盛有SO2的试管倒立在水中,试管内水面上升。
用PH试纸测定溶液的酸碱度,溶液显酸性。
在溶液中滴入品红溶液,品红溶液褪色。
给褪色后的溶液加热,溶液恢复红色。
在实验过程中,闻到刺激性气味。
【P92科学探究】
实验步骤
现象
解释(可用化学方程式表示)
(1)
将一支充满NO2的试管倒放在盛有水的水槽中
红棕色气体逐渐消失,水位上升,最后水充满试管的2/3,无色气体充满试管的1/3(上部)
3NO2+H2O=2HNO3+NO
MnO2
NO2为红棕色气体,和水反应,生成NO为无色气体难溶于水
(2)
制取少量氧气
△
2KClO3==2KCl+3O2↑
MnO2
2H2O2===2H2O+O2↑
(3)
将氧气慢慢通入步骤
(1)的试管中
无色气体变为红棕色气体,又变为无色气体,但气体体积逐渐缩小,液面不断上升。
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
【P97实验4-8】
现象:
烧杯里的水沿玻璃管进入烧瓶,形成喷泉,烧瓶内液体呈红色。
分析出现这一现象的原因及可能得出的结论:
氨气极易溶于水,烧瓶内气压降低,外界大气压将烧杯中的水沿玻璃管压入烧瓶,形成喷泉;氨气溶于水生成碱性物质,使酚酞变红。
【P101实验4-9】
现象:
浓硫酸与铜在加热时能发生反应,放出能使紫色石蕊溶液变红(或使品红溶液褪色)的气体。
反应后生成物的水溶液显蓝色。
【P105归纳与整理】
一、硅
1.硅单质:
用途:
硅芯片、光电池
2.二氧化硅:
存在:
有结晶形和无定形两大类,统称硅石。
(石英、水晶、玛瑙、沙子)
性质:
化学性质不活泼。
可以和酸性氧化物反应生成盐,和强碱反应生成盐,和氢氟酸反应。
用途:
建筑材料、光学及光纤制品、工艺品等。
3.硅酸盐
Na2SiO3
制法:
SiO2+2NaOH==Na2SiO3+2H2O
性质:
Na2SiO3+2HCl==H2SiO3(胶体)+2NaCl
用途:
可做木材防火剂
硅酸盐产品:
玻璃、水泥、陶瓷等。
二、氯
1.氯气:
物理性质:
黄绿色气体,有刺激性气味,有毒。
易液化。
在25℃时,1体积水中可溶解约2体积的氯气
化学性质:
与水反应:
化学方程式:
Cl2+H2O==HCl+HClO
产物的用途:
漂白、杀菌消毒
与碱反应:
化学方程式:
Cl2+2NaOH==NaCl+NaClO+H2O
产物的用途:
漂白液
化学方程式:
2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O
产物的用途:
漂白粉或漂粉精
与金属反应:
2Na+Cl2
2NaCl
2Fe+3Cl2
2FeCl3
Cu+Cl2
CuCl2
2.Cl—的检验
化学方程式:
Ag++Cl—==AgCl↓
试剂:
硝酸银溶液和稀硝酸
操作:
取少量待测液于试管中,先滴加少量稀硝酸使溶液酸化,再滴加硝酸银溶液。
若有白色沉淀生成,则待测液中含有Cl—。