化学中考备忘录.docx
《化学中考备忘录.docx》由会员分享,可在线阅读,更多相关《化学中考备忘录.docx(53页珍藏版)》请在冰豆网上搜索。
化学中考备忘录
化学中考化学备忘录
一、常见物质的俗名、学名、主要成分、化学式:
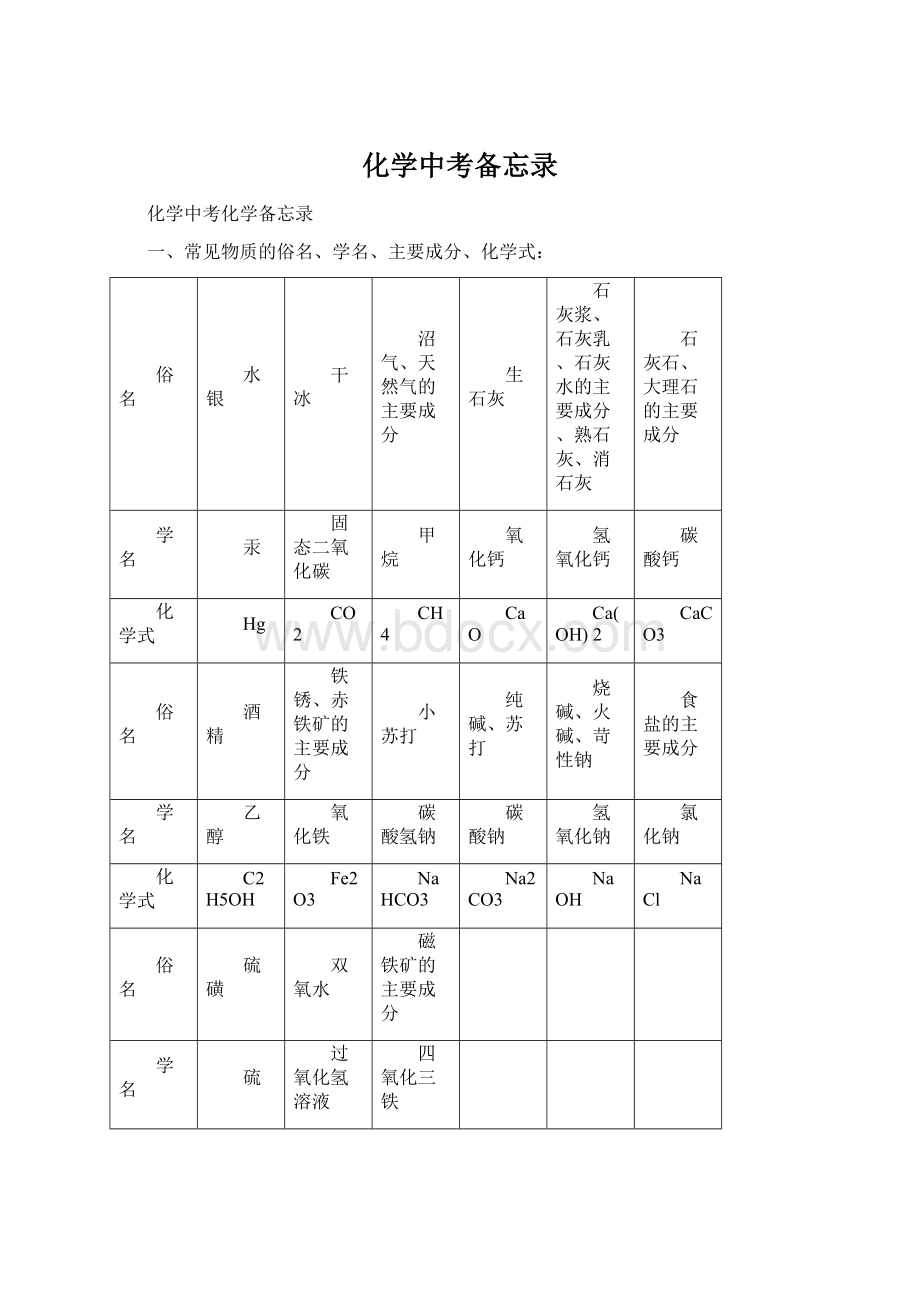
俗名
水银
干冰
沼气、天然气的主要成分
生石灰
石灰浆、石灰乳、石灰水的主要成分、熟石灰、消石灰
石灰石、大理石的主要成分
学名
汞
固态二氧化碳
甲烷
氧化钙
氢氧化钙
碳酸钙
化学式
Hg
CO2
CH4
CaO
Ca(OH)2
CaCO3
俗名
酒精
铁锈、赤铁矿的主要成分
小苏打
纯碱、苏打
烧碱、火碱、苛性钠
食盐的主要成分
学名
乙醇
氧化铁
碳酸氢钠
碳酸钠
氢氧化钠
氯化钠
化学式
C2H5OH
Fe2O3
NaHCO3
Na2CO3
NaOH
NaCl
俗名
硫磺
双氧水
磁铁矿的主要成分
学名
硫
过氧化氢溶液
四氧化三铁
化学式
S
H2O2
Fe3O4
二、物质特征颜色(如固体颜色、溶液颜色、沉淀颜色、火焰颜色等):
1.红色固体有Cu(紫红色)、Fe2O3(红棕色);
2.黑色固体有C、CuO、Fe3O4、MnO2、Fe粉等;
3.白色固体:
MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、NaHCO3、CaCO3;铁丝、镁带为银白色(汞为银白色液态);
4.暗紫色固体:
KMnO4;
5.淡黄色粉末:
硫磺(S);
6.溶液的颜色:
凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈(棕)黄色,其余溶液一般为无色(高锰酸钾溶液为紫红色);
7.沉淀颜色:
蓝色沉淀为Cu(OH)2,红褐色沉淀为Fe(OH)3,常见的白色沉淀有BaSO4、AgCl、CaCO3、BaCO3、Mg(OH)2;
8.S在O2中燃烧产生明亮的蓝紫色火焰。
三、初中化学之最:
1.空气中含量最多的气体是氮气(N2)。
2.化学变化中的最小粒子是原子。
3.最简单的有机物是甲烷(CH4)。
4.硬度最大的天然物质是金刚石(C)。
5.形成化合物种类最多的是碳元素(C)。
6.最常用的溶剂是水(H2O)。
7.人体内含量最多的元素是氧(O);最多的金属元素是钙(Ca)。
8.相对分子质量最小的氧化物是水。
9.地壳中含量最多的元素是氧元素(O);金属元素是铝元素(Al)。
10.密度最小的物质是氢气(H2);最理想的燃料是氢气(H2)。
11.一种元素与另一种元素最根本的区别是两种元素原子核内的质子数不同。
12.与元素化学性质关系最密切的是原子的最外层电子数;原子的最外层电子数最多不超过8个。
13.同一温度下,同一种溶质的溶液中,饱和溶液的溶质质量分数最大。
四、初中化学常见的错别字对照表:
误
正
误
正
误
正
误
正
活性碳
活性炭
贡
汞
练钢
炼钢
蒸发血
蒸发皿
炭酸
碳酸
中合反应
中和反应
兰色
蓝色
滤子
滤纸
甲完
甲烷
质(直)换反应
置换反应
原素
元素
长劲漏斗
长颈漏斗
天燃气
天然气
质量守衡定律
质量守恒定律
崔化剂
催化剂
水糟
水槽
金钢石
金刚石
混和物
混合物
暴炸
爆炸
象皮塞
橡皮塞
分太
酚酞
致冷剂
制冷剂
吸付
吸附
聂子
镊子
石芯
石蕊
干噪剂
干燥剂
干锅钳
坩埚钳
元子
原子
五、化学方程式汇总:
(一)物质与氧气的反应:
(1)单质与氧气的反应:
(化合反应)
1.镁在空气中燃烧:
2Mg+O2
2MgO(发出耀眼的白光)
2.铁在氧气中燃烧:
3Fe+2O2
Fe3O4(火星四射)
3.铜在空气中受热:
2Cu+O2
2CuO
4.铝在空气中缓慢氧化:
4Al+3O2===2Al2O3(致密的氧化膜)
5.氢气(最清洁的燃料)中空气中燃烧:
2H2+O2
2H2O(无污染)
6.红磷在空气中燃烧:
4P+5O2
2P2O5(产生大量的白烟)
7.硫粉在氧气中燃烧:
S+O2
SO2(发出蓝紫色的火焰)
8.碳在氧气中充分燃烧:
C+O2
CO2
9.碳在氧气中不充分燃烧:
2C+O2
2CO
(2)化合物与氧气的反应:
10.一氧化碳在氧气中燃烧:
2CO+O2
2CO2
11.天然气(主要成分是甲烷)在空气中燃烧:
CH4+2O2
CO2+2H2O
12.乙醇(俗称酒精)在空气中燃烧:
C2H5OH+3O2
2CO2+3H2O
13.葡萄糖缓慢氧化:
C6H12O6+6O26CO2+6H2O
(二)几个分解反应:
14.水在直流电的作用下分解:
2H2O
2H2↑+O2↑
15.实验室用过氧化氢溶液和二氧化锰制氧气:
2H2O22H2O+O2↑
16.实验室用加热氯酸钾和二氧化锰的混合物制氧气:
2KClO3
2KCl+3O2↑
17.实验室用加热高锰酸钾制氧气:
2KMnO4
K2MnO4+MnO2+O2↑
18.碳酸不稳定而分解:
H2CO3===H2O+CO2↑
19.高温煅烧石灰石:
CaCO3
CaO+CO2↑
(三)几个氧化还原反应:
20.氢气还原氧化铜:
H2+CuO
Cu+H2O
21.木炭还原氧化铜:
C+2CuO
2Cu+CO2↑
22.木炭还原氧化铁:
3C+2Fe2O3
4Fe+3CO2↑
23.二氧化碳通入炽热的木炭层:
CO2+C
2CO
24.一氧化碳还原氧化铜:
CO+CuO
Cu+CO2
25.高炉冶炼赤铁矿:
3CO+Fe2O3
2Fe+3CO2
26.高炉冶炼磁铁矿:
4CO+Fe3O4
3Fe+4CO2
(四)单质、氧化物、酸、碱、盐的相互关系:
(1)金属(单质)+酸--------盐+氢气(置换反应)
27.锌和稀硫酸:
Zn+H2SO4===ZnSO4+H2↑(实验室制取氢气)
28.铁和稀硫酸:
Fe+H2SO4===FeSO4+H2↑(单质铁在溶液中发生置换反应时生成+2价亚铁化合物)
29.镁和稀硫酸:
Mg+H2SO4===MgSO4+H2↑
30.铝和稀硫酸:
2Al+3H2SO4===Al2(SO4)3+3H2↑
31.锌和稀盐酸:
Zn+2HCl===ZnCl2+H2↑
32.铁和稀盐酸:
Fe+2HCl===FeCl2+H2↑
33.镁和稀盐酸:
Mg+2HCl===MgCl2+H2↑
34.铝和稀盐酸:
2Al+6HCl===2AlCl3+3H2↑
常见金属在溶液中的活动性顺序:
KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu
金属的活动性由强逐渐减弱
(2)金属(单质)+盐(溶液)-------另一种金属+另一种盐(置换反应)
35.铁和硫酸铜溶液反应:
Fe+CuSO4===FeSO4+Cu
36.锌和硫酸铜溶液反应:
Zn+CuSO4===ZnSO4+Cu
37.铝和硫酸铜溶液反应:
2Al+3CuSO4===Al2(SO4)3+3Cu
38.铁和硝酸银溶液反应:
Fe+2AgNO3===Fe(NO3)2+2Ag
39.铜和硝酸银溶液反应:
Cu+2AgNO3===Cu(NO3)2+2Ag
(3)碱性氧化物+酸--------盐+水(复分解反应)
40.氧化铁和稀盐酸反应:
Fe2O3+6HCl===2FeCl3+3H2O(清洗铁锈)
41.氧化铁和稀硫酸反应:
Fe2O3+3H2SO4===Fe2(SO4)3+3H2O
42.氧化铜和稀盐酸反应:
CuO+2HCl===CuCl2+H2O
43.氧化铜和稀硫酸反应:
CuO+H2SO4===CuSO4+H2O
44.氧化镁和稀硫酸反应:
MgO+H2SO4===MgSO4+H2O
45.氧化铝和稀盐酸反应:
Al2O3+6HCl===2AlCl3+3H2O
(4)酸性氧化物+碱--------盐+水(不属于任何基本反应类型)
46.苛性钠暴露在空气中变质:
2NaOH+CO2===Na2CO3+H2O(除去CO2)
47.苛性钠吸收二氧化硫气体:
2NaOH+SO2===Na2SO3+H2O
48.苛性钠与三氧化硫反应:
2NaOH+SO3===Na2SO4+H2O
49.消石灰放在空气中变质:
Ca(OH)2+CO2===CaCO3↓+H2O(检验CO2)
50.消石灰吸收二氧化硫:
Ca(OH)2+SO2===CaSO3+H2O
51.氢氧化钡溶液与CO2反应:
Ba(OH)2+CO2===BaCO3↓+H2O
(5)酸+碱--------盐+水(复分解反应)(1:
1:
1中和反应)
52.盐酸和烧碱反应:
HCl+NaOH===NaCl+H2O
53.硫酸和烧碱反应:
H2SO4+2NaOH===Na2SO4+2H2O
54.盐酸和氢氧化钙反应:
2HCl+Ca(OH)2===CaCl2+2H2O(熟石灰中和土壤的酸性)
55.熟石灰中和硫酸厂废水:
H2SO4+Ca(OH)2===CaSO4+2H2O
56.有白色沉淀生成的中和反应:
H2SO4+Ba(OH)2===BaSO4↓+2H2O
57.氢氧化铝药物治疗胃酸过多:
3HCl+Al(OH)3===AlCl3+3H2O
58.稀盐酸除去水垢中氢氧化镁:
2HCl+Mg(OH)2===MgCl2+2H2O
59.硫酸和氢氧化铜反应:
H2SO4+Cu(OH)2===CuSO4+2H2O
60.盐酸和氢氧化铁反应:
3HCl+Fe(OH)3===FeCl3+3H2O
(6)酸+盐--------另一种酸+另一种盐(复分解反应)
61.大理石与稀盐酸反应:
CaCO3+2HCl===CaCl2+H2O+CO2↑(实验室制取二氧化碳)
62.碳酸钠(纯碱、苏打)与稀盐酸反应:
Na2CO3+2HCl===2NaCl+H2O+CO2↑
63.硫酸和碳酸钠反应:
Na2CO3+H2SO4===Na2SO4+H2O+CO2↑
64.碳酸氢钠(小苏打)与稀盐酸反应:
NaHCO3+HCl===NaCl+H2O+CO2↑
65.盐酸和硝酸银溶液反应:
HCl+AgNO3===AgCl↓+HNO3
66.硫酸和氯化钡溶液反应:
H2SO4+BaCl2===BaSO4↓+2HCl
(7)碱+盐--------另一种碱+另一种盐(复分解反应)
67.氢氧化钠溶液与硫酸铜溶液:
2NaOH+CuSO4===Cu(OH)2↓(蓝色沉淀)+Na2SO4
68.氢氧化钠溶液与氯化铁溶液:
3NaOH+FeCl3===Fe(OH)3↓(红褐色沉淀)+3NaCl
69.氢氧化钠溶液与氯化镁溶液:
2NaOH+MgCl2===Mg(OH)2↓(白色沉淀)+2NaCl
70.氢氧化钡溶液与碳酸钠溶液:
Ba(OH)2+Na2CO3===BaCO3↓(白色沉淀)+2NaOH
71.氢氧化钙溶液与碳酸钠溶液:
Ca(OH)2+Na2CO3===CaCO3↓(白色沉淀)+2NaOH(工业纯碱制烧碱)
(8)盐+盐-----两种新盐(复分解反应)
72.氯化钠溶液和硝酸银溶液:
NaCl+AgNO3===AgCl↓(白色沉淀,不溶于酸)+NaNO3
73.硫酸钠溶液和氯化钡溶液:
Na2SO4+BaCl2===BaSO4↓(白色沉淀,不溶于酸)+2NaCl
74.碳酸钠溶液和氯化钙溶液:
Na2CO3+CaCl2===CaCO3↓+2NaCl
75.碳酸钠溶液和氯化钡溶液:
Na2CO3+BaCl2===BaCO3↓+2NaCl
76.碳酸钠溶液和硝酸钙溶液:
Na2CO3+Ca(NO3)2===CaCO3↓+2NaNO3
77.碳酸钠溶液和硝酸钡溶液:
Na2CO3+Ba(NO3)2===BaCO3↓+2NaNO3
78.硫酸铜溶液和氯化钡溶液:
CuSO4+BaCl2===BaSO4↓+CuCl2
(五)其它反应
79.二氧化碳溶解于水:
CO2+H2O===H2CO3
80.生石灰溶于水:
CaO+H2O===Ca(OH)2(放热反应)
81.二氧化硫溶解于水:
SO2+H2O===H2SO3(亚硫酸)
六、考点整合
【考点1】
1.分子是保持由分子构成的物质的化学性质的最小粒子。
分子的质量和体积都很小;分子间有间隔,且分子间的间隔受热增大,遇冷缩小,气态物质的分子间间隔最大;分子在不停地运动,且温度越高分子运动越快。
2.原子是化学变化中的最小粒子。
在化学反应中,分子可分,而原子不可再分。
3.离子是带电的原子或原子团,带正电的原子(或原子团)叫阳离子,带负电的原子(或原子团)叫阴离子。
【考点2】
1.
2.原子中,核电荷数(即该原子在元素周期表中的原子序数)=质子数=核外电子数。
3.原子的质量主要集中在原子核上,所以,相对原子质量≈质子数+中子数。
4.原子结构示意图可以简明、方便地表示核外电子的分层排布。
【考点3】分子、原子和离子都可以直接构成物质。
1.一般由非金属元素组成的单质或化合物由分子构成,如氧气、水、二氧化碳等;
2.金属、稀有气体以及金刚石等由原子直接构成,如铁、水银、氦气等;
3.含有金属阳离子(或NH4+)的化合物(如盐和碱)由离子构成,如氯化钠等。
【考点4】
1.元素是质子数(即核电荷数)相同的一类原子的总称。
2.元素的种类决定于核电荷数(即核内质子数)。
3.元素的性质与原子的最外层电子数的关系:
元素分类
最外层电子数
得失电子倾向
化学性质
稀有气体元素
8个
(He为2个)
不易得失电子、相对稳定
稳定
金属元素
一般小于4个
易失去最外层电子,达到8电子的稳定结构,形成阳离子
不稳定
非金属元素
一般大于或等于4个
易得到电子,使最外层达到8电子的稳定结构,形成阴离子
不稳定
4.原子核外电子的排布,特别是最外层的电子数目,跟元素的化学性质有密切的关系。
【考点5】
1.以一种碳原子质量的1/12为标准,其他原子的质量与它相比较所得到的比,就是这种原子的相对原子质量(符号为Ar)。
2.相对分子质量是化学式中各原子的相对原子质量的总和(符号为Mr)。
【考点6】
1.混合物在宏观上由两种或多种物质混合而成。
如空气、食醋、乙醇汽油等。
2.纯净物在宏观上由一种物质组成,在微观上由构成同种物质的微粒构成,纯净物可以用化学式来表示。
如O2、CO2、H2O等。
【考点7】
1.单质是由同种元素组成的纯净物。
如N2、Cl2、Fe。
由同种原子构成的分子属于单质分子,如O2。
只含一种元素的物质可能为混合物,如O2和O3。
2.化合物是由不同种元素组成的纯净物。
如SO2、KMnO4、KClO3。
由不同种原子构成的分子属于化合物分子,如H2O。
【考点8】
1.由两种元素组成,其中有一种是氧元素的化合物叫氧化物。
如Fe2O3、P2O5。
而含氧化合物是指含有氧元素的化合物,含氧化合物不一定是氧化物,如KMnO4,但两种元素组成的含氧化合物属于氧化物,如CO。
2.解离出的阳离子全部为H+的化合物叫酸。
如HCl、H2SO4、HNO3、H2CO3。
3.解离出的阴离子全部为OH-的化合物叫碱。
如NaOH、Ca(OH)2。
4.能解离出金属离子(或NH4+)和酸根离子的化合物叫盐。
如NaCl、Na2CO3、NaHCO3、CaCO3。
5.有机化合物(有机物)是指含有碳元素的化合物,如CH4(最简单的有机物)、C2H5OH、C6H12O6。
而无机化合物是指不含碳元素的化合物。
但是少数含有碳元素的化合物,如CO、CO2和CaCO3等具有无机化合物的特点,因此,把它们看做无机化合物。
6.从微观模型图判断物质分类:
混合物单质化合物
7.物质分类易错点总结:
水银不是银
水银Hg,银Ag
铅芯不是铅
铅芯是石墨,铅Pb
干冰不是冰
干冰是固态二氧化碳,冰是固态水
纯碱不是碱
纯碱虽然显碱性,但是盐,是碳酸钠
冰水共存物不是混合物
冰水混合物是水的不同状态,是同种分子构成,属于纯净物
【考点9】
1.物理变化:
没有生成其他物质的变化,在物理变化中物质常发生了形态的变化。
2.化学变化(又叫做化学反应):
生成了其他物质的变化,如燃烧、钢铁生锈、食物腐败、呼吸作用、光合作用等。
化学变化中常伴随放热、发光、颜色改变、放出气体、生成沉淀等现象。
【考点10】
1.物理性质是指物质不需要通过化学变化就能表现出来的性质,如颜色、状态、气味、密度、硬度、熔点、沸点、溶解性、导电性、导热性、挥发性、延展性等。
2.化学性质是指物质通过化学变化才能体现出来的性质,如可燃性、氧化性、还原性、稳定性、酸碱性、金属活动性、毒性等。
【考点11】
1.物质与氧发生的反应叫做氧化反应。
剧烈氧化:
如可燃物的燃烧。
缓慢氧化:
如铁生锈、动植物的呼吸、食物的腐烂、酒和醋的酿造、农家肥料的腐熟。
2.含氧化合物里的氧被夺去的反应叫做还原反应。
3.初中阶段常见的还原剂:
H2、C、CO;常见的氧化剂:
O2、CuO、Fe2O3等。
【考点12】
1.分解反应:
由一种反应物生成两种或两种以上其他物质的反应。
2.化合反应:
由两种或两种以上的物质生成另一种物质的反应。
【考点13】
1.置换反应:
一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应。
2.活泼金属+酸→盐+氢气。
如Fe+2HCl===FeCl2+H2↑
发生的条件:
在金属活动性顺序里,金属的位置要在氢(H)的前面。
酸一般用盐酸或稀硫酸。
3.金属+盐(溶液)→另一金属+另一种盐。
如Fe+CuSO4===Cu+FeSO4
发生的条件:
在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们的盐溶液里置换出来。
【考点14】
1.复分解反应:
两种化合物相互交换成分,生成另外两种化合物的反应,特点是在相互交换成分过程中各元素的化合价不发生改变。
2.中和反应是指由酸与碱作用生成盐和水的反应。
中和反应的实质是酸溶液中的H+和碱溶液中的OH—结合成H2O分子。
3.复分解反应发生的条件:
生成水、↓(沉淀)或↑(气体)(简记:
生成水“电”气)至少一种。
【考点15】
1.催化剂是指在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质。
2.催化剂在化学反应中所起的作用叫催化作用。
【考点16】
1.【识记】以下常见元素名称和元素符号:
氢(H)、氦(He)、碳(C)、氮(N)、氧(O)、氟(F)、氖(Ne)、钠(Na)、镁(Mg)、铝(Al)、硅(Si)、磷(P);硫(S)、氯(Cl)、氩(Ar)、钾(K)、钙(Ca)、锰(Mn)、铁(Fe)、汞(Hg)、铜(Cu)、锌(Zn);银(Ag)、碘(I)、钡(Ba)、铂(Pt)、金(Au)
2.元素符号的意义:
⑴宏观意义:
表示一种元素。
⑵微观意义:
表示这种元素的一个原子。
⑶对于由单原子构成的单质来讲,元素符号还表示一种单质。
【考点17】
1.常见元素和原子团的化合价:
氢+1;氧-2;钠+1;钾+1;银+1;钙+2;镁+2;钡+2;锌+2;铝+3;铜+2;铁+2、+3。
氢氧根(OH)-1;硫酸根(SO4)-2;碳酸根(CO3)-2;硝酸根(NO3)-1;铵根(NH4)+1。
2.在化合物里,各元素正负化合价代数和为0。
在单质里,元素的化合价为0。
【考点18】
1.化学式是用元素符号和数字的组合表示物质组成的式子。
2.化学式的意义:
3.【熟记】下列物质的化学式:
单
质
氢气
氧气
氮气
碳
磷
硫
铁
铜
H2
O2
N2
C
P
S
Fe
Cu
化
合
物
氧
化
物
水
二氧化碳
一氧化碳
二氧化硫
三氧化硫
五氧化二磷
氧化铁
四氧化三铁
H2O
CO2
CO
SO2
SO3
P2O5
Fe2O3
Fe3O4
氧化镁
氧化铜
氧化锌
二氧化锰
氧化钙
过氧化氢
氧化铝
氧化汞
MgO
CuO
ZnO
MnO2
CaO
H2O2
Al2O3
HgO
酸
盐酸
硫酸
硝酸
碳酸
HCl
H2SO4
HNO3
H2CO3
碱
氢氧化钠
氢氧化钾
氢氧化钙
氢氧化钡
氢氧化铜
氢氧化铁
氢氧化镁
氢氧化铝
NaOH
KOH
Ca(OH)2
Ba(OH)2
Cu(OH)2
Fe(OH)3
Mg(OH)2
Al(OH)3
盐
氯化钠
碳酸钠
氯化铁
氯化钙
氯化钾
硫酸钠
硫酸铜
氯化银
NaCl
Na2CO3
FeCl3
CaCl2
KCl
Na2SO4
CuSO4
AgCl
氯化亚铁
氯化铝
硫酸亚铁
硫酸铁
硫酸锌
碳酸钙
氯化钡
硫酸钡
FeCl2
AlCl3
FeSO4
Fe2(SO4)3
ZnSO4
CaCO3
BaCl2
BaSO4
高锰酸钾
氯酸钾
硝酸铜
碳酸氢钠
氯化铵
硝酸铵
硫酸铵
碳酸氢铵
KMnO4
KClO3
Cu(NO3)2
NaHCO3
NH4Cl
NH4NO3
(NH4)2SO4
NH4HCO3
有机物
甲烷
乙醇、酒精
葡萄糖
CH4
C2H5OH
C6H12O6
4.【重点】化学符号周围数字的意义:
数字、符号的位置
表示的意义
举例
元素符号前面的数字
表示原子的数目
2个氢原子:
2H2个氮原子:
2N
离子符号前面的数字
表示离子的数目
2个钠离子:
2Na+2个氯离子:
2Cl—
化学式(分子式)前面的数字
表示分子的数目
2个氧分子:
2O22个水分子:
2H2O
元素符号正上方的数字
表示元素的化合价
+2价的镁元素:
氧化镁中镁元素的化合