高考化学四海八荒易错集专题03 氧化还原反应.docx
《高考化学四海八荒易错集专题03 氧化还原反应.docx》由会员分享,可在线阅读,更多相关《高考化学四海八荒易错集专题03 氧化还原反应.docx(18页珍藏版)》请在冰豆网上搜索。
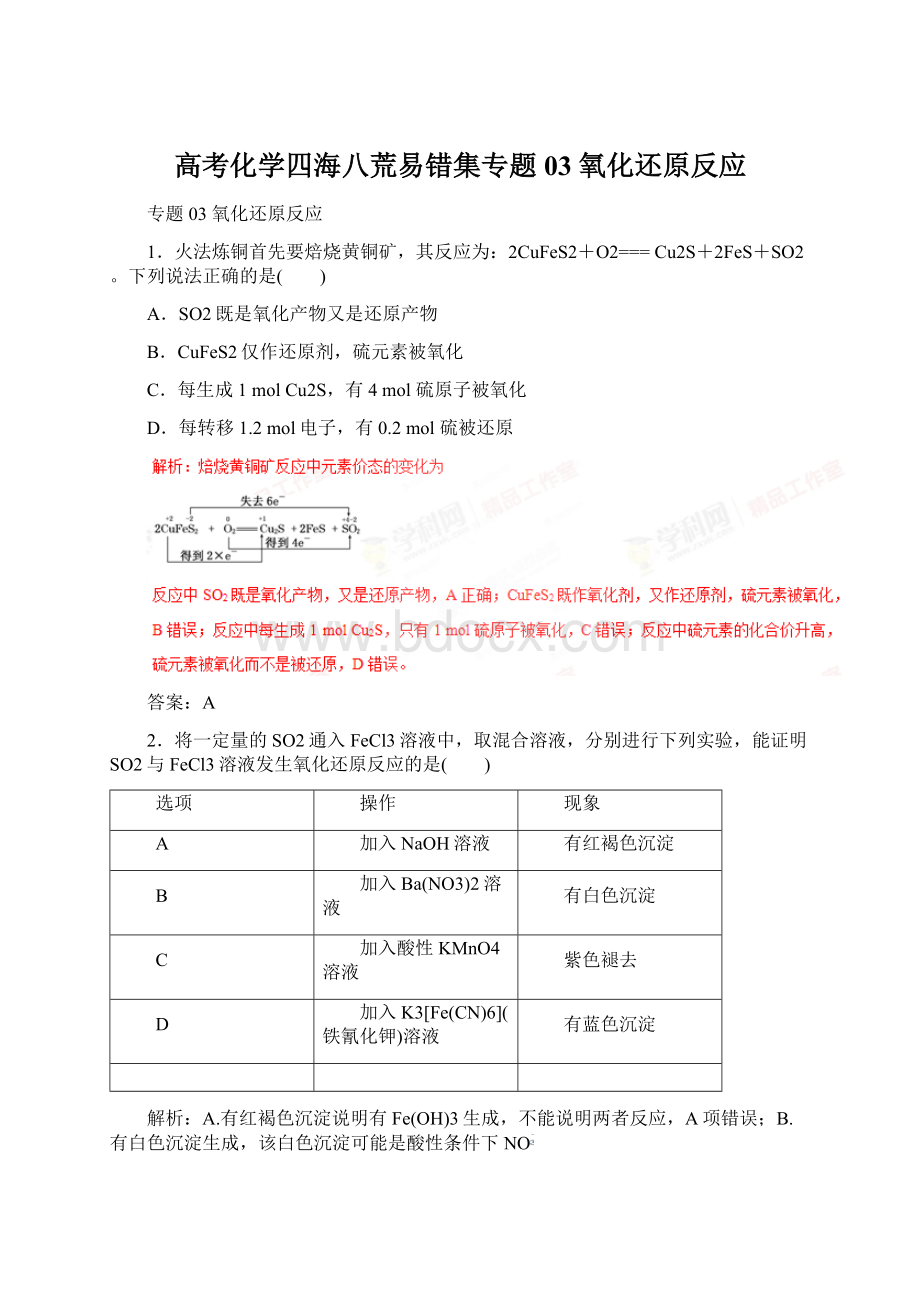
高考化学四海八荒易错集专题03氧化还原反应
专题03氧化还原反应
1.火法炼铜首先要焙烧黄铜矿,其反应为:
2CuFeS2+O2===Cu2S+2FeS+SO2。
下列说法正确的是( )
A.SO2既是氧化产物又是还原产物
B.CuFeS2仅作还原剂,硫元素被氧化
C.每生成1molCu2S,有4mol硫原子被氧化
D.每转移1.2mol电子,有0.2mol硫被还原
答案:
A
2.将一定量的SO2通入FeCl3溶液中,取混合溶液,分别进行下列实验,能证明SO2与FeCl3溶液发生氧化还原反应的是( )
选项
操作
现象
A
加入NaOH溶液
有红褐色沉淀
B
加入Ba(NO3)2溶液
有白色沉淀
C
加入酸性KMnO4溶液
紫色褪去
D
加入K3[Fe(CN)6](铁氰化钾)溶液
有蓝色沉淀
解析:
A.有红褐色沉淀说明有Fe(OH)3生成,不能说明两者反应,A项错误;B.有白色沉淀生成,该白色沉淀可能是酸性条件下NO
氧化SO2生成的SO
与Ba2+反应生成BaSO4,不能说明FeCl3溶液与SO2反应,B项错误;C.紫色褪去可能因为SO2的还原性,不能说明两者反应,C项错误;D.铁氰化钾溶液是Fe2+的专属检验试剂,有蓝色沉淀能说明两者发生氧化还原反应生成了Fe2+,D项正确。
答案:
D
3.下列化学反应先后顺序判断正确的是( )
A.含有等物质的量的H+、Al3+的溶液中,逐滴加入NaOH溶液:
H+、A13+、Al(OH)3
B.含有等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:
I-、Br-、Fe2+
C.含有等物质的量的NaCl、Na2S的溶液中加入AgNO3溶液:
NaCl、Na2S
D.含有等物质的量的Fe3+、Cu2+的溶液中加入铁粉:
Cu2+、Fe3+
答案:
A
4.在汽车排气管加装催化装置,可有效减少CO和NOx的排放,催化装置内发生反应为:
NOx+CO
N2+CO2(未配平),下列关于此反应的说法中正确的是( )
A.该反应中化合价变化的只有N元素
B.当x=2时,每生成1molN2,转移电子4mol
C.等物质的量N2和CO2中,共价键的个数比为3∶2
D.氧化剂与还原剂的物质的量之比为1∶1时,NOx中氮元素的化合价为+2价
解析:
分析可知C的化合价由+2变为+4,故A错;x=2时,每生成1molN2,由2molN由+4变为0价,转移电子8mol,故B错;N2中有三键,CO2中为两个双键,应为3∶4,故C错;氧化剂与还原剂的物质的量之比为1∶1时,为NO,即氮元素化合价为+2,D正确。
答案:
D
5.下列关于氧化性、还原性的判断正确的是( )
A.B的阳离子的氧化性比A的阳离子强,说明A元素的金属性一定比B元素强
B.发生氧化还原反应时A原子失去的电子比B原子多,证明A的金属性一定比B强
C.适量的Cl2通入FeI2溶液中可发生反应:
3Cl2+6FeI2===2FeCl3+4FeI3
D.一定量氯气通入30mL10.00mol/L的氢氧化钠溶液中,加热后形成NaCl、NaCl
O、NaClO3共存的溶液,若反应中转移的电子为nmol,则0.15<n<0.25
解析:
A.铁离子的氧化性比铜离子的氧化性强,但是铁的金属性比铜强,所以错误,不选A;B.金属性强弱与失去电子的多少无关,错误,不选B;C.氯气和碘化亚铁反应时,碘离子先和氯气反应生成碘单质,错误,不选C;D.氯气和氢氧化钠的反应可以分两种,Cl2+2NaOH===NaCl+NaClO+H2O,3Cl2+6NaOH===5NaCl+NaClO3+3H2O,发生前面的反应,当有2mol氢氧化钠反应就转移1mol电子,所以现有0.3mol氢氧化钠反应可转移0.15mol电子,发生后面的反应,当有6mol氢氧化钠反应转移5mol电子,所以现有0.3mol氢氧化钠反应可转移电子0.25mol,正确,选D。
答案:
D
6.氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:
aHClO3===bO2↑+cCl2↑+dHClO4+eH2O。
下列有关说法正确的是( )
A.由反应可确定:
氧化产物只有O2
B.若氯酸分解所得1mol混合气体质量为45g,则反应方程式可表示为:
3HClO3===2O2↑+C12↑+HClO4+H2O
C.由非金属性Cl>S,可推知酸性HClO3>H2SO4
D.若化学计量数a=8,b=3,则该反应转移电子数为8
答案:
B
7.己知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。
现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
A.图中AB段的氧化剂为K2Cr2O7
B.图中BC段发生的反应为:
2Fe3++2I-===2Fe2++I2
C.开始加入的K2Cr2O7为0.25mol
D.n(K2Cr2O7)∶n(FeSO4)=1∶3
答案:
D
8.
(1)①PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为___________________________________。
(2)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。
写出该反应的化学方程式________________。
(3)请配平第①步反应的化学方程式:
□NaBO2+□SiO2+□Na+□H2________□NaBH4+□Na2SiO3
(4)完成NaClO3氧化FeCl2的离子方程式:
□ClO
+□Fe2++□________===□Cl-+□Fe3++□________。
解析:
(1)由题意可知,生成的黄绿色气体应为Cl2,氯元素的化合价升高,则铅元素的化合价
降低,反应化学方程式为:
PbO2+4HCl(浓)
PbCl2+Cl2↑+2H2O
(2)KClO3有氧化性,H2C2O4有还原性,在酸性条件下KClO3可以和草酸(H2C2O4)反应生成高效的消毒杀菌
剂ClO2,还生成CO2和KHSO4等物质。
则根据电子守恒及原子守恒,可得该反应的化学方程式是:
2KClO3+H2C2O4+2H2SO4===2ClO2+2CO2↑+2KHSO4+2H2O。
(3)根据还原剂钠化合价升高1,而还原剂NaBH4(其中B的化合价为+3价、H的化合价为-1价)中H化合价下降4,可以直接配平。
(4)根据题意,氯酸钠氧化酸性的氯化亚铁,则反应物中有氢离子参加,则生成物中有水生成,Cl元素的化合价从+5价降低到-1价,得到6个电子,而Fe元素的化合价从+2价升高到+3价,失去1个电子,根据得失电子守恒,则氯酸根离子的计量数为1,Fe2+的计量数为6,则铁离子的计量数也是6,氯离子的计量数是1,根据电荷守恒,则氢离子的计量数是6,水的计量数是3。
答案:
(1)PbO2+4HCl(浓)
PbCl2+Cl2↑+2H2O
(2)2KClO3+H2C2O4+2H2SO4===2ClO2↑+2CO2↑+2KHSO4+2H2O
(3)1、2、4、2 === 1、2
(4)1 6 6 H+ 1 6 3 H2O
9.高铁电池能量密度大、体积小、重量轻、寿命长、无污染。
功率是民用电池的10~15倍,放电电流是普通电池的3~10倍,性价比极高。
已知,以Zn和K2FeO4为电极材料制作的高铁电池放电时,电池内发生的总反应为:
□Zn+□K2FeO4===□ZnO+□Fe2O3+□K2ZnO2。
(1)配平上面的化学方程式______________________________。
(2)已知铁是26号元素,则1molFeO
中含有电子的物质的量为________mol,Na2FeO4是否具有还原性________,原因是_________________________________________________________
。
(3)制备高铁酸钾可以将Fe(OH)3在碱性条件下与KClO溶液反应,若将该反应设计为原电池,则此电池的负极反应方程式为__________________________________________________________。
(4)向1L1mol/L的K2FeO4中加入足量稀H2SO4酸化,可以产生O2和Fe3+,该反应的离子方程式为____________________________________________________________________________。
向酸化后溶液中加入一定量的金属铜,使Fe3+和Cu2+浓度相等,若此时溶液密度为1.25g/mL,体积仍为1L,则此时溶液中Cu元素的质量分数约为________。
(精确到0.01)
(4)4FeO
+20H+===4Fe3++3O2↑+10H2O 1.71%
10.Ⅰ.煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O
4H++2Fe2++4SO
;
②Fe2++O2+H+
Fe3++________;
③FeS2+2Fe3+
3Fe2++2S;
④2S+3O2+2H2O
4H++2SO
。
已知:
FeS2中的硫元素为-1价。
回答下列问题:
(导学号58870119)
(1)根据质量守恒定律和电荷守恒定律,将上述②离子方程式配平并补充完整。
(2)反应③的还原剂是__________________。
(3)观察上述反应,硫元素最终转化为____________从煤炭中分离出来。
Ⅱ.在淀粉KI溶
液中,滴入少量NaClO溶液,溶液立即变蓝,有关反应的离子方程式是____________________________。
在上述蓝色溶液中,继续滴加足量的NaClO溶液,蓝色逐渐消失,有关反应的离子方程式是________________________。
(提示:
碘元素被氧化成IO
)从以上实验可知,ClO-、I2、IO
的氧化性
由强到弱的顺序是________________。
Ⅲ.工业上用黄铜矿(CuFeS2)冶炼铜,副产品中有SO2,冶炼铜的反应为8CuFeS2+21O2
8Cu+4FeO+2Fe2O3+16SO2。
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是________(填元素符号)。
当生成0.8mol铜时,此反应转移的电子数目是________。
+16SO2。
CuFeS2中Fe的化合价为+2,反应后被氧化为Fe2O3;S在反应前化合价是-2价,反应后被氧化为+4价。
Cu是+2价,反应后被还原为0价,O2中O元素的化合价是0价,反应后被还原变为-2价,所以反应中被还原的元素是Cu、O;根据反应方程式可知:
每产生8mol的Cu,转移电子100mol,所以当生成0.8mol铜时,此反应转移的电子数目是10NA。
答案:
Ⅰ.
(1)4、1、4、4、2H2O
(2)FeS2 (3)硫酸盐
Ⅱ.2I-+ClO-+H2O===I2+Cl-+2OH- I2+5ClO-+2OH-===2IO
+5Cl-+H2O ClO->IO
>I2
Ⅲ.Cu、O 10NA
易错起源1、氧化还原反应的概念
例1.下列说法正确的是( )
A.氧化还原反应的本质是元素的化合价发生变化
B.还原剂是一种能够得到电子的物质
C.物质所含元素化合价升高的反应是还原反应
D.氧化反应和还原反应是同时发生的