成都树德中学高一期末复习基础知识归纳总结.docx
《成都树德中学高一期末复习基础知识归纳总结.docx》由会员分享,可在线阅读,更多相关《成都树德中学高一期末复习基础知识归纳总结.docx(19页珍藏版)》请在冰豆网上搜索。
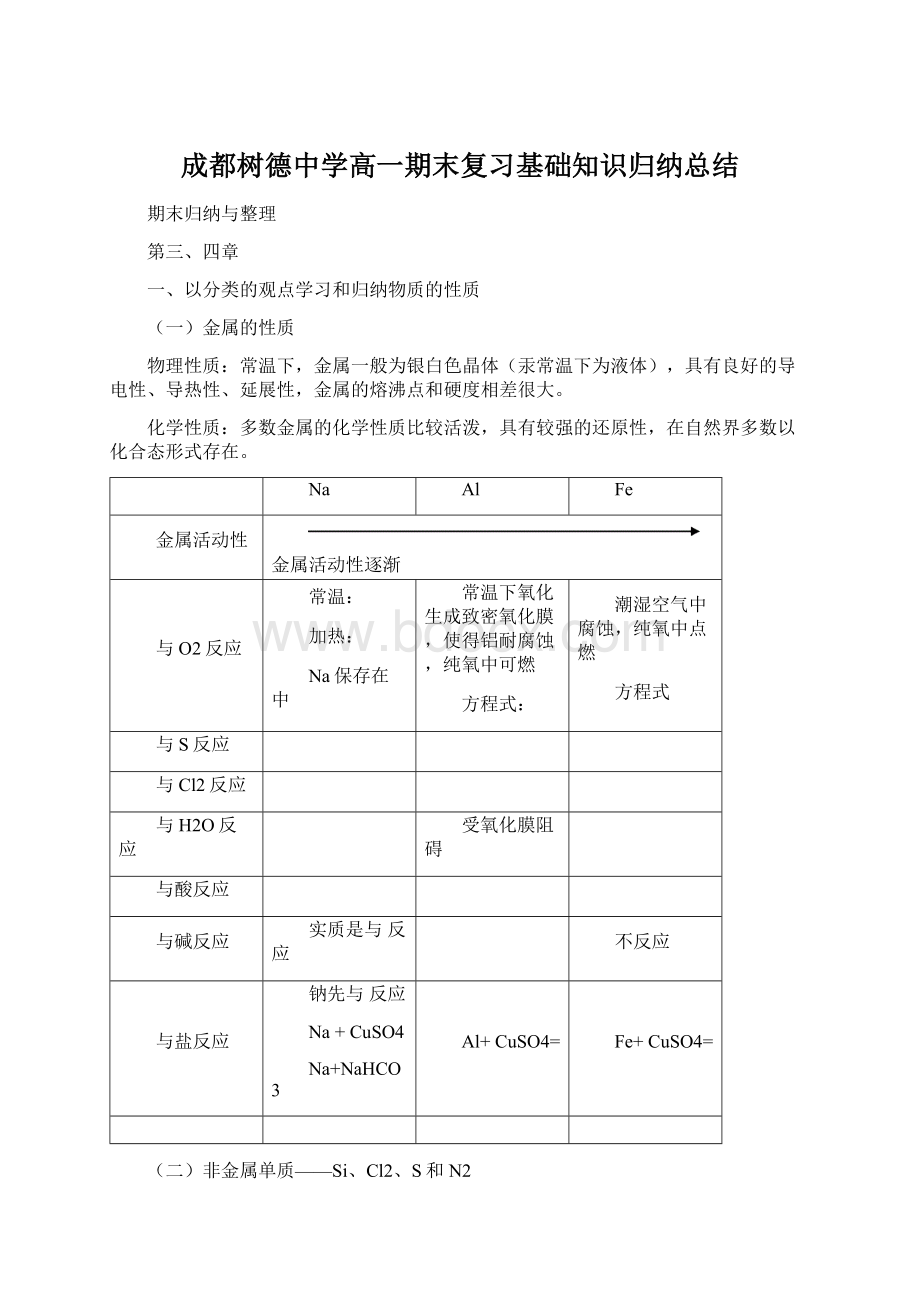
成都树德中学高一期末复习基础知识归纳总结
期末归纳与整理
第三、四章
一、以分类的观点学习和归纳物质的性质
(一)金属的性质
物理性质:
常温下,金属一般为银白色晶体(汞常温下为液体),具有良好的导电性、导热性、延展性,金属的熔沸点和硬度相差很大。
化学性质:
多数金属的化学性质比较活泼,具有较强的还原性,在自然界多数以化合态形式存在。
Na
Al
Fe
金属活动性
金属活动性逐渐
与O2反应
常温:
加热:
Na保存在中
常温下氧化生成致密氧化膜,使得铝耐腐蚀,纯氧中可燃
方程式:
潮湿空气中腐蚀,纯氧中点燃
方程式
与S反应
与Cl2反应
与H2O反应
受氧化膜阻碍
与酸反应
与碱反应
实质是与反应
不反应
与盐反应
钠先与反应
Na+CuSO4
Na+NaHCO3
Al+CuSO4=
Fe+CuSO4=
(二)非金属单质——Si、Cl2、S和N2
1.Si的主要性质
⑴常温下与、、反应。
请写出方程式:
⑵高温或点燃条件下与、和反应,写出反应的方程式:
⑶制备粗硅的反应:
2.Cl2的主要性质和用途
⑴与金属反应:
Na+Cl2=;Fe+Cl2=;Cu+Cl2=;Cl2与变价金属反应生成价金属氯化物。
⑵与非金属反应:
H2+Cl2========;P+Cl2(少)=;P+Cl2(过)=;
⑶与水反应:
Cl2+H2O=。
离子方程式为
⑷与碱反应:
Cl2+NaOH=。
离子方程式为
Cl2+Ca(OH)2=。
若用的是石灰乳,该反应的离子方程式为
3.S的主要性质:
S是一种色的体。
溶于水,溶于酒精,溶于CS2。
⑴弱氧化性:
H2+S==;Na+S==;Fe+S==;Cu+S==;S与变价金属反应生成价金属硫化物。
⑵还原性:
S+O2===
4.N2的主要性质:
N2+O2====;N2+H2========;
(三)氧化物
1.分类(请将I和II,II和III连线)
I(非金属氧化物)II(从性质分类)III(金属氧化物)
⑴H2O2⑴酸性氧化物⑴Na2O2、KO2等
⑵CO、NO、NO2、H2O⑵碱性氧化物⑵Na2O、CaO、MgO、FeO、Fe2O3、CuO等
⑶SiO2、CO2、SO2、SO3等⑶两性氧化物⑶Mn2O7、CrO3
⑷特殊氧化物⑷Al2O3和ZnO等
⑸不成盐氧化物
特殊氧化物:
过氧化物(Na2O2)、超氧化物(KO2)等。
与水反应生成对应的可溶性酸
酸性氧化物(如Mn2O7、CrO3)→酸性氧化物通性与碱反应生成盐和水
CO2、SO2等与碱性氧化物反应生成盐
氧Na2O、K2O、CaO与水反应生成碱
化成盐氧化物碱性氧化物(大多数金属氧化物)→碱性氧化物的通性与酸反应生成盐和水
物与酸性氧化物反应生成盐
与酸反应生成盐和水
两性氧化物(Al2O3和ZnO等)→两性氧化物的通性与强碱反应生成盐和水
2.几种常见的金属氧化物(下列表格中,是离子反应的请用离子方程式表示)
Na2O2
Na2O
Al2O3
Fe2O3
FeO
Fe3O4
颜色状态
粉末
色粉末
色粉末
色粉末
色粉末
色的晶体
属性
特殊化合物,可看成FeO·Fe2O3
与水反应
不反应
不反应
不反应
不反应
与酸反应
与碱反应
实质是与水反应
实质是与水反应
不反应
不反应
不反应
与CO
FexOy+CO===
3.几种常见的酸性氧化物
CO2
SiO2
SO2
SO3
颜色状态
类别
酸性氧化物的通性
与水
与CaO
与Ca(OH)2
少量:
少量:
过量:
过量:
氧化性
还原性
无
无
可以被
等氧化。
无
特性
⑴
⑵
⑶
可以与有机色素发生
反应而漂白,是性的。
H2SO4(浓)+nSO3=
H2SO4·nSO3
实验室制法
自然界大量存在,不需要制备
4.不成盐氧化物——NO和NO2
⑴NO:
色的气体。
容易被氧气氧化而变成红棕色,方程式为。
利用该反应可以检验NO。
⑵NO2:
色的气体。
可以溶解于水,方程式为
(四)金属氢氧化物(下列表格中,是离子反应的请用离子方程式表示)
NaOH
Al(OH)3
Fe(OH)2
Fe(OH)3
属性
碱性氢氧化物
两性氢氧化物
碱性氢氧化物
碱性氢氧化物
与强酸反应
与强碱反应
不反应
不反应
不反应
热稳定性
稳定
还原性
无还原性
无还原性
Fe(OH)2+O2+H2O=
现象:
无还原性
制备
略
⑴
⑵
用途
化工原料
脱色净水、中和胃酸
净水
净水
(五)酸
1.非氧化性酸的通性:
⑴酸溶液能与酸碱指示剂作用(石蕊遇酸变红,酚酞遇酸不变色)
⑵酸+活泼金属→盐+氢气:
反应条件:
金属活动顺序表H以前的金属置换酸中的H
⑶酸+碱性氧化物→盐+水⑷酸+碱→盐+水⑸酸+盐→新盐+新酸
2.两种常见的氧化性酸——硝酸和浓硫酸
浓硫酸
硝酸
酸的通性
与无还原性的金属氧化物、盐和碱反应体现酸的通性
CuO+H2SO4=
Ba(OH)2+H2SO4=
与无还原性的金属氧化物、盐和碱反应体现酸的通性
CuO+HNO3=
Ba(OH)2+HNO3=
强氧化性
与金属反应
⑴常温下,浓硫酸可以使钝化
⑵在加热条件下可以与除Pt、Au外的金属反应,生成硫酸盐+SO2+H2O
Cu+H2SO4(浓)===
硫酸起作用
⑴常温下,浓硝酸可以使钝化(稀硝酸不可以)
⑵在常温下,浓硝酸和稀硝酸可以与除Pt、Au外的金属反应,生成高价金属的硝酸盐+NO2(或NO)+H2O
Cu+HNO3(浓)===
Cu+HNO3(稀)===
硝酸起作用
与非金属反应
在加热时,浓硫酸与C、S、P等非金属反应,生成最高价稳定性酸或最高价氧化物,浓硫酸被还原为SO2
C+H2SO4(浓)===
S+H2SO4(浓)===
浓硫酸起作用
在加热时,浓硝酸与C、S、P等非金属反应,生成最高价稳定性酸或最高价氧化物,浓硝酸被还原为NO2
C+HNO3(浓)===
S+HNO3(浓)===
硝酸起作用
与还原性化合物反应
能氧化-2的S、-1的I+2的Fe
能氧化-2的S、-1的I、+4的S、+2的Fe
吸水性
可以做干燥剂,不能干燥
无
脱水性
有
无
稳定性
很稳定
不稳定。
方程式为
保存方法
色的试剂瓶
色的试剂瓶
(六)几种盐
1、碳酸钠和碳酸氢钠
名称
Na2CO3
NaHCO3
俗名
水溶性
水溶液的酸碱性
热稳定性
与CO2反应
与酸反应
与碱反应
NaOH
Ca(OH)2
Ca(OH)2(少)
Ca(OH)2(过)
与盐
CaCl2
主要用途
相互转化
2.亚硫酸盐和亚硫酸氢盐
Na2SO3类似于Na2CO3,NaHSO3类似于NaHCO3,只是亚硫酸盐和亚硫酸氢钠具有还原性,能被O2、O3、H2O2、Na2O2、Fe3+、X2、KMnO4、硝酸等氧化剂氧化,均生成Na2SO4。
3.铁盐和亚铁盐
亚铁盐——FeCl2
铁盐——FeCl3
溶液颜色
化学性质
与碱溶液
与NaOH
与氨水
与KSCN
氧化性
与Fe之前的金属单质反应
Zn+Fe2+=
与Ag之前的金属、S2-、I-、SO32-等反应
Fe3++Fe=
Fe3++Cu=
Fe3++Zn(过)=
还原性
与O2、Cl2、H2O2、硝酸等氧化剂反应
Fe2++Cl2=
(“有”或“无”)还原性
相互转化
检验方法
⑴观察法:
溶液为色的是Fe3+,色的是Fe2+。
⑵加碱:
生成色沉淀的是Fe3+,生成色沉淀,迅速变成色,最后转化为色沉淀的是的是Fe2+。
⑶KSCN法(特效试剂):
溶液是Fe3+;溶液不变色,再加,溶液变的是Fe2+。
二、同种元素的单质及其化合物的转化关系
(一)Na及其化合物的转化
(请在下图中填写物质转化的条件和其他的反应物,并按要求填空)
⑴Na与酸混合时,首先与反应,再与反应,一般可以认为Na反应完全,且Na与H2的物质的量之比为。
⑵Na与除酸以外的其他溶液混合,一般先于反应,再考虑生成的NaOH是否与反应。
Na加入到饱和的Ca(OH)2溶液中会观察到现象。
⑶当有H2O、CO2同时存在时,我们认为Na2O2首先与反应。
Na2O2与H2O、CO2和酸反应时,氧化剂是,还原剂是,它们的物质的量之比为,1molNa2O2反应转移的电子数为,生成1molO2转移电子的物质的量为。
⑷CO2与Na2O2反应时,1molCO2充分,反应固体的增加量相等于1molCO,即g。
H2O与Na2O2反应时,1molH2O充分,反应固体的增加量相等于1molH2,即g。
若某物质可以看成(CO)m(H2)n(m和n均≥0,但不同时为0时),ag该物质充分燃烧后的产物与Na2O2充分反应,固体的增加量为g。
⑸碳酸钠、碳酸氢钠分别与盐酸反应,速率较快的是。
若Na2CO3和NaHCO3的质量相同,消耗盐酸多的是,生成CO2多的是。
若Na2CO3和NaHCO3的物质的量相同,消耗盐酸多的是,生成CO2。
(二)Al及其化合物的转化
请在下图中填写物质转化的条件和其他的反应物,并按要求填空
1.请用离子方程式表示制备Al(OH)3的三种方法:
①②
③
2.若相同量的铝与物质的量相同的HCl和NaOH反应,反应的离子方程式分别为,。
若铝完全消耗,生成的H2的物质的量之比为;若酸和碱均消耗完,生成的H2的物质的量之比为;若生成的H2物质的量之比为1:
2,则盐酸烧杯中,反应完,装NaOH烧杯中,反应完。
(三)Fe及其化合物的转化
请在下图中填写物质转化的条件和其他的反应物,并按要求填空
⑴Fe→Fe2+:
可以加入等弱氧化剂。
⑵Fe→Fe3+:
可以加入等强氧化剂。
⑶Fe2+→Fe3+:
可加入等氧化剂。
⑷Fe2+→Fe:
可加入等还原剂。
⑸Fe3+→Fe2+:
可加入等还原剂。
⑹Fe3+→Fe:
可加入等还原剂。
(四)硅及其化合物的转化
请在下图中填写物质转化的条件和其他的反应物,并按要求填空
1.请写出生产玻璃的两个反应方程式