广东佛山市届高三上学期届普通髙中教学质量检测一理科综合化学试题Word版含答案.docx
《广东佛山市届高三上学期届普通髙中教学质量检测一理科综合化学试题Word版含答案.docx》由会员分享,可在线阅读,更多相关《广东佛山市届高三上学期届普通髙中教学质量检测一理科综合化学试题Word版含答案.docx(20页珍藏版)》请在冰豆网上搜索。
广东佛山市届高三上学期届普通髙中教学质量检测一理科综合化学试题Word版含答案
2018~2019学年佛山市普通髙中教学质量检测
(一)
高三理科综合试题(化学部分)
可能用到的相对原子质量:
H-1C-12N-14O-16S-32C1-35.5Ti-48Cu-64
一、选择题:
本题共13个小题,每小题6分,共78分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
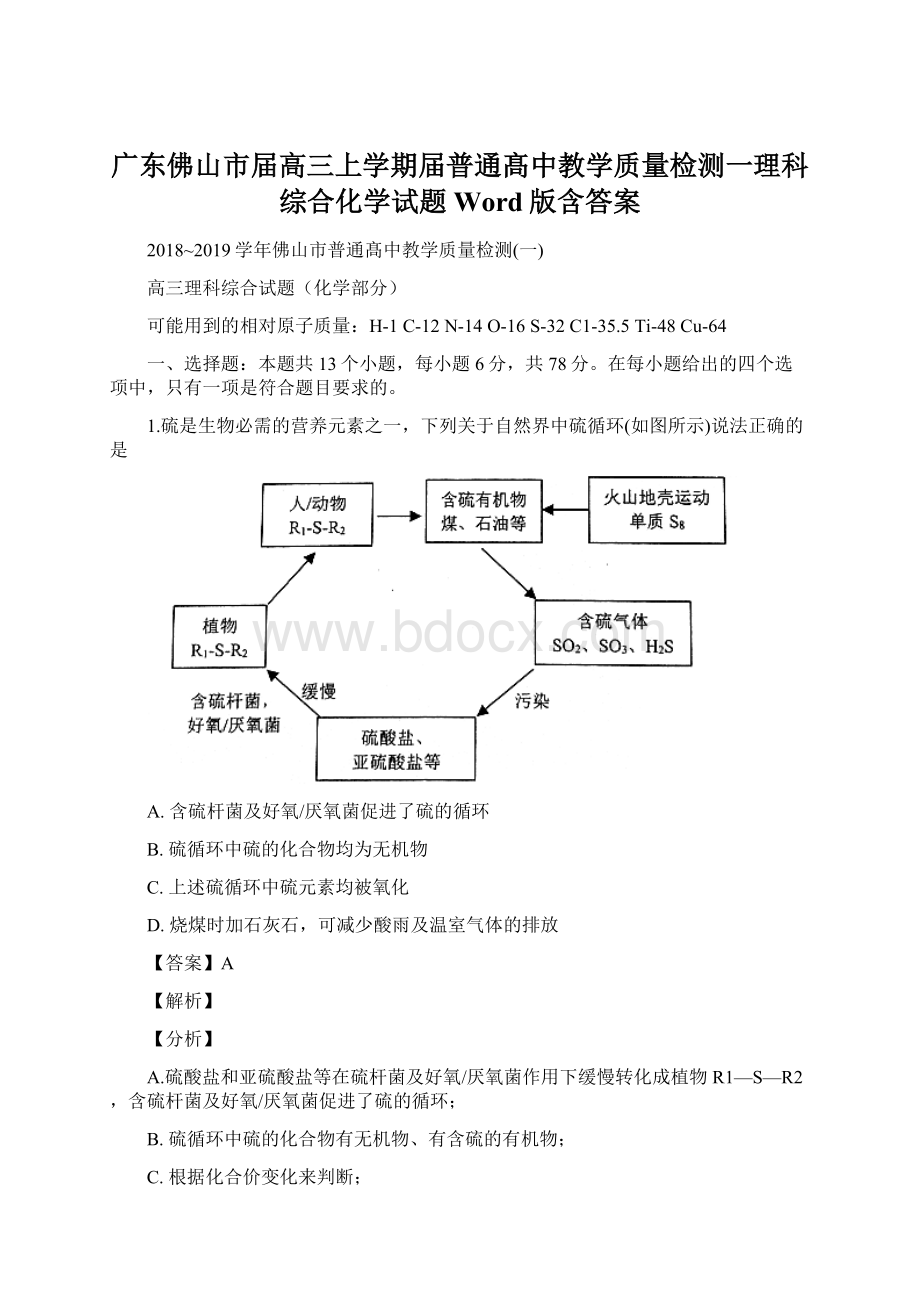
1.硫是生物必需的营养元素之一,下列关于自然界中硫循环(如图所示)说法正确的是
A.含硫杆菌及好氧/厌氧菌促进了硫的循环
B.硫循环中硫的化合物均为无机物
C.上述硫循环中硫元素均被氧化
D.烧煤时加石灰石,可减少酸雨及温室气体的排放
【答案】A
【解析】
【分析】
A.硫酸盐和亚硫酸盐等在硫杆菌及好氧/厌氧菌作用下缓慢转化成植物R1—S—R2,含硫杆菌及好氧/厌氧菌促进了硫的循环;
B.硫循环中硫的化合物有无机物、有含硫的有机物;
C.根据化合价变化来判断;
D.烧煤时加石灰石,生成二氧化碳;
【详解】A.硫酸盐和亚硫酸盐等在硫杆菌及好氧/厌氧菌作用下缓慢转化成植物R1—S—R2,含硫杆菌及好氧/厌氧菌促进了硫的循环,故A正确;
B.硫循环中硫的化合物有含硫的有机物,不全是无机物,故B错误;
C.含硫杆菌及好氧/厌氧菌将硫酸盐、亚硫酸盐中硫还原成R1-S-R2,硫循环中硫元素有时被氧化,有时被还原,故C错误;
D.烧煤时加石灰石,可减少酸雨排放,但生成二氧化碳,增加温室气体的排放,故D错误;
故选A。
2.NA为阿伏加德常数的值。
下列叙述中正确的是
A.标准状况下,2.24LCH3OH中质子数为18NA
B.28gC2H4和C2H6混合气体中氢原子数目为4NA
C.60g乙酸分子中共用电子对数目为8NA
D.1L0.1mol/LHF的水溶液中HF共价键数目为0.1NA
【答案】C
【解析】
【分析】
A.标准状况下,2.24LCH3OH不是气态;
B.C2H4和C2H6分子中氢原子数目为4、6;
C.每个乙酸分子中共用电子对数目为8;
D.HF是弱电解质,部分共价键被拆开;
【详解】A.标准状况下,2.24LCH3OH不是气态,不能用标准状况下气体摩尔体积计算物质的量,故A错误;
B.C2H4和C2H6分子中氢原子数目为4、6,28gC2H4中含H原子物质的量为28g÷28g/mol×4=4mol,28gC2H6中含H原子物质的量为28g÷30g/mol×6=5.6mol,故B错误;
C.60gCH3COOH物质的量为1mol,每个乙酸分子中共用电子对数目为8,60g乙酸分子中含共用电子对数目为8NA,故C正确;
D.HF是弱电解质,部分共价键被拆开,1L0.1mol/LHF的水溶液中HF共价键数目少于0.1NA,故D错误;
故选C。
3.某防晒产品中含水杨酸乙基己酯(结构简式如图)、丙烯酸(CH2=CH-COOH)、甘油(丙三醇)、水等物质。
下列说法错误的是
A.甘油具有保湿作用
B.水杨酸乙基己酯结构中所有的碳原子均可共面
C.水杨酸乙基己酯苯环上的一氯代物有四种
D.丙烯酸可发生加成、取代和氧化反应
【答案】B
【解析】
【分析】
A.甘油中羟基是亲水基团,易吸水;
B.水杨酸乙基己酯结构中有一个采用sp3杂化的碳原子与三个碳原子相连;
C.水杨酸乙基己酯苯环上有四种氢原子;
D.根据丙烯酸中碳碳双键、羧基官能团的性质解答。
【详解】A.甘油中羟基是亲水基团,易吸水,甘油具有保湿作用,故A正确;
B.水杨酸乙基己酯结构中有一个采用sp3杂化的碳原子与三个碳原子相连,呈四面体结构,水杨酸乙基己酯结构中所有的碳不可能共面,故B错误;
C.水杨酸乙基己酯苯环上有四种氢原子,能形成四种苯环上的一氯代物,故C正确;
D.丙烯酸中含碳碳双键,能发生加成反应、氧化反应,含羧基能发生取代,故D正确。
故选B。
4.图甲~丁中关于海带提取碘的部分实验操作及目的正确的是
A.装置甲的作用是使海带中I2升华
B.装置乙加H2O2发生置换反应生成I2
C.装置丙用于富集水溶液中的I2
D.装置丁用于分离I2和水的混合物
【答案】C
【解析】
【分析】
A.装置甲的作用是通过灼烧除去海带中有机物杂质;
B.H2O2是氧化剂,将碘离子氧化生成I2;
C.用萃取法提取水溶液中的I2;
D.I2和四氯化碳的混合物,用蒸馏法分离。
【详解】A.装置甲的作用是通过灼烧除去海带中有机物杂质,再溶解过滤获取海带中碘的无机盐,故A错误;
B.H2O2是氧化剂,将碘离子氧化生成I2,不是置换反应,故B错误;
C.用萃取法提取水溶液中的I2,达到富集水溶液中的I2目的,故C正确;
D.利用I2和四氯化碳沸点差别较大的性质,I2和四氯化碳的混合物,用蒸馏法分离,回收四氯化碳,同时获得碘单质,故D错误。
故选C。
5.我国研制出非贵金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图)。
总反应为CO(NH2)2+H2O=3H2↑+N2↑+CO2↑。
下列说法中错误的是
A.a为阳极,CO(NH2)2发生氧化反应
B.b电极反应为:
2H2O+2e-=H2↑+2OH-
C.每转移6mol电子,a电极产生1molN2
D.电解一段时间,a极区溶液pH升高
【答案】D
【解析】
【分析】
A、电解池工作时,CO(NH2)2失去电子,a为阳极发生氧化反应;
B、阴极产生H2,则阴极反应式为:
2H2O+2e-═2OH-+H2↑;
C、阳极的电极反应式为:
CO(NH2)2-6e-+H2O═CO2↑+N2↑+6H+,根据电极反应计算;
D、a极发生CO(NH2)2-6e-+H2O═CO2↑+N2↑+6H+,a极区溶液pH降低。
【详解】A、电解池工作时,CO(NH2)2失去电子,a为阳极发生氧化反应,故A正确;
B、阴极水得电子产生H2,则阴极反应式为:
2H2O+2e-═2OH-+H2↑,故B正确;
C、阳极的电极反应式为:
CO(NH2)2-6e-+H2O═CO2↑+N2↑+6H+,若电路中通过6mol电子,阳极产生N2的物质的量为n(N2)=6mol×1/6=1mol,故C正确;
D、a极发生CO(NH2)2-6e-+H2O═CO2↑+N2↑+6H+,a极区溶液中氢离子浓度增大,溶液的pH降低,故D错误。
故选D。
【点睛】本题考查电解原理,解题关键:
明确电极反应式。
难点C,根据电极反应计算。
6.已知W、X、Y、Z为原子序数依次增大的短周期元素,W与Z同主族,X与Y同周期,且Y与Z的原子序数之和为20。
Y单质能与无色无味液体m反应置换出X单质,Z单质也能与m反应置换出W单质。
W、X、Y均能与Z形成离子化合物。
下列说法错误的是
A.X、Z两元素的简单离子电子层结构相同
B.X与Z形成的离子化合物一定只含有离子键
C.Y的氢化物比X的氢化物稳定
D.W与Y形成的化合物WY可刻蚀玻璃
【答案】B
【解析】
【分析】
无色无味液体m是水,Y单质能与无色无味液体m反应置换出X单质,Z单质也能与m反应置换出W单质。
Y和Z单质,一个是强还原剂钠,一个是强氧化剂氟气,且Y与Z的原子序数之和为20,得Z为钠,Y为氟,W是氢,X是氧。
W、X、Y均能与Z形成离子化合物NaH、Na2O、Na2O2、NaF。
【详解】A.O2-、Na+两简单离子电子层结构相同,都是两层电子,分别为2、8个电子,故A正确;
B.X与Z形成的离子化合物Na2O、Na2O2一定含有离子键,Na2O2含有共价键,故B错误;
C.非金属性F>O,则气态氢化物的稳定性:
Y的氢化物HF比X的氢化物H2O稳定,故C正确;
D.SiO2+4HF=SiF4+2H2O,W与Y形成的化合物HF可刻蚀玻璃,故D正确;
故选B。
【点睛】本题考查原子结构与元素周期律,解题关键:
把握元素的性质、原子结构、原子序数来推断元素,难点元素的推断,注意规律性知识及元素化合物知识的应用,从氟气与水、钠与水发生置换反应突破。
7.常温下,向20mL0.1moL/L的H3PO4溶液中滴加0.1moL/L的NaOH溶液,所得溶液的pH与NaOH溶液体积的关系如图所示,下列说法正确的是
A.H3PO4溶液第一步滴定可用酚酞作指示剂
B.A点溶液中c(H2PO4-)>c(H3PO4)>c(HPO42-)
C.图像中A、B、C三处溶液中
相等
D.B点溶液存在2c(Na+)=c(PO43-)+c(H2PO4-)+c(HPO42-)+c(H3PO4)
【答案】C
【解析】
【分析】
A、H3PO4溶液第一步滴定生成NaH2PO4,溶液呈酸性,选变色范围为酸性的指示剂;
B、NaH2PO4在水溶液中,电离大于水解;
C、温度相同,同一反应的平衡常数相同;
D、B点是Na2HPO4溶液,用物料守恒去解。
【详解】A、H3PO4溶液第一步滴定生成NaH2PO4,溶液呈酸性,选变色范围为酸性的指示剂,可选用甲基橙作指示剂,故A错误;
B、A点为NaH2PO4溶液,NaH2PO4在水溶液中,电离大于水解,A点溶液中c(H2PO4-)>c(HPO42-)>c(H3PO4),故B错误;
C、温度相同,同一反应的平衡常数相同,HPO42-水解常数:
A、B、C三处溶液中
相等,故C正确;
D、B点是Na2HPO4溶液,物料守恒为:
c(Na+)=2[c(PO43-)+c(H2PO4-)+c(HPO42-)+c(H3PO4)],故D错误。
故选C。
【点睛】本题考查了离子浓度大小比较、盐水解电离等知识,解题关键:
明确反应后溶质组成,注意掌握电荷守恒、物料守恒、盐的水解原理在判断离子浓度大小中的应用方法。
二、非选择题:
共174分。
第22~32题为必考题,每个试题考生都必须作答。
第33~38题为选考题,考生根据要求作答。
8.葡萄糖酸亚铁【(C6H11O7)2Fe】是常用的补铁剂,易溶于水,几乎不溶于乙醇。
用下图装置制备FeCO3,并利用FeCO3与葡萄糖酸反应可得葡萄糖酸亚铁。
回答下列问题:
(1)a的名称为_________。
(2)打开a中K1、K3,关闭K2,一段时间后,关闭K3,打开K2。
在_________(填仪器标号)中制得碳酸亚铁。
实验过程中产生的H2作用有_________、____________。
(写2条)
(3)将制得的碳酸亚铁浊液过滤、洗涤。
如过滤时间过长会发现产品部分变为红褐色。
用化学方程式说明原因____________。
(4)将葡萄糖酸与碳酸亚铁混合,加入乙醇、过滤、洗涤、干燥。
加入乙醇的目的是_________________。
(5)用NaHCO3溶液代替Na2CO3溶液制备碳酸亚铁,同时有气体产生,离子方程式为______________,此法产品纯度更高,原因是_______________。
【答案】
(1).恒压滴液漏斗
(2).c(3).排出装置内的空气,防止生成的FeCO3被氧化(4).将b中溶液压入c中(5).4FeCO3+O2+6H2O=4Fe(OH)3+4CO2(6).降低葡萄糖酸亚铁在水中溶解度(7).Fe2++2HCO3-=FeCO3↓+H2O+CO2↑(8).降低溶液的pH以免产生氢氧化亚铁
【解析】
【分析】
(1)a的名称为恒压滴液漏斗;
(2)b中产生的硫酸亚铁被氢气压入c中与碳酸钠作用产生碳酸亚铁;实验过程中产生的H2作用还有:
排出装置内的空气,防止生成的FeCO3被氧化;
(3)FeCO3与O2反应生成红褐色Fe(OH)3;
(4)乙醇分子的极性