实验与工艺流程.docx
《实验与工艺流程.docx》由会员分享,可在线阅读,更多相关《实验与工艺流程.docx(15页珍藏版)》请在冰豆网上搜索。
实验与工艺流程
S02,将足量S02通入AgNO3溶液中,迅速反应,
1化学小组实验探究S02与AgN03溶液的反应。
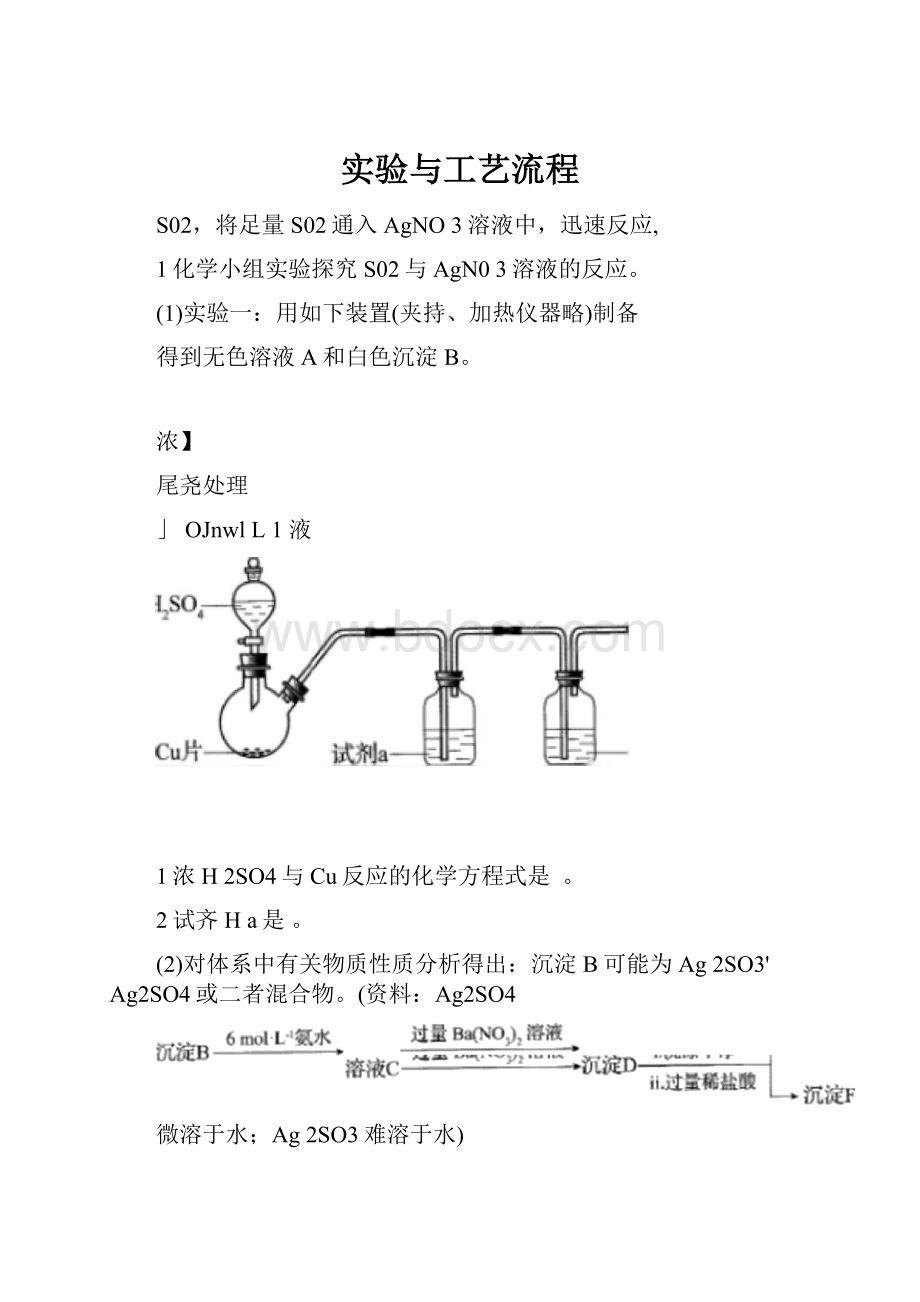
(1)实验一:
用如下装置(夹持、加热仪器略)制备
得到无色溶液A和白色沉淀B。
浓】
尾尧处理
」OJnwlL1液
1浓H2SO4与Cu反应的化学方程式是。
2试齐Ha是。
(2)对体系中有关物质性质分析得出:
沉淀B可能为Ag2SO3'Ag2SO4或二者混合物。
(资料:
Ag2SO4
微溶于水;Ag2SO3难溶于水)
实验二:
验证B的成分
1写出Ag2SO3溶于氨水的离子方程式:
。
2加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。
推断D中主要是BaSO3,进而推断B中含有AgzSOs。
向滤液E中加入一种试剂,可进一步证实B中含有Ag2SO3。
所用试剂及现象是。
(3)根据沉淀F的存在,推测SO42-的产生有两个途径:
途径1实验一中,SO2在AgNO3溶液中被氧化生成Ag2SO4,随沉淀B进入D。
途径2:
实验二中,SO32-被氧化为SO42-进入D。
实验三:
探究SO42-的产生途径
1向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有:
取上层清液继续滴加BaCS
溶液,未出现白色沉淀,可判断B中不含Ag2SO4。
做出判断的理由:
。
2实验三的结论:
。
(4)实验一中SO2与AgNO3溶液反应的离子方程式是。
(5)根据物质性质分析,SO2与AgNO3溶液应该可以发生氧化还原反应。
将实验一所得混合物放置一段时间,有Ag和SO42-生成。
(6)根据上述实验所得结论:
。
2.N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。
N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。
NH3与。
2在加
热和催化剂作用下生成N2O的化学方程式为。
(2)NO和NO?
的处理。
已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH2NO2+H2O
2NO2+2OH-NO2-+NO3-+H2O
1下列措施能提高尾气中NO和NO?
去除率的有(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
2吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是(填化学
式);吸收后排放的尾气中含量较高的氮氧化物是(填化学式)。
(3)NO的氧化吸收。
用NaCIO溶液吸收硝酸尾气,可提高尾气中NO的去除率。
其他条件相同,NO转
化为NOJ的转化率随NaCIO溶液初始pH(用稀盐酸调节)的变化如图所示。
1在酸性NaCIO溶液中,HCIO氧化NO生成CI-和NO3-,其离子方程式为。
2NaCIO溶液的初始pH越小,NO转化率越高。
其原因是。
100
W
80
70
60
246810
卩H
3.硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工业。
一种以硼镁矿(含Mg2B2O5?
H2O、SiO2及少量Fe2O3、AI2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
蓉液滅渣]
——————pH=3一
硼镁矿粉一*濬浸—►过激1*过滤2—►耳;
气体一H吸收£沉訂—Mg(OH)rMgCO.—►轻质氧化镁
溶液母液
回答下列问题:
(1)在95C“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为。
(2)“滤渣1”的主要成分有。
为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学
试齐U是。
+——10
(3)根据H3BO3的解离反应:
H3BO3+H2O?
H+B(OH)4,Ka=5.81X10,可判断H3BO3是酸;
在“过滤2”前,将溶液pH调节至3.5,目的是。
(4)在"沉镁”中生成Mg(OH)2?
MgC03沉淀的离子方程式为,母液经加热后可返回工
序循环使用。
由碱式碳酸镁制备轻质氧化镁的方法是。
4.硫酸铁铵[NH4Fe(S04)2?
xH2O]是一种重要铁盐。
为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如图:
回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是。
(2)步骤②需要加热的目的是,温度保持80-95C,采用的合适加热方式是。
铁屑中
含有少量硫化物,反应产生的气体需要净化处理,合适的装置为(填标号)。
(3)步骤③中选用足量的H2O2,理由是。
分批加入H2O2,同时为了,溶液要保持pH
小于0.5。
(4)步骤⑤的具体实验操作有,经干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150C时失掉1.5个结晶水,
失重5.6%•硫酸铁铵晶体的化学式为。
5•高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、
Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。
回答下列问题:
相关金属离子[C0(Mn+)=0.1mol?
L1]形成氢氧化物沉淀的pH范围如下:
金属离子
Mn2+
2+
Fe
3+
Fe
3+
Al
2+
Mg
2+
Zn
2+
Ni
开始沉淀的pH
8.1
6.3
1.5
3.4
8.9
6.2
6.9
沉淀完全的pH
10.1
8.3
2.8
4.7
10.9
8.2
8.9
(1)滤渣1”含有S和;写出溶浸”中二氧化锰与硫化锰反应的化学方程式
(2)氧化”中添加适量的MnO2的作用是。
(3)调pH'除铁和铝,溶液的pH范围应调节为〜6之间。
(4)除杂1”的目的是除去Zn2+和Ni2+,滤渣3”的主要成分是。
(5)除杂2”的目的是生成MgF2沉淀除去Mg2+.若溶液酸度过高,Mg2+沉淀不完全,原因是
(6)写出沉锰”的离子方程式。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、
Mn的化合价分别为+2、+3、+4.当x=y=丄时,z=。
6.乙酰水杨酸(阿司匹林)是目前常用药物之一。
实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如图:
水杨陵酉昔酸酎乙験水杨酸
水杨酸
醋酸酐
乙酰水杨酸
熔点/C
157〜159
-72——74
135〜138
相对密度/(g?
cm「3)
1.44
1.10
1.35
相对分子质量
138
102
180
实验过程:
在100mL锥形瓶中加入水杨酸6.9g及醋酸酐10mL,充分摇动使固体完全溶解。
缓慢滴加
0.5mL浓硫酸后加热,维持瓶内温度在70C左右,充分反应。
稍冷后进行如下操作。
1在不断搅拌下将反应后的混合物倒入100mL冷水中,析出固体,过滤。
2所得结晶粗品加入50mL饱和碳酸氢钠溶液,溶解、过滤。
3滤液用浓盐酸酸化后冷却、过滤得固体。
4固体经纯化得白色的乙酰水杨酸晶体5.4g。
回答下列问题:
(1)该合成反应中应采用加热。
(填标号)
A.热水浴B.酒精灯C.煤气灯D.电炉
(2)下列玻璃仪器中,①中需使用的有(填标号),不需使用的有(填名称)。
(3)①中需使用冷水,目的是。
(4)②中饱和碳酸氢钠的作用是,以便过滤除去难溶杂质。
(5)④采用的纯化方法为。
(6)本实验的产率是%。
7•多晶硅是制作光伏电池的关键材料。
以下是由粗硅制备多晶硅的简易过程。
回答下列问题:
n.将SiCl4氢化为SiHCI3有三种方法,对应的反应依次为:
1SiCl4gH2gL二SiHCbgHCIgHiO
23SiCl4g2H2gSisLL二4SiHCl3g比:
:
0
32SiCl4gH2gSisHCIg3SiHCl3g$3
(1)氢化过程中所需的高纯度H2可用惰性电极电解KOH溶液制备,写出产生H2的电极名称
(填阳极”或阴极)该电极反应方程式为
(2)已知体系自由能变丁汨-TS,.G:
:
:
0时反应自发进行。
三个氢化反应的-G与温度的关系
如图1所示,可知:
反应①能自发进行的最低温度是;相同温度下,反应②比反应
①的笙小,主要原因是。
(3)不同温度下反应②中SiCI4转化率如图2所示。
下列叙述正确的是(填序号)。
a.B点:
V正•V逆b.Ve:
A点点c.反应适宜温度:
480、520°C
(4)反应③的.汨3二(用.H1,.H2表示)。
温度升高,反应③的平衡常数K(填增
大”减小”或不变”。
(5)由粗硅制备多晶硅过程中循环使用的物质除SiCI4、SiHCI3和Si外,还有(填分子式)。
8.
环己烯是重要的化工原料。
其实验室制备流程如下:
OH
回答下列问题:
I.环己烯的制备与提纯
(1)原料环己醇中若含苯酚杂质,检验试剂为,现象为
(2)操作1的装置如图所示(加热和夹持装置已略去)
化剂,选择FeCS6H2O而不用浓硫酸的原因为(填序号)。
a.浓硫酸易使原料炭化并产生SO2b.FeCl36H2O污染小、可循环使用,符合绿色化学理念c.同等条件下,用FeCl36H2O比浓硫酸的平衡转化率高
②仪器B的作用为。
(3)操作2用到的玻璃仪器是。
(4)将操作3(蒸馏)的步骤补齐:
安装蒸馏装置,加入待蒸馏的物质和沸石,,弃去前
馏分,收集83C的馏分。
n.环己烯含量的测定
在一定条件下,向ag环己烯样品中加入定量制得的bmoib「2,与环己烯充分反应后,剩余的b「2与足量
KI作用生成I?
,用cmolL丄的N82S2O3标准溶液滴定,终点时消耗NazSOs标准溶液vmL(以上数据均已扣除干扰因素)。
测定过程中,发生的反应如下:
3
②Ba2KI—I?
2KBr
l2-2Na2S2O32NalNa2S4O6
(5)滴定所用指示剂为。
样品中环己烯的质量分数为(用字母表示)
(6)下列情况会导致测定结果偏低的是(填序号)。
a.样品中含有苯酚杂质
b.在测定过程中部分环己烯挥发
c.NazSOs标准溶液部分被氧化
9.咖啡因是一种生物碱(易溶于水及乙醇,熔点234.5C,100C以上开始升华),有兴奋大脑神经和利尿
等作用。
茶叶中含咖啡因约1%~5%、单宁酸(Ka约为10卫,易溶于水及乙醇)约3%~10%,还含有色素、
(3)提取液需经蒸馏浓缩”除去大部分溶剂。
与水相比,乙醇作为萃取剂的优点计、接收管之外,还有
(5)可采用如右图所示的简易装置分离提纯咖啡因。
将粉状物放入蒸发皿中并小
火加热,咖啡因在扎有小孔的滤纸上凝结,该分离提纯方法的名称是
1.
(1)①Cu+2H2SO4(浓)一CUSO4+SO2f+H20②饱和NaHS03溶液
(2)①Ag2SO3+4NH3H2O=2Ag(NH3)2++SO32-+4出0
②H2O2溶液,产生白色沉淀
(3)①Ag+Ag2SO4溶解度大于BaSO4,没有BaSO4沉淀时,必定没有Ag2SO4
②途径1不产生SO42-,途径2产生SO42-
(4)2Ag++SO2+H2O=Ag2SO3^+2H
(6)实验条件下:
SO2与AgNO3溶液生成Ag2SO3的速率大于生成Ag和的SO42-速率碱性溶液中SO32-
更易被氧化为SO42-
2.
(1)2NH3+2O2'N2O+3H2O
(2)①BC②NaNOsNO
A
(3)①3HC1O+2NO+H2。
^=3C「+2NO3-+5H+
②溶液pH越小,溶液中HCIO的浓度越大,氧化NO的能力越强
3.
(1)NH4HCO3+NH3(NH4)2CO3
(2)SQ2、Fe2O3、Al2O3KSCN
(3)一元弱转化为H3BO3,促进析出
(4)2Mg2++3CO;G2H2OMg(OH)2MgCO3妊2HCO「
(或2Mg2++2CO;—+H2O^=Mg(OH)2MgCOsJ+COzf)溶浸高温焙烧
4.
(1)碱煮水洗
(2)加快反应热水浴C
(3)将Fe2+全部氧化为Fe3+;不引入杂质防止Fe3+水解
(4)加热浓缩、冷却结晶、过滤(洗涤)
(5)NH4Fe(SO4)212H2O
5.
(1)SiO2(不溶性硅酸盐)MnO2+MnS+2H2SO4=2MnSO4+S+2H2O
(2[将卩©2+氧化为Fe3+(3)4.7(4)NiS和ZnS
(5)F与H+结合形成弱电解质HF,MgF2hMg2++2F-平衡向右移动
(6)Mn+2HCO3~=MnCO3J+CO2I+H2O(7)1/36.
(1)A
(2)BD分液漏斗、容量瓶
(3)充分析出乙酰水杨酸固体(结晶)
(4)生成可溶的乙酰水杨酸钠
(5)重结晶
(6)60
H=—225kJmo「
r300c
7.I•Sis3HClg^=SiHC4g出g
xi:
:
CKS1X1:
■*■
Jt
(1)阴极
2H2O2e^=H22OH■或2H2e^=H2
(2)1000C:
H2...Hi导致反应②的,\G小
(3)a、c
(4)减小
(5)HCI、H2
8
(1)FeCl3溶液溶液显紫色
(3)分液漏斗、烧杯
9.
(1)增加固液接触面积,提取充分;沸石
(2)乙醇易挥发,易燃;使用溶剂量少,可连续萃取(萃取小率高)
(3)AC
(4)单宁酸;水
(5)升华