初中化学重点难点知识点总结精简版卢克敏.docx
《初中化学重点难点知识点总结精简版卢克敏.docx》由会员分享,可在线阅读,更多相关《初中化学重点难点知识点总结精简版卢克敏.docx(36页珍藏版)》请在冰豆网上搜索。
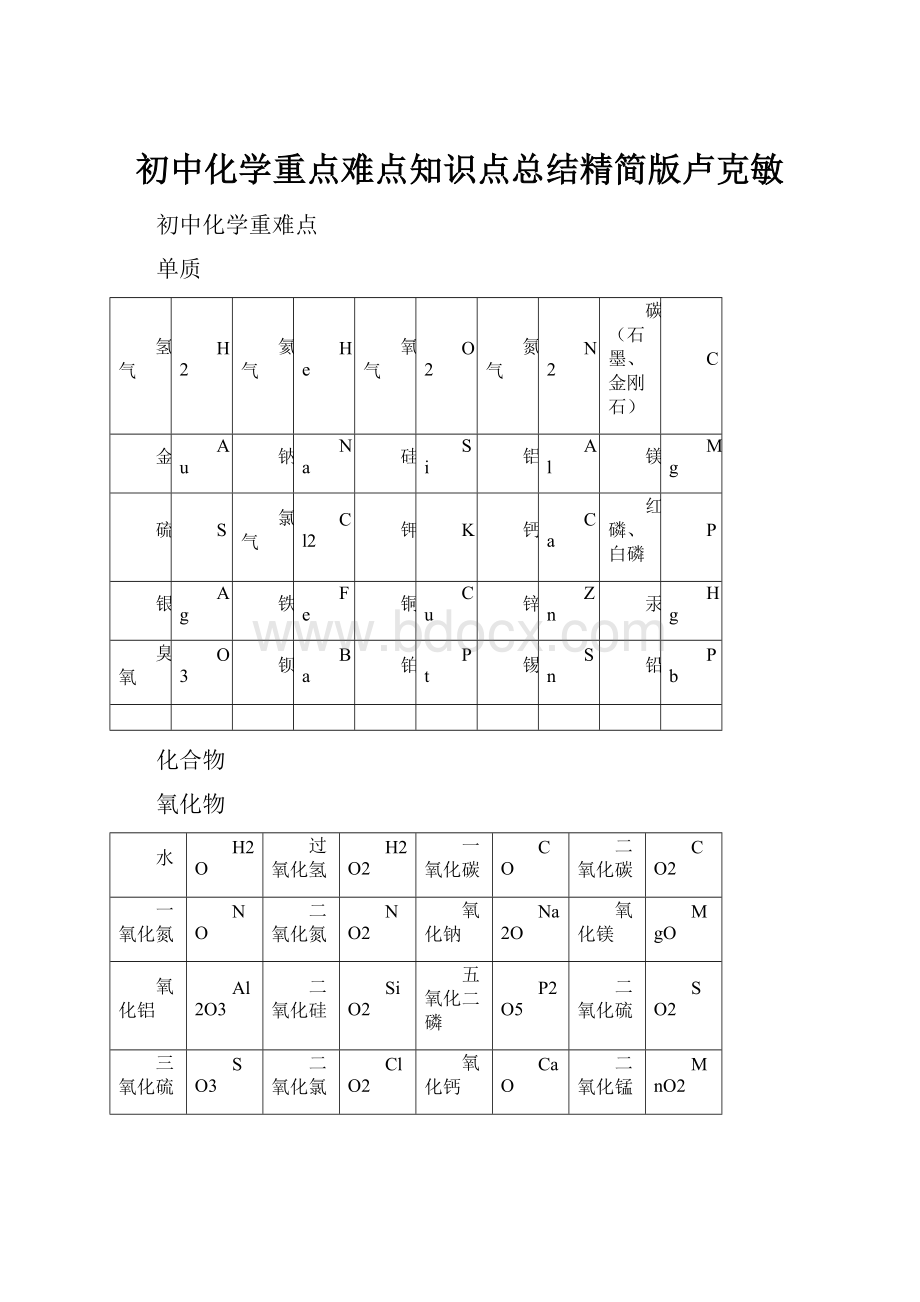
初中化学重点难点知识点总结精简版卢克敏
初中化学重难点
单质
氢气
H2
氦气
He
氧气
O2
氮气
N2
碳(石墨、金刚石)
C
金
Au
钠
Na
硅
Si
铝
Al
镁
Mg
硫
S
氯气
Cl2
钾
K
钙
Ca
红磷、白磷
P
银
Ag
铁
Fe
铜
Cu
锌
Zn
汞
Hg
臭氧
O3
钡
Ba
铂
Pt
锡
Sn
铅
Pb
化合物
氧化物
水
H2O
过氧化氢
H2O2
一氧化碳
CO
二氧化碳
CO2
一氧化氮
NO
二氧化氮
NO2
氧化钠
Na2O
氧化镁
MgO
氧化铝
Al2O3
二氧化硅
SiO2
五氧化二磷
P2O5
二氧化硫
SO2
三氧化硫
SO3
二氧化氯
ClO2
氧化钙
CaO
二氧化锰
MnO2
氧化亚铁
FeO
氧化铁
Fe2O3
四氧化三铁
Fe3O4
氧化铜
CuO
氧化银
Ag2O
氧化汞
HgO
一氧化二氮
N2O
酸
硝酸
HNO3
盐酸
HCl
硫酸
H2SO4
亚硫酸
H2SO3
碳酸
H2CO3
氢氟酸
HF
氢硫酸
H2S
乙酸(醋酸)
CH3COOH
碱
氨水
NH3·H2O
氢氧化钾
KOH
氢氧化钠
NaOH
氢氧化钡
Ba(OH)2
氢氧化钙
Ca(OH)2
氢氧化镁
Mg(OH)2
氢氧化铝
Al(OH)3
氢氧化铜
Cu(OH)2
氢氧化铁
Fe(OH)3
盐
NO3-
Cl-
SO42-
CO32-
NH4+
NH4NO3
硝酸铵
NH4Cl
氯化铵
(NH4)2SO4
硫酸铵
(NH4)2CO3
碳酸铵
K+
KNO3
硝酸钾
KCl
氯化钾
K2SO4
硫酸钾
K2CO3
碳酸钾
Na+
NaNO3
硝酸钠
NaCl
氯化钠
Na2SO4
硫酸钠
Na2CO3
碳酸钠
Ba2+
Ba(NO3)2
硝酸钡
BaCl2
氯化钡
BaSO4
硫酸钡
BaCO3
碳酸钡
Ca2+
Ca(NO3)2
硝酸钙
CaCl2
氯化钙
CaSO4
硫酸钙
CaCO3
碳酸钙
Mg2+
Mg(NO3)2
硝酸镁
MgCl2
氯化镁
MgSO4
硫酸镁
MgCO3
碳酸镁
Al3+
Al(NO3)3
硝酸铝
AlCl3
氯化铝
Al2(SO4)3
硫酸铝
Zn2+
Zn(NO3)2
硝酸锌
ZnCl2
氯化锌
ZnSO4
硫酸锌
ZnCO3
碳酸锌
Fe2+
Fe(NO3)2
硝酸亚铁
FeCl2
氯化亚铁
FeSO4
硫酸亚铁
FeCO3
碳酸亚铁
Fe3+
Fe(NO3)3
硝酸铁
FeCl3
氯化铁
Fe2(SO4)3
硫酸铁
Cu2+
Cu(NO3)2
硝酸铜
CuCl2
氯化铜
CuSO4
硫酸铜
Ag+
AgNO3
硝酸银
AgCl
氯化银
Ag2SO4
硫酸银
Ag2CO3
碳酸银
高锰酸钾
KMnO4
氯酸钾
KClO3
锰酸钾
K2MnO4
碳酸氢钙
Ca(HCO3)2
硫酸铜晶体
CuSO4·5H2O
碳酸钠晶体
Na2CO3·10H2O
碳酸氢铵
NH4HCO3
磷酸钙
Ca3(PO4)2
磷酸二氢钙
Ca(H2PO4)2
碳酸氢钠
NaHCO3
亚硝酸钠
NaNO2
磷酸二氢铵
NH4H2PO4
磷酸氢二铵
(NH4)2HPO4
羟基磷酸钙
Ca10(PO4)6(OH)2
有机物
甲烷
CH4
乙醇(酒精)
C2H5OH
乙酸(醋酸)
CH3COOH
淀粉
(C6H10O5)n
葡萄糖
C6H12O6
蔗糖
C12H22O11
尿素
CO(NH2)2
其他:
氨气NH3
常见物质的俗名
名称
俗名
化学式
名称
俗名
化学式
碳酸钠
苏打、纯碱
Na2CO3
氧化钙
生石灰
CaO
碳酸钠晶体
天然碱、石碱、口碱
Na2CO3·10H2O
固体二氧化碳
干冰
CO2
碳酸氢钠
小苏打
NaHCO
一氧化碳和氢气
水煤气
CO和H2
氢氧化钠
烧碱、火碱、苛性钠
NaOH
硫酸铜晶体
胆矾、蓝矾
CuSO4·5H2O
氢氧化钙
熟石灰
Ca(OH)2
甲烷
沼气
CH4
常见的化学方程式
化合反应
●红磷在空气中燃烧,产生白烟:
4P+5O2
2P2O5
白磷自燃:
4P+5O2=2P2O5
●木炭充分燃烧:
C+O2
CO2
●木炭不充分燃烧:
2C+O2
2CO
●硫在空气(氧气)中燃烧:
S+O2
SO2
●铁丝在氧气中燃烧:
3Fe+2O2
Fe3O4
●铝在氧气中燃烧:
4Al+3O2
2Al2O3
铝不易生锈的原因:
4Al+3O2=2Al2O3
●镁在空气中燃烧:
2Mg+O2
2MgO
●铜在空气中加热:
2Cu+O2
2CuO
●氢气在氧气中燃烧:
2H2+O2
2H2O
●将CO2变成CO:
C+CO2
2CO
●二氧化碳溶于水形成碳酸:
CO2+H2O=H2CO3
●用生石灰制取熟石灰:
CaO+H2O=Ca(OH)2
●一氧化碳燃烧:
2CO+O2
2CO2
●向澄清的石灰水中通入过量的二氧化碳,变浑浊的石灰水又变澄清:
CaCO3+CO2+H2O=Ca(HCO3)2
●氢气在氯气中燃烧:
H2+Cl2
2HCl
钠在氯气中燃烧:
2Na+Cl2
2NaCl
镁在氮气中燃烧:
3Mg+N2
Mg3N2(注意氮元素的化合价)
镁在二氧化碳中燃烧:
2Mg+CO2→点燃2MgO+C
上面三个化学方程式给我们的启示是:
燃烧不一定有氧气参与。
分解反应
●汞在空气中加热:
2Hg+O2
2HgO
●氧化汞加强热:
2HgO
2Hg+O2↑
●分解过氧化氢制取氧气(实验室制取氧气的反应原理之一):
2H2O2
2H2O+O2↑
加热高锰酸钾制取氧气(实验室制取氧气的反应原理之一):
2KMnO4
K2MnO4+MnO2+O2↑
加热氯酸钾制取氧气(实验室制取氧气的反应原理之一):
2KClO3
2KCl+3O2↑
分解过氧化氢制取氧气符合绿色化学的观念,是三种方案中最安全、最节约资源的一种。
●电解水生成氢气和氧气:
2H2O
2H2↑+O2↑
●工业制取生石灰和CO2的反应原理:
CaCO3
CaO+CO2↑
●干粉灭火器的反应原理(碳酸氢钠受热分解):
2NaHCO3
Na2CO3+H2O+CO2↑
●碱式碳酸铜受热分解:
Cu2(OH)2CO3
2CuO+H2O+CO2↑
●过氧化氢溶液不稳定,发生分解:
2H2O2=2H2O+O2↑
●碳酸不稳定,分解成水和二氧化碳:
H2CO3=H2O+CO2↑
●石笋、钟乳石的形成过程:
CaCO3+CO2+H2O=Ca(HCO3)2Ca(HCO3)2=CaCO3↓+CO2↑+H2O
置换反应
●氢气还原氧化铜:
H2+CuO
Cu+H2O
●木炭还原氧化铜:
C+2CuO
2Cu+CO2↑
●木炭还原氧化铁:
3C+2Fe2O3
4Fe+3CO2↑
●水煤气的形成:
C+H2O
H2+CO(注意没有气体生成符号↑)
●实验室制取氢气的反应原理:
Zn+H2SO4=ZnSO4+H2↑
●金属与稀盐酸的反应
⏹2X+2HCl=2XCl+H2↑(X是+1价的金属,包括K、Na)
⏹X+2HCl=XCl2+H2↑(X是+2价的金属,包括Ca、Mg、Zn、Fe)
⏹2Al+6HCl=2AlCl3+3H2↑
●金属与稀硫酸的反应
⏹2X+H2SO4=X2SO4+H2↑(X是+1价的金属,包括K、Na)
⏹X+H2SO4=XSO4+H2↑(X是+2价的金属,包括Ca、Mg、Zn、Fe)
⏹2Al+3H2SO4=Al2(SO4)3+3H2↑
●金属与盐溶液的反应
⏹Cu+2AgNO3=Cu(NO3)2+2Ag
⏹K、Ca、Na不遵循这样的置换反应,它们与盐溶液反应时,会先和水反应生成对应的碱,然后再和盐溶液反应。
如:
2Na+2H2O=2NaOH+H2↑NaOH+CuSO4=Na2SO4+Cu(OH)2↓
●镁在二氧化碳中燃烧:
2Mg+CO2
2MgO+C
复分解反应
●NaOH溶液与稀盐酸反应:
NaOH+HCl=NaCl+H2O
●NaOH溶液与稀硫酸反应:
2NaOH+H2SO4=Na2SO4+2H2O
●Ba(OH)2溶液与稀硫酸反应:
Ba(OH)2+H2SO4=BaSO4↓+2H2O
●用胃舒平(氢氧化铝)中和过多的胃酸:
Al(OH)3+3HCl=AlCl3+3H2O
●用氢氧化镁中和过多的胃酸:
Mg(OH)2+2HCl=MgCl2+2H2O
●用熟石灰中和含有硫酸的污水:
Ca(OH)2+H2SO4=CaSO4+2H2O
●稀盐酸除铁锈:
Fe2O3+6HCl=2FeCl3+3H2O
●稀硫酸除铁锈:
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
●稀盐酸与氧化铜反应:
CuO+2HCl=CuCl2+H2O
●稀硫酸与氧化铜反应(制取CuSO4):
CuO+H2SO4=CuSO4+H2O
●提示:
CaO、Na2O、K2O、BaO可以直接和酸反应。
●实验室制取CO2的反应原理:
CaCO3+2HCl=CaCl2+H2O+CO2↑
●盐酸与水垢中的主要成分发生反应:
CaCO3+2HCl=CaCl2+H2O+CO2↑
●实验室不用大理石和稀硫酸制取CO2的原因:
CaCO3+H2SO4=CaSO4+H2O+CO2↑
●泡沫灭火器的反应原理:
Na2CO3+2HCl=2NaCl+H2O+CO2↑
●误食碳酸钡后发生中毒的原因:
BaCO3+2HCl=BaCl2+H2O+CO2↑
●用小苏打治疗胃酸过多:
NaHCO3+HCl=NaCl+H2O+CO2↑
●硝酸银溶液与稀盐酸反应:
AgNO3+HCl=HNO3+AgCl↓
●钡盐与稀硫酸反应:
Ba(NO3)2+H2SO4=2HNO3+BaSO4↓ BaCl2+H2SO4=2HCl+BaSO4↓ BaCO3+H2SO4=BaSO4↓+H2O+CO2↑
●硫酸和碱式碳酸铜反应:
Cu2(OH)2CO3+2H2SO4=2CuSO4+2H2O+CO2↑
●工业制取烧碱:
Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
●生成蓝色沉淀的反应:
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4(参加反应的碱只能是四大强碱)
●生成红褐色沉淀的反应:
FeCl3+3NaOH=Fe(OH)3↓+3NaCl(参加反应的碱只能是四大强碱)
●生成白色沉淀的反应:
MgCl2+2NaOH=Mg(OH)2↓+2NaCl(生成物只能是弱碱)
●生成白色沉淀的反应:
MgSO4+Ba(OH)2=Mg(OH)2↓+BaSO4↓(硫酸盐与氢氧化钡反应)
●生成蓝白沉淀的反应:
CuSO4+Ba(OH)2=Cu(OH)2↓+BaSO4↓
●生成红白沉淀的反应:
Fe2(SO4)3+3Ba(OH)2=2Fe(OH)3↓+3BaSO4↓
●配制波尔多液时发生的反应:
CuSO4+Ca(OH)2=CaSO4+Cu(OH)2↓
●误食BaCO3或BaCl2发生中毒之后,要服用泻盐(MgSO4)解毒:
BaCl2+MgSO4=MgCl2+BaSO4↓
●其他常见的反应:
⏹NaCl+AgNO3=NaNO3+AgCl↓
⏹CaCl2+Na2CO3=2NaCl+CaCO3↓(CaCl2可以换成Ca(NO3)2,Na2CO3可以换成K2CO3)
⏹BaCl2+Na2CO3=2NaCl+BaCO3↓(BaCl2可以换成Ba(NO3)2,Na2CO3可以换成K2CO3)
⏹BaCl2+Na2SO4=2NaCl+BaSO4↓(BaCl2可以换成Ba(NO3)2,Na2SO4可以换成K2SO4)
●证明NaOH变质的三种方法:
⏹Na2CO3+2HCl=2NaCl+H2O+CO2↑
⏹Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
⏹Na2CO3+CaCl2=2NaCl+CaCO3↓
●证明NaOH部分变质(先用下面的方法除去Na2CO3,然后向溶液中滴加酚酞,如果溶液变红说明NaOH部分变质):
⏹Na2CO3+CaCl2=2NaCl+CaCO3↓
⏹Na2CO3+Ca(NO3)2=2NaNO3+CaCO3↓
●证明Ca(OH)2变质的方法:
CaCO3+2HCl=CaCl2+H2O+CO2↑
●证明Ca(OH)2部分变质的方法(取两份相同的样品,分别按以下方法做)
⏹证明Ca(OH)2变质:
CaCO3+2HCl=CaCl2+H2O+CO2↑
⏹证明还有Ca(OH)2存在:
Ca(OH)2+2NH4Cl=CaCl2+2H2O+2NH3↑
●证明CaO部分变质的方法(取三份相同的样品,分别按以下方法做):
⏹证明CaO仍然存在:
CaO+H2O=Ca(OH)2
⏹证明CaCO3的存在:
CaCO3+2HCl=CaCl2+H2O+CO2↑
⏹证明Ca(OH)2的存在:
Ca(OH)2+2NH4Cl=CaCl2+2H2O+2NH3↑
非基本类型
●一氧化碳还原氧化铜(检验一氧化碳的反应原理):
CO+CuO
Cu+CO2
●甲烷充分燃烧:
CH4+2O2
CO2+2H2O
●二氧化碳使澄清的石灰水变浑浊(Ca(OH)2固体变质的原因):
Ca(OH)2+CO2=CaCO3↓+H2O
●用NaOH溶液吸收CO2(NaOH固体变质的原因):
2NaOH+CO2=Na2CO3+H2O
●用NaOH溶液吸收SO2:
2NaOH+SO2=Na2SO3+H2O
●NaOH溶液与SO3反应:
2NaOH+SO3=Na2SO4+H2O
常见反应的现象
化学方程式
反应现象
备注
C+O2
CO2
①木炭在空气中燃烧时持续红热,无烟无焰;在氧气中燃烧时发出白光
②放热
③生成能使澄清石灰水变浑浊的气体
做木炭在氧气中燃烧的实验时,夹有红热木炭的坩埚钳伸入氧气的集气瓶中时,要由瓶口向下缓慢插入
S+O2
SO2
①在空气中燃烧发出淡蓝色火焰,在氧气中燃烧发出蓝紫色火焰
②放热
③生成有刺激性气味的气体
在做硫燃烧实验时,集气瓶底部应加入少量NaOH溶液以吸收有毒的SO2
4P+5O2
2P2O5
①产生大量白烟
②放热
①由于红磷燃烧只消耗氧气,并且生成物只有固体,所以可以用来测定空气中氧气的含量。
②应用:
发令枪
2H2+O2
2H2O
①发出淡蓝色火焰(如果不纯,还会发出尖锐的爆鸣声);②放热;③生成能使无水硫酸铜变蓝的液体
①点燃氢气之前必须验纯;
②氢气是最清洁的能源,是高能燃料
3Fe+2O2
Fe3O4
①剧烈燃烧,火星四射
②放热
③生成一种黑色固体
①用砂纸把细铁丝磨成光亮的银白色,是为了除去细铁丝表面的杂质。
②将细铁丝盘成螺旋状,是为了增大细铁丝与氧气的接触面积。
③把细铁丝绕在火柴上,是为了引燃细铁丝,使细铁丝的温度达到着火点。
④待火柴快燃尽时才缓慢插入盛有氧气的集气瓶中,是为了防止火柴燃烧时消耗氧气,保证有充足的氧气与细铁丝反应。
⑤由上向下缓慢伸进盛有氧气的集气瓶中是为了防止细铁丝燃烧时放热使氧气从集气瓶口逸出,保证有充足的氧气与细铁丝反应。
⑥集气瓶里要预先装少量水或在瓶底铺上一薄层细沙,是为了防止灼热的生成物溅落使集气瓶瓶底炸裂。
2Mg+O2
2MgO
①发出耀眼的白光
②放热
③生成白色固体
①点燃前要先用砂纸除去镁条表面的氧化膜
②应用:
信号弹
2Cu+O2
2CuO
红色固体逐渐变成黑色
可用来除去混合气体中的氧气
2Hg+O2
2HgO
银白色液体逐渐变成红色固体
拉瓦锡实验中反应之一
2CO+O2
2CO2
①发出蓝色火焰
②放热
③生成能使澄清石灰水变浑浊的气体
①CO有毒!
②点燃前要验纯
③应用:
煤气
2HgO
2Hg+O2↑
红色固体逐渐变成银白色液体,并生成能使带火星的木条复燃的气体
拉瓦锡实验中反应之一
石蜡+氧气
二氧化碳+水
①火焰发出白光;②放热;③生成能使澄清石灰水变浑浊的气体;④生成能使无水硫酸铜变蓝的液体
CH4+2O2
CO2+2H2O
①发出明亮的蓝色火焰;②放热;③生成能使澄清石灰水变浑浊的气体;④生成能使无水硫酸铜变蓝的液体
①点燃前要验纯
②应用:
天然气
Ca(OH)2+CO2=CaCO3↓+H2O
澄清的石灰水变浑浊
应用:
检验二氧化碳、吸收少量二氧化碳
2H2O
2H2↑+O2↑
①通电后,电极上有气泡产生。
通电一段时间后,两个试管内汇集了一些气体,与正、负极相连的试管内的气体体积比约为1:
2,质量比约为8:
1。
②与正极相连的试管内的气体可以使带火星的木条复燃;与负极相连的试管内的气体移近火焰时,气体能够燃烧,火焰呈淡蓝色。
①通电时,必须使用直流电。
②预先在水中加入少量氢氧化钠溶液或稀硫酸,可以增强水的导电性。
③气体的体积比往往不是1:
2,原因是:
氧气比氢气更易溶于水。
2H2O2
2H2O+O2↑
产生大量气泡,生成能使带火星木条复燃的气体
应用:
实验室制取氧气
Cu2(OH)2CO3
2CuO+H2O+CO2↑
①绿色固体逐渐变成黑色;②生成能使澄清石灰水变浑浊的气体;③生成能使无水硫酸铜变蓝的液体
H2+CuO
Cu+H2O
①黑色粉末逐渐变成红色
②生成能使无水硫酸铜变蓝的液体
氢气要“早来晚走”,酒精灯要“迟到早退”
H2O+CO2=H2CO3
(如果加入石蕊溶液)石蕊溶液变红
证明二氧化碳与水反应生成碳酸
Fe+CuSO4=Cu+FeSO4
①铁钉表面附着一层红色物质
②溶液由蓝色逐渐变成浅绿色。
可以用来验证质量守恒定律
C+2CuO
2Cu+CO2↑
①黑色粉末逐渐变成红色
②生成能使澄清石灰水变浑浊的气体
①加热时酒精灯上要加网罩,是为了:
使火焰集中并提高温度
②反应开始的标志:
澄清的石灰水变浑浊
③配制混合物时木炭粉应稍过量的目的:
防止已经还原的铜被氧气重新氧化
④实验完毕后要先移出导气管,后熄灭酒精灯
CO+CuO
Cu+CO2
①黑色粉末逐渐变成红色
②生成能使澄清石灰水变浑浊的气体
①一氧化碳“早来”,酒精灯“迟到”的目的:
排净装置内的空气,防止加热空气和一氧化碳的混合气体引起爆炸。
②一氧化碳“晚走”,酒精灯“早退”的目的:
防止灼热的铜重新被空气中的氧气氧化
③因为一氧化碳有剧毒,随意排放还会造成空气污染,所以必须进行尾气处理(方法是在装置末尾的导气口处放一只燃着的酒精灯)
3CO+Fe2O3
2Fe+3CO2
①红色粉末逐渐变成黑色
②生成能使澄清石灰水变浑浊的气体
①铁粉是黑色的
②一氧化碳“早来晚走”,酒精灯“迟到早退”
Mg+2HCl=MgCl2+H2↑
①金属逐渐溶解消失;②产生大量气泡;③放热
①在金属活动性顺序表中排在H后面的金属不与酸反应
②如果有Fe参加反应,要注意生成的Fe的化合价是+2价,并且溶液颜色会发生变化
Zn+2HCl=ZnCl2+H2↑
①金属逐渐溶解消失;②产生大量气泡
Fe+2HCl=FeCl2+H2↑
①金属逐渐溶解消失;②产生(大量)气泡;③溶液由无色逐渐变成浅绿色
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
铁锈逐渐溶解消失
溶液由无色逐渐变成黄色
稀盐酸、稀硫酸可用来除铁锈
稀盐酸除铁锈的效果比较好
CuO+2HCl=CuCl2+H2O
CuO+H2SO4=CuSO4+H2O
黑色粉末逐渐溶解消失
溶液由无色逐渐变成蓝色
第二个反应是制取硫酸铜的反应原理
HCl+NaOH=NaCl+H2O
没有明显现象(但是这个反应放热)
强酸和强碱反应时一般要借助指示剂
Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
生成白色沉淀
工业制取烧碱的反应原理
描述实验现象时要注意不能说出生成物的名称,但可以根据生成物的化学性质来描述生成物。
常见物质的颜色、气味
固体
●红色:
红磷P、铜Cu、氧化铁Fe2O3、氧化汞HgO
●红褐色:
氢氧化铁Fe(OH)3
●黄色:
金Au、硫S
●绿色:
碱式碳酸铜Cu2(OH)2CO3
●紫黑色:
高锰酸钾晶体KMnO4
●淡蓝色:
固态氧O2
●蓝色:
氢氧化铜Cu(OH)2、硫酸铜晶体CuSO4·5H2O
●银白色:
大多数金属(铁Fe、银Ag、铝Al、锌Zn、镁Mg……)
●黑色:
木炭C、铁粉Fe、氧化铜CuO、二氧化锰MnO2、四氧化三铁Fe3O4、氧化亚铁FeO等
●深灰色:
石墨C
●灰白色:
大多数磷肥
●无色:
金刚石C、干冰CO2、冰H2O
●白色:
除了上述固体之外,我们学过的其他固体、固体粉末或晶体基本上都是白色的。
●有刺激性气味的固体:
碳酸氢铵NH4HCO3
液体
●淡蓝色:
液态氧O2
●蓝色:
含有Cu2+的溶液
●浅绿色:
含有Fe2+的溶液
●黄色:
含有Fe3+的溶液
●银白色:
汞Hg
●我们学过的大多数液体都是无色的。
●有特殊气味的液体:
乙醇C2H5OH
●有刺激性气味的液体:
醋酸CH3COOH
气体
●有毒的气体:
一氧化碳CO、氯化氢HCl、氨气NH3、二氧化硫SO2、二氧化氮NO2等
●有刺激性气味的气体:
氯化氢HCl、氨气NH3、二氧化硫SO2等
●计入空气污染指数的项目:
二氧化硫SO2、一氧化碳CO、二氧化氮NO2、可吸入颗粒物和臭氧O3等
●能产生温室效应的气体:
二氧化碳CO2
多功能瓶
下面是多功能瓶的常见用途:
一、洗气瓶(图①)
多功能瓶作为洗气瓶来使用时,气体要从长导管进入,从短导管中出去。
洗气瓶一般用来检验气体(如二氧化碳)、干燥气体(如混有水蒸气的气体)、吸收气体(如二氧化硫)或除去气体中的杂质(如HCl气体等)
●检验气体:
检验二氧化碳的试剂是澄清的石灰水。
●干燥气体:
试剂一般是浓硫酸。
需要注意的是,浓硫酸不能干燥NH3等碱性气体。
●吸收气体或除去气体中的杂质:
①对于SO2、CO2等气体,可以使用NaOH溶液吸收(最好不用Ca(OH)2溶液,因为Ca(OH)2微溶于水)
②对于混在CO2中的HCl气体,不可以使用NaOH溶液吸收,但可以使用NaHCO3溶液来吸收。
③Cl2可以用NaOH溶液吸收。
二、向上排空气取气瓶(图②)
使用条件:
收