学年第一学期高三化学反应方程式与基础知识小测无答案.docx
《学年第一学期高三化学反应方程式与基础知识小测无答案.docx》由会员分享,可在线阅读,更多相关《学年第一学期高三化学反应方程式与基础知识小测无答案.docx(30页珍藏版)》请在冰豆网上搜索。
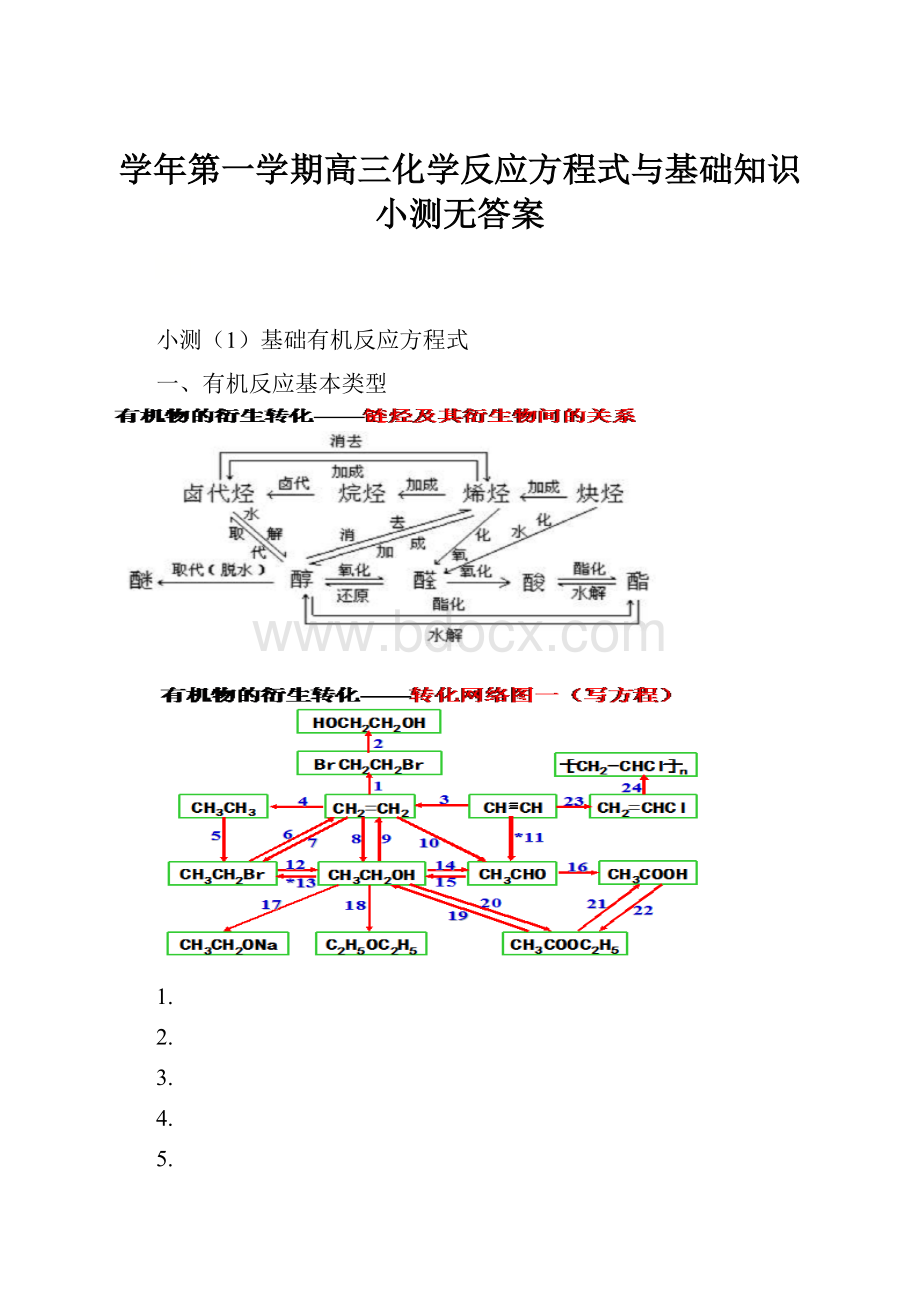
学年第一学期高三化学反应方程式与基础知识小测无答案
小测
(1)基础有机反应方程式
一、有机反应基本类型
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
小测
(2)
1.有机化学中取代反应范畴很广,下列反应属于取代反应的是
2.下列反应属于消去反应的是
3.某有机物的结构式为:
它在一定条件下能发生的反应有:
①加成②水解③酯化④氧化⑤中和⑥消去
A.②③④B.①③⑤⑥C.①③④⑤ D.②③④⑤⑥
小测(3)
1.某有机物A是农药生产中的一种中间体,其结构简式如下。
下列叙述中正确的是
A.有机物A属于芳香烃
B、有机物A可以与Br2的CCl4溶液发生加成反应
C.有机物A与浓硫酸混合加热,可以发生消去反应
D.1mo1A与足量的NaOH溶液反应,最多可以消耗3molNaOH
2.从某些植物树叶中提取的挥发油含有下列主要成分:
ABC
(1)写出A物质可能发生的反应类型(至少三种)。
(2)1molB与溴水充分反应,需消耗_______mol单质溴。
(3)写出C在一定条件下与足量H2反应的化学方程式。
(4)已知RCH=CHR′
RCOOH+R′COOH。
写出C在强氧化剂条件下生成的有机化合物的结构简式。
(5)写出A与B在一定条件下,生成的一种高分子化合物的化学方程式
___________________________________。
小测(4)
1.下列说法正确的是( )
A.
的结构中含有酯基
B.顺2丁烯和反2丁烯的加氢产物不同
C.1mol葡萄糖可水解生成2mol乳酸(C3H6O3)
D.油脂和蛋白质都是能发生水解反应的高分子化合物
2.下列说法不正确的是
A.麦芽糖及其水解产物均能发生银镜反应
B.用溴水即可鉴别苯酚溶液、2,4-己二烯和甲苯
C.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
D.用甘氨酸(
)和丙氨酸(
)缩合最多可形成4种二肽
3.下列说法正确的是
A.天然植物油常温下一般呈液态,难溶于水,有恒定的熔点、沸点
B.麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖
C.若两种二肽互为同分异构体,则二者的水解产物不一致
D.乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体
小测(5)聚合反应有机高分子
1.完成下列加聚或者缩聚反应的化学方程式:
1)乙烯制备聚乙烯
2)氯乙烯制备聚氯乙烯
3)乙烯和丙烯发生聚合反应
4)乙炔制备聚乙炔
5)丁二烯制备聚丁二烯
6)乙二醇和乙二酸形成聚合物
7)乳酸形成聚乳酸
8)甲醛和苯酚形成树脂
9)对苯二甲酸和乙二醇形成涤纶
10)丙烯酸钠形成高吸水性的聚丙烯酸钠
2.找单体
的单体是
的单体是
的单体是
小测(6)有机合成方程式
1、由乙烯制备乙炔
2、由溴乙烷制备乙酸
3、由乙烯制备二乙酸乙二酯
4、由甲苯制取苯甲醇
小测(7)有机方程式
12-丙醇的催化氧化
21-丙醇和金属钠
31-丙醇制丙烯
4乙酸乙酯在碱性条件下水解
5溴乙烷和NaOH醇溶液反应
6甲苯和硝酸的反应
7苯和液溴反应
8实验室制乙炔
9丙醛和新制Cu(OH)2的反应
⑨丙醛和银氨溶液反应
小测(8)有机方程式
1苯酚和NaOH反应
2苯酚和浓溴水反应
3苯酚钠溶液通入过量CO2(离子)
4苯甲醛的银镜反应
5甲苯制TNT(1个)
6苯甲酸甲酯在NaOH溶液中的水解
7乙酸甲酯在酸性条件下水解
8乙醇和乙二酸反应生成乙二酸二乙酯
9苯酚制酚醛树脂
小测(9)有机方程式参考用时10min
乳酸CH3CHOHCOOH发生下列反应
1)与金属钠反应:
2)与NaOH反应
3)催化氧化反应:
4)消去反应:
5)单分子酯化成环:
6)两分子酯化成链
7)两分子酯化成环
8)缩聚反应
9)乙炔、CH2=C(CH3)COOCH3、CH2=C(CH3)-CH=CH2分别发生加聚反应(3个)
小测(10)有机方程式参考用时15min
1.乙醇→
1消去反应:
2加成反应:
3水解反应:
4分子间脱水反应:
2.由苯酚制备1,2-环己二醇
①加成反应:
②消去反应:
③加成反应:
5水解反应:
3.银氨溶液验淀粉是否水解(包括水解和检验共2个)
6
小测(11)有机方程式参考用时:
15min
.写出
发生分子内成环酯反应的方程式:
.F是对苯二甲酸的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物;b.遇FeCl3溶液显示特征颜色;
c.能与碳酸氢钠溶液反应。
写出F与NaHCO3溶液反应的化学方程式
。
.CH3CHBrCOOH与足量NaOH醇溶液共热时反应的化学方程式是:
。
.一氯乙酸CH2ClCOOH与足量NaOH水溶液混合加热反应:
.写出
与足量NaOH溶液共热反应
的化学方程式:
。
.
与足量的NaOH溶液反应的化学方程式为
。
.
与足量浓溴水反应的方程式为
。
小测(13)化学反应热
1.火箭推进器中盛有强还原性液态肼(N2H4)和强氧化剂液态双氧水,当它们混合反应时,即生成大量氮气和水蒸气,并放出大量的热,已知0.4mol液态肼与过量的液态双氧水反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)该反应的热化学方程式为。
(2)又已知:
H2O(g)→H2O(l);△H=-44kJ/mol,则16g液态肼与液态双氧水反应生成液态水时放出的热量是。
2.下列表示可燃物燃烧热的热化学方程式书写正确的是(△H的绝对值均正确)
A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=-1367.0kJ/mol
B.C(s)+1/2O2(g)==CO(g);△H=-110.35kJ/mol
C.2S(s)+2O2(g)===2SO2(g);△H=-539.6kJ/mol
D.C6H12O6(s)+6O2(g)===6CO2(g)+6H2O
(1);△H=-2800kJ/mol
3.CH3—CH3→CH2=CH2+H2;有关化学键的键能如下。
化学键
C-H
C=C
C-C
H-H
键能/kJ·mol-1
414.4
615.3
347.4
435.3
该反应的反应热△H=。
4.已知:
P4(s)(白磷)+5O2(g)=P4O10(s);△H=-2983.2kJ/mol
P(s)(红磷)+5/4O2(g)=1/4P4O10(s);△H=-738.5kJ/mol
试写出白磷转化为红磷的热化学方程式
5.已知:
C(s)+O2(g)===CO2(g) ΔH1CO2(g)+C(s)===2CO(g) ΔH2
2CO(g)+O2(g)===2CO2(g) ΔH34Fe(s)+3O2(g)===2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5,
下列关于上述反应焓变的判断正确的是
A.ΔH1>0,ΔH3<0B.ΔH2>0,ΔH4>0C.ΔH1=ΔH2+ΔH3D.ΔH3=ΔH4+ΔH5
小测(14)化学反应速率
1.用有效碰撞理论解释外界因素对化学反应速率的影响
条件变化
微观因素变化
速率变化
单位体积分子总数
活化分子百分数
单位体积内活化分子数目
有效碰撞次数
反应物浓度增大
压强增大
温度增大
使用催化剂
2.对A(g)+3B(g)
2C(g)+2D(g)来说,下列四种不同情况下的反应速率最快的是
A.v(A)=0.15mol/(L•min)B.v(B)=0.3mol/(L•min)
C.v(C)=0.1mol/(L•min)D.v(A)=0.01mol/(L•s)
3.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:
3A(g)+B(g)
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,c(A):
c(B)=3:
5,C的平均反应速率是0.1mol·L-1·min-1。
求:
(1)此时A的浓度及反应开始前放入容器中A、B的物质的量;
(2)B的平均反应速率;
(3)x值是多少?
4.一定温度下,10mL0.40mol/LH2O2溶液发生催化分解。
不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min
0
2
4
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
10~6min的平均反应速率v(H2O2)=
②反应至6min时,c(H2O2)=
③反应至6min时,H2O2分解率为
小测(15)化学平衡
(每空10分)
1.NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。
(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是。
(2)Ⅱ中,2NO+O2
2NO2。
在其它条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如右图)。
①比较p1、p2的大小关系:
。
②随温度升高,该反应平衡常数变化的趋势是。
(3)Ⅲ中,降低温度,将NO2 (g)转化为N2O4 (l),再制备浓硝酸。
已知:
2NO2(g)
N2O4(g)∆H12NO2(g)
N2O4(l)∆H2
下列能量变化示意图中,正确的是(选填字母)。
3.用Cl2生产某些含氯有机物时会产生副产物HCl。
利用反应A,可实现氯的循环利用。
反应A:
4HCl+O2
2Cl2+2H2O 4molHCl被氧化,放出115.6kJ的热量。
下图是在4种投料比[n(HCl)∶n(O2),分别为1∶1、2∶1、4∶1、6∶1]下,反应温度对HCl平衡转化率影响的曲线。
①曲线b对应的投料比是 。
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是 。
③投料比为2∶1、温度为400℃时,平衡混合气中Cl2的物质的量分数是 。
4.已知反应:
2NO2(红棕色)
N2O4(无色)△H<0。
将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。
(1)b点的操作是。
(2)请比较d点:
v(正)________v(逆),指出判断依据
。
小测(16)水溶液中的平衡
1.以0.1mol·L-1CH3COOH溶液为例,填写外界条件对
CH3COOH
CH3COO-+H+ ΔH>0的影响。
实例(稀溶液)
CH3COOHH++CH3COO-ΔH>0
改变条件
平衡移动方向
n(H+)
c(H+)
导电能力
Ka
加水稀释
加入少量冰醋酸
通入HCl(g)
加NaOH(s)
加入镁粉
升高温度
加CH3COONa(s)
2.物质的量浓度相同的盐酸和醋酸,下列说法中正确的是
A.盐酸氢离子浓度大B.醋酸氢离子浓度大
C.盐酸氢离子的物质的量多D.醋酸氢离子物质的量大
3.已知0.1mol/L的醋酸溶液中存在电离平衡:
CH3COOH
CH3COO-+H+,要使溶液中
c(H+)/c(CH3COOH)值增大,可以采取的措施是
A.加少量烧碱溶液B.升高温度C.加少量盐酸D.加水
3.用水稀释0.1mol·L-1氨水时,溶液中随着水量的增加而一直减小的是
A.c(OH-)/c(NH3·H2O)B.c(NH3·H2O)/c(OH-)C.c(OH-)D.H+的物质的量
4.某温度下,纯水中的c(H+)=2.0×10-7mol/L,则此时溶液中c(OH-)为;若温度不变,滴入稀硫酸使c(H+)=5.0×10-6mol/L,则c(OH-)为。
5.下列说法中正确的是
A.溶液呈中性就是pH=7B.溶液呈中性指的是c(H+)=c(OH-)
C.酸和碱恰好完全反应时,溶液一定呈中性D.盐溶液一定呈中性
6.能使H2O+H2O
H3O++OH-电离平衡向正反应方向移动,且使所得溶液是酸性的措施是
A.在水中加小苏打B.在水中加稀硫酸
C.在水中加明矾固体D.在水中加NaHSO4固体
7.下列离子方程式中,属于水解反应的是
A.HCOOH+H2O
HCOO-+H3O+B.CO2+H2O
HCO3-+H+
C.CO32-+H2O
HCO3-+OH-D.HS-+H2O
S2-+H3O+
小测(17)pH计算的基本类型
(一)单一溶液的pH:
(1)浓度为0.05mol/L的硫酸溶液的pH为
(2)常温时,浓度为0.005mol/L的氢氧化钡溶液的pH为:
(二)混合溶液的pH:
(1)常温时,0.1mol/L的NaOH和0.06mol/L的H2SO4溶液等体积混合,求混合溶液的pH。
(2)常温时,0.1mol/L的盐酸和0.06mol/L的Ba(OH)2溶液等体积混合,求混合溶液的pH。
(三)溶液稀释的pH:
(1)将pH=3的盐酸溶液,稀释100倍,则稀释后溶液的pH为?
若稀释成原来的105倍呢?
(2)将pH=12的NaOH溶液,稀释100倍,则稀释后溶液的pH为?
若稀释成原来的106倍呢?
(3)将pH=3的醋酸溶液,稀释100倍,则稀释后溶液的pH为?
(4)将pH=12的氨水溶液,稀释100倍,则稀释后溶液的pH为?
(四)pH计算综合问题:
(1)常温时,若1体积硫酸恰好与10体积pH=11的氢氧化钠溶液完全反应,则二者物质的量浓度之比应为
A.10:
1B.5:
1C.1:
1D.1:
10
(2)水的电离平衡如右图所示:
①若A点表示25℃时水的电离平衡状态,当升高温度至100℃时水的电离平衡状态为B点,则此时水的离子积为。
②将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为。
小测(18)盐类的水解
1.在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-浓度分别为amol/L与bmol/L,则a和b的关系为
A.a>bB.a=10-4bC.b=10-4aD.a=b
2.①在常温下,已知醋酸的酸性大于次氯酸的酸性,等物质的量浓度的CH3COONa溶液和NaClO溶液,pH大的为:
。
②在常温下,已知NH3·H2O的碱性大于Al(OH)3的碱性,等物质的量浓度的NH4Cl溶液和AlCl3溶液,pH小的为:
。
③在相同的温度下,物质的量浓度相等的NH4Cl溶液和CH3COONH4溶液,铵根离子浓度大的为:
3.已知酸(HA)的酸性比酸(HB)弱,在物质的量浓度均为0.1mol·L-1的NaA和NaB混合溶液中,下列排序正确的是
A.c(OH-)>c(HA)>c(HB)>c(H+)B.c(OH-)>c(A-)>c(B-)>c(H+)
C.c(OH-)>c(B-)>c(A-)>c(H+)D.c(OH-)>c(HB)>c(HA)>c(H+)
4.物质的量浓度相同的下列溶液中,NH4+最大的是
A.NH4ClB.NH4HSO4C.CH3COONH4D.NH4HCO3
5.回答下列问题:
(1)常温下pH=3的盐酸溶液中,求水电离出的氢离子浓度为:
(2)在常温下,求pH=3的醋酸溶液中,水电离出的氢离子浓度为:
(3)在常温下,求pH=11的氢氧化钠溶液中,水电离出的氢氧根离子浓度为:
(4)在常温下,求pH=11的氨水中,水电离出的氢氧根离子浓度为:
(5)在常温下,求pH=4的氯化铝溶液水,水电离出的氢离子浓度为:
小测(19)溶液中离子浓度的大小关系
1.在0.1mol/l的CH3COOH溶液中,下列关系正确的是
A.c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-)B.c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
C.c(CH3COOH)>c(CH3COO-)=c(H+)>c(OH-)D.c(CH3COOH)>c(CH3COO-)>c(OH-)>c(H+)
2.在氯化铵溶液中,下列关系正确的是
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)B.c(NH4+)>c(Cl-)>c(H+)>c(OH-)
C.c(NH4+)=c(Cl-)>c(H+)=c(OH-)D.c(Cl-)=c(NH4+)>c(H+)>c(OH-)
3.在0.1mol·L-1的NaHCO3溶液中,下列关系式正确的是
A.c(Na+)>c(HCO3-)>c(H+)>c(OH-)B.c(Na+)+C(H+)=c(HCO3-)+c(OH-)+2c(CO32-)
C.c(Na+)=c(HCO3-)>c(OH-)>c(H+)D.c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)
4.在10ml0.1mol·L-1NaOH溶液中加入同体积、同浓度弱酸HAc溶液,反应后溶液中各微粒的浓度关系错误的是
A.c(Na+)>c(Ac-)>c(H+)>c(OH-)B.c(Na+)>c(Ac-)>c(OH-)>c(H+)
C.c(Na+)=c(Ac-)+c(HAC)D.c(Na+)+c(H+)=c(Ac-)+c(OH-)
5.将0.2mol·L-1CH3COOK与0.1mol·L-1盐酸等体积混合后,则溶液中下列微粒的物质的量浓度的关系正确的是
A.c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH)
B.c(CH3COO-)=c(Cl-)>c(CH3COOH)>c(H+)
C.c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
D.c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
6.物质的量浓度相同的下列溶液中,NH4+浓度最大的是
A.NH4ClB.NH4HSO4C.HCOONH4D.NH4HCO3
7.下列四种溶液:
(1)pH=0的盐酸溶液
(2)0.1mol/L的盐酸溶液(3)0.01mol/L的NaOH溶液(4)pH=11的NaOH溶液由水电离出的c(H+)浓度之比
A.1:
10:
100:
1000B.0:
1:
11:
11
C.14:
13:
12:
11D.100:
10:
1:
0
8.在pH都等于4的HCl和NH4Cl两种溶液中,设由水电离产生的H+浓度分别为amol/L与bmol/L,则a和b的关系为
A.a>bB.a=10-6bC.b=10-6aD.a=b
小测(20)速率平衡图像
1.
某温度时,在2L容器中X、Y、Z三种物质的量随时间的变化曲线如图所示。
由图中数据分析,该反应的化学方程式为
_______________________________。
反应开始至2min,Z的平均反应速率为。
2.可逆反应aA(g)+bB(g)
pC(g),反应时间与C%(产物C的体积分数)函数关系如图所示。
A图表示压强不同的曲线,B图表示的是温度不同的曲线,试比较下列大小关系:
P1______P2,T1______T2,ΔH_____0,a+b______p。
3.在一密闭容器中发生反应N2+3H2
2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
回答下列问题:
(1)处于平衡状态的时间段是________(填选项)。
A.t0~t1B.t1~t2C.t2~t3D.t3~t4E.t4~t5F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是(填选项)
A.增大压强B.减小压强C.升高温度
D.降低温度E.加催化剂F.充入氮气
t1时刻________;t3时刻________;t4时刻________。
(3)依据
(2)中的结论,下列时间段中,氨的百分含量最高的是________(填选项)。
A.t0~t1B.t2~t3C.t3~t4D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。
4.在催化剂的作用下,水蒸气将CH4氧化。
结合下图回答问题。
1过程的热化学方程式是。
2比较压强P1和p2的大小关系:
P1p2(选填“>”“<”或“=”)。
5.已知反应N2(g)+3H2(g)
2NH3(g)ΔH<0。
按n(N2)∶n(H2)=1∶3向反应容器中投料,在不同温度下分别达平衡时,混合气中NH3的质量分数随压强变化的曲线如图所示:
①下列说法正确的是 。
(填字母)
a.曲线a、b、c对应的温度是由低到高
b.加入催化剂能加快化学反应速率和提高H2的转化率
c.图中Q、M、N点的平衡常数:
K(N)>K(Q)=K(M)
②M点对应H2的转化率是 。
小测(21)化学平衡
1.
工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g)Si3N4(s)+12HCl(g)△H<0
某温度和压强条件下,分别将0.3molSiCl4(g)、0.2molN2(g)、0.6molH2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是mol/(L·min)。
②平衡时容器内N2的浓度是mol·L-1。
③SiCl4(g)的转化率是。
④若按n