大学化学之电化学基础.ppt
《大学化学之电化学基础.ppt》由会员分享,可在线阅读,更多相关《大学化学之电化学基础.ppt(131页珍藏版)》请在冰豆网上搜索。
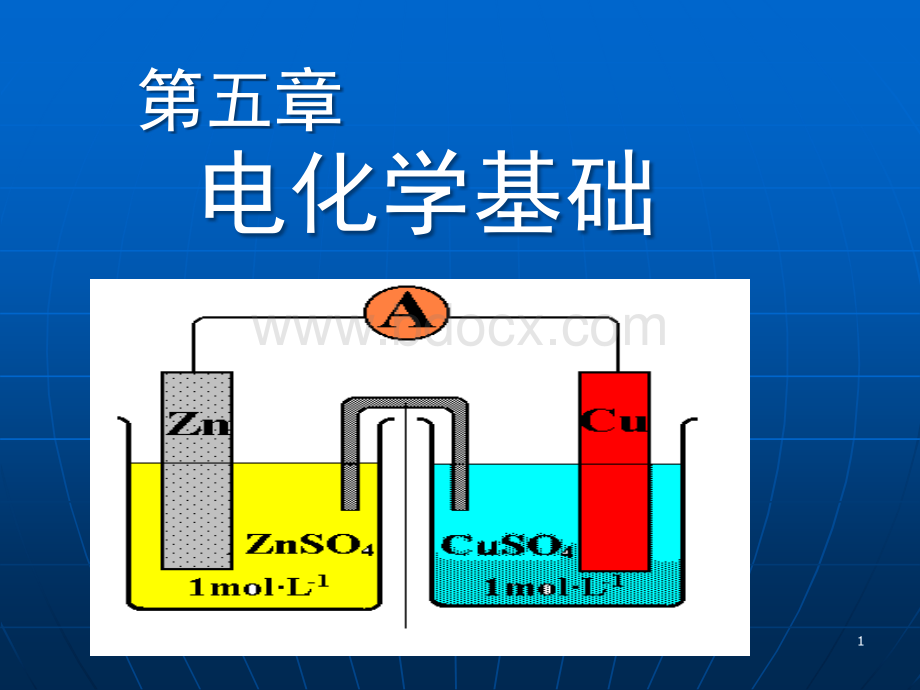
第五章电化学基础11电化学电化学是研究化学能和电能相互转化的一门科学.22氧化还原过程人类一切生产和生命活动:
能量供应问题。
煤、石油等燃烧发热营养物质的消化吸收体内的生物化学反应生物电现象(心电、脑电)33主要内容主要内容5.15.1氧化还原反应氧化还原反应5.25.2原电池原电池5.35.3电极电势电极电势5.45.4原电池热力学原电池热力学5.55.5电解与电化学技术电解与电化学技术5.65.6金属的腐蚀与防护金属的腐蚀与防护445.1氧化还原反应氧化还原反应5.1.1氧化还原反应氧化还原反应5.1.2氧化还原电对氧化还原电对5.1.3氧化还原反应方程式的配平氧化还原反应方程式的配平555.1.1氧化还原反应氧化还原反应1.定义定义元素的氧化值发生了变化的化学反应。
元素的氧化值发生了变化的化学反应。
Sn2+Fe3+Sn4+Fe2+2.特点特点
(1)存在着氧化剂与还原剂;)存在着氧化剂与还原剂;
(2)存在着氧化态与还原态。
)存在着氧化态与还原态。
氧化氧化Ox(氧化态)氧化态)neRed(还原态)还原态)还原还原665.1.2氧化还原电对氧化还原电对1.电对电对Ox+neRed同种元素的氧化态与还原态构成了氧化同种元素的氧化态与还原态构成了氧化还原电对,记作还原电对,记作Ox/Red。
如如Sn4+/Sn2+,Fe3+/Fe2+,一个氧化还一个氧化还原反应由两个氧化还原电对组成。
原反应由两个氧化还原电对组成。
772.2.电极反应电极反应任何氧化还原反应都可拆分为两个氧化还任何氧化还原反应都可拆分为两个氧化还原电对的半反应(半电池反应,电极反应):
原电对的半反应(半电池反应,电极反应):
Fe3+eFe2+Sn2+Sn4+2e氧化还原反应的实质:
氧化还原反应的实质:
两个共轭电对之间的电子转移反应。
两个共轭电对之间的电子转移反应。
883.电对拆分:
电对拆分:
2MnO2MnO44-5H5H22CC22OO446H6H2Mn2Mn2210CO10CO228H8H22OOMnO4-8H5eMn24H2OH2C2O42CO22H2eMnO4-/Mn2;CO2/H2C2O4995.1.3氧化还原反应方程式的配平氧化还原反应方程式的配平离子离子-电子法电子法1.配平原则:
配平原则:
电荷守恒:
反应过程中氧化剂与还原剂电荷守恒:
反应过程中氧化剂与还原剂得失电子数相等。
得失电子数相等。
质量守恒:
反应前后各元素的原子总数相质量守恒:
反应前后各元素的原子总数相等。
等。
10102.配平的具体步骤:
配平的具体步骤:
(1)写出写出离子方程式:
离子方程式:
MnO4-SO32-HMn2SO42-H2O
(2)将反应)将反应拆分拆分为氧化和还原两个半反应式:
为氧化和还原两个半反应式:
还原反应:
还原反应:
MnO4-Mn2氧化反应:
氧化反应:
SO32-SO42-(3)配平配平:
使半反应两边的原子数和电荷数相等:
使半反应两边的原子数和电荷数相等MnO4-8H+5e=Mn24H2OSO32-H2O=SO42-2H+2e1111(4)使两个半反应得失电子数为其最小公倍使两个半反应得失电子数为其最小公倍数,数,合并合并成一个配平的离子反应式:
成一个配平的离子反应式:
2)MnO4-8H+5e=Mn24H2O+5)SO32-H2O=SO42-2H+2e2MnO4-5SO32-6H=2Mn25SO42-3H2O1212例2配平下列氧化还原反应:
H2S+H2SO3S+H2OH2S-2eS+2H+H2SO3+4H+4eS+3H2O2+2+得得:
2H2S+H2SO3=3S+3H2O1515例例33:
配平:
配平Cl2(g)+NaOHNaCl+NaClO3解:
解:
Cl2(g)+2e=2Cl-Cl2(g)+12OH-=2ClO3-+6H2O+10e5+得:
得:
6Cl2(g)+12OH-=10Cl-+2ClO3-+6H2O化简得:
化简得:
3Cl2(g)+6OH-=5Cl-+ClO3-+3H2O3Cl2(g)+6NaOH=5NaCl+NaClO3+3H2O16165.25.2原电池原电池5.2.15.2.1原电池的概念原电池的概念5.2.25.2.2原电池的符号原电池的符号5.2.35.2.3电池电动势电池电动势5.2.45.2.4电极类型电极类型17175.2.15.2.1原电池的概念原电池的概念1.1.定义定义原电池是利用氧化还原原电池是利用氧化还原反应产生电流的装置。
反应产生电流的装置。
2.2.原电池的构成原电池的构成电势不同的两个电极;电势不同的两个电极;盐桥;盐桥;外电路(检流计)。
外电路(检流计)。
1818图图1Daniell电池电池+e电子由电子由Zn极流向极流向Cu极:
极:
Zn极电势低,为负极;极电势低,为负极;Cu极电势高,为正极。
极电势高,为正极。
3.Daniell电池电池19194.特征特征正极:
氧化剂正极:
氧化剂(Cu2+)被还原,半电池反应为:
被还原,半电池反应为:
Cu2+2eCu负极:
还原剂负极:
还原剂(Zn)被氧化,半电池反应为:
被氧化,半电池反应为:
ZnZn2+2e电池反应为:
电池反应为:
Cu2+ZnCu+Zn2+20205.2.2原电池的符号表示原电池的符号表示1.1.书写要求书写要求(11)负极写在左边,正极写在右边;负极写在左边,正极写在右边;(22)正负极之间用盐桥)正负极之间用盐桥“”相接;相接;(33)电极固体标志用一竖线)电极固体标志用一竖线“”表示;表示;(44)同相之不同物质间用)同相之不同物质间用“,”间隔;间隔;(55)若为离子时应注明其活度(浓度亦可);)若为离子时应注明其活度(浓度亦可);(66)若电对不含金属导体,则需加一惰性导体;)若电对不含金属导体,则需加一惰性导体;(77)纯气体、液体或固体与惰性电极名称之间以)纯气体、液体或固体与惰性电极名称之间以“,”间隔,并应注明其状态。
间隔,并应注明其状态。
21212.应用示例应用示例例例4将将氧化还原反应氧化还原反应2MnO4-5H2O26H=2Mn28H2O5O2拆成两个半电池反应,并写出电极组成和电池组拆成两个半电池反应,并写出电极组成和电池组成表示式。
成表示式。
解解
(1)根据正极发生还原反应,负极发生氧化)根据正极发生还原反应,负极发生氧化反应的原则,拆分此氧化还原反应为两个半电反应的原则,拆分此氧化还原反应为两个半电池反应:
池反应:
正极反应:
正极反应:
MnO4-8H5eMn24H2O负极反应:
负极反应:
H2O22HO22e2222
(2)电极组成电极组成:
正极:
正极:
PtMnO4-(c1),Mn2(c2),H(c3)负极:
负极:
Pt,O2(p)H2O2(c4),H(c3)(3)电池符号电池符号:
(-)Pt,OPt,O22(pp)HH22OO22(cc44),H,H(cc33)MnOMnO44-(cc11),Mn,Mn22(cc22),H,H(cc33)PtPt(+)23235.2.3电池电动势电池电动势1.定义定义电池电动势是电池正负极之间的瞬时电势电池电动势是电池正负极之间的瞬时电势差。
(在接近零电流下所测定的电势差)差。
(在接近零电流下所测定的电势差)2.表示表示电池电动势电池电动势EE+-E-E+某时刻正极的电势,某时刻正极的电势,E-某时刻负极的电势。
某时刻负极的电势。
思考:
为什么手电筒电光愈用愈暗?
思考:
为什么手电筒电光愈用愈暗?
因为其电池电动势愈用愈低。
因为其电池电动势愈用愈低。
24245.2.4电极类型电极类型1.1.金属金属-金属离子电极:
金属离子电极:
Zn|Zn2+(c)电极反应电极反应Zn2+2eZn2.金属金属-金属难溶盐金属难溶盐-阴离子电极:
阴离子电极:
Ag,AgCl(s)|Cl-(c)电极反应电极反应AgCl+eAg+Cl-3.双离子电对电极:
双离子电对电极:
Pt|Fe2+(c1),Fe3+(c2)电极反应电极反应Fe3+eFe2+4.气体电极:
气体电极:
Pt,Cl2(p)|Cl-(c)电极反应电极反应Cl2+2e2Cl-25255.3电极电势电极电势5.3.1电极电势的产生电极电势的产生5.3.2标准电极电势标准电极电势5.3.3Nernst方程式方程式26265.35.3电极电势电极电势5.3.1电极电势的产生电极电势的产生1.电极的双电层结构电极的双电层结构+-(a)溶解溶解沉积沉积+-(b)沉积沉积溶解溶解图图-2双电层的形成双电层的形成M(s)Mn+(aq)+ne由于在金属与溶液间的界面处形成双电层结构,电由于在金属与溶液间的界面处形成双电层结构,电极电势产生了。
极电势产生了。
2727双电层结构的双电层结构的电极电势为绝对电极电势。
电极电势为绝对电极电势。
22.影响电极电势的因素影响电极电势的因素电极电势的大小与以下因素有关:
电极电势的大小与以下因素有关:
(11)电极物质的本性;)电极物质的本性;(22)电极物质离子的浓度或气体的分压;)电极物质离子的浓度或气体的分压;(33)温度。
)温度。
28285.3.25.3.2标准电极电势标准电极电势1.标准氢电极的作用标准氢电极的作用无法直接测出表面电势和相间电势无法直接测出表面电势和相间电势不能确不能确定电极电势的绝对值。
定电极电势的绝对值。
实际中选定一个标准电极,将其电极电势定实际中选定一个标准电极,将其电极电势定义为零,即可确定其它电极的电极电势。
义为零,即可确定其它电极的电极电势。
IUPAC规定,采用规定,采用标准氢电极标准氢电极作为基准电极。
作为基准电极。
29292.标准氢电极的组成标准氢电极的组成StandardHydrogenElectrode,SHE
(1)海绵状铂黑作电)海绵状铂黑作电极导体;极导体;
(2)H2压力维持压力维持100kPa;(3)H+活度为活度为1(1.184molL-1););(4)EH+/H2=0.0000V3030标准氢电极的组成式可表示为标准氢电极的组成式可表示为:
Pt,H2(100kPa)H(a=1)(5)标准氢电极的组成式(电极符号)铂黑上吸附的铂黑上吸附的H2与溶液中的与溶液中的H建立如下动建立如下动态平衡态平衡:
2H(aq)+2eH2(g)31313.标准电极电势
(1)定义)定义处于标准态下的电极的电势称为该电极的处于标准态下的电极的电势称为该电极的标准电极电势标准电极电势(standardelectrodepotential),用符号用符号E表示。
表示。
(2)标准态)标准态溶液活度为溶液活度为1,或气体压力为或气体压力为100kPa,液体液体和固体为纯净物。
和固体为纯净物。
32324.标准电极电势的测定电池电动势EE+-E-首先和标准氢电极组成原电池,其次确定被测电极是正首先和标准氢电极组成原电池,其次确定被测电极是正极还是负极。
极还是负极。
n若为正极,则其若为正极,则其标准电极电势E+E+EH+/H2En若为负极,则其若为负极,则其标准电极电势E-EH+/H2-E-EnEOx/Red定义为给定电极的定义为给定电极的标准电极电势电极电势(相对值)相对值)。
3333标准电极电势的测定例例5简述测定简述测定Pt|Fe3+(1.0),Fe2+(1.0)的标准的标准电极电势的方法及结果。
电极电势的方法及结果。
解解将将Pt|Fe3+(1.0),Fe2+(1.0)与标准氢电极与标准氢电极组成电池。
从实验电流的方向确定此待测电极组成电池。
从实验电流的方向确定此待测电极为正极,标准氢电极为负极。
为正极,标准氢电极为负极。
测得电动势为测得电动势为0.771V,则则EE+-E-EFe3+/Fe2+-EH+/H2式中式中E的右下角注明了参加电极反应物质的氧的右