氧气.docx
《氧气.docx》由会员分享,可在线阅读,更多相关《氧气.docx(14页珍藏版)》请在冰豆网上搜索。
氧气
氧气
氧气,化学式O2,式量32.00,无色无味气体,氧元素最常见的单质形态。
熔点-218.4℃,沸点-183℃。
不易溶于水,1L水中溶解约30mL氧气。
在空气中氧气约占21%。
液氧为天蓝色。
固氧为蓝色晶体。
常温下不很活泼,与许多物质都不易作用。
但在高温下则很活泼,能与多种元素直接化合,这与氧原子的电负性仅次于氟有关。
氧在自然界中分布最广,占地壳质量的48.6%,是丰度最高的元素。
在烃类的氧化、废水的处理、火箭推进剂以及航空、航天和潜水中供动物及人进行呼吸等方面均需要用氧。
动物呼吸、燃烧和一切氧化过程(包括有机物的腐败)都消耗氧气。
但空气中的氧能通过植物的光合作用不断地得到补充。
中文名:
氧气
英文名:
oxygen
发现人:
马和、约瑟夫·普里斯特利、卡尔·威廉·舍勒
命名人:
拉瓦锡
命名时间:
1777年
CAS号:
7782-44-7
MDL号:
MFCD00011434
EINECS号:
231-956-9
PubChem号:
24845041
氧气-简介
氧气(英文Oxygengas或Dioxygen,分子式O2)是氧元素最常见的单质形态。
氧气是空气的组分之一,无色、无嗅、无味。
氧气密度比空气大,在标准状况(0℃和大气压强101325帕)下密度为1.429克/升,能溶于水,溶解度很小,1L水中约溶30mL氧气。
在压强为101kPa时,氧气在约-180摄氏度时变为淡蓝色液体,在约-218摄氏度时变成雪花状的淡蓝色固体。
氧气-氧气的发现
拉瓦锡
1772年11月,法国科学院收到拉瓦锡对于燃烧现象的研究,也就是早就知道的化学现象:
磷,在空气中会燃烧,冒出白色的浓烟。
1774年10月,拉瓦锡受到普利斯特里和舍勒的启发,做了很精细的实验,被人们称为“二十天实验”。
实验过程中红色的渣滓越来越多。
到了第十二天,红色渣滓不再增多了。
实验结束时,钟罩里的空气的体积,大约减少了五分之一。
他收集了红色的渣滓,用高温加热。
“三仙丹”分解了,重新释放出气体。
拉瓦锡总共得到7~8立方英寸(1立方英寸等于16.377cm)的气体,正好与原先钟罩中失去的气体体积相等。
至于剩下来的气体,既不能帮助燃烧,也不能供呼吸用。
拉瓦赐把那占空气总体积五分之一的气体,称为“氧气”(也就是普利斯特里所谓的“失燃素空气”、舍勒所谓的“火空气”)。
就这样,千百年来被人们当作“元素”的空气,终于被拉瓦锡揭开了真面目──原来,空气是由氧气、氮气、二氧化碳等气体混合组成的。
随着空气之谜被揭开,燃烧的本质也随之被查清楚了。
氧气的中文名称是徐寿命名的。
他认为人的生存离不开氧气,所以就命名为“养气”即“养气之质”,后来为了统一就用“氧”代替了“养”字,叫“氧气”。
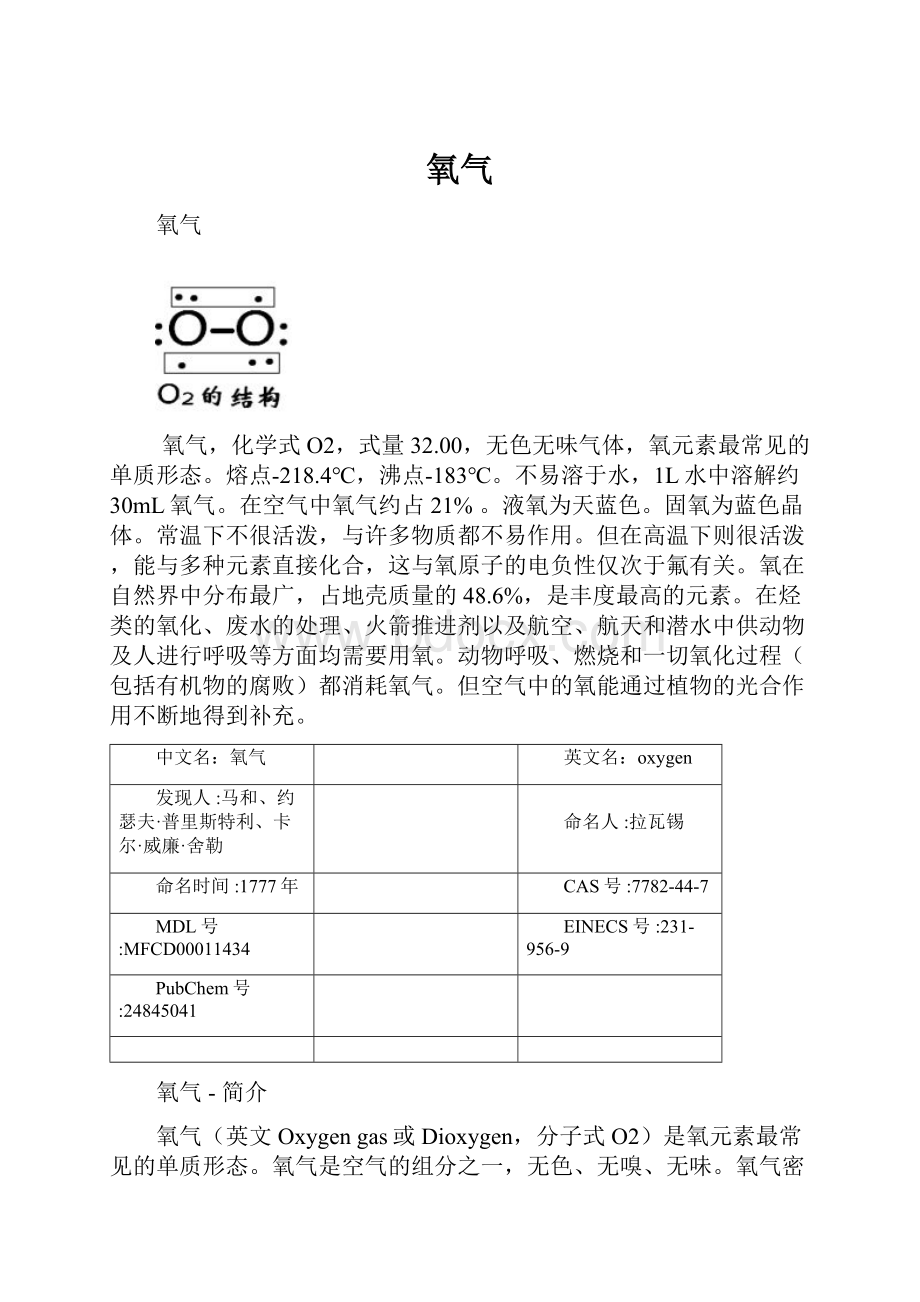
氧气-分布与结构
氧气结构
氧气分子结构
分布:
地球空气中大约含有体积为20.947%的以单质形式存在的氧气。
结构:
氧气是双原子分子,两个氧原子进行sp2轨道杂化,一个单电子填充进sp2杂化轨道,成σ键,另一个单电子填充进p轨道,成π键。
氧气是奇电子分子,具有顺磁性。
氧气-大气层氧气的产生
光合作用制氧
地球的大气层形成初期是不含氧气的。
原始大气是还原性的,充满了甲烷、氨等气体。
大气层氧气的出现源于两种作用。
一个是非生物参与的水的光解,一个是生物参与的光合作用。
生物的光合作用对大气层的影响巨大。
它造成了大气层由还原氛围向氧化氛围的转变。
使得水光解产生的氢气能重新被氧化为水回到地球而不至于扩散到外层空间去,从而防止了地球上的水的流失。
同时光合作用也加速了大气层氧气的积累,深刻地改变了地球上物种的代谢方式和形态。
大气层含氧量在石炭纪的时候一度上升到了35%!
。
氧气含量的增加造成了依赖于渗透方式输氧的昆虫在形态上的巨型化。
在石炭纪曾出现过翼展达一米的巨蜻蜓。
氧气-制法
实验室制法
氧气实验室制法
一般实验室制造氧气使用的方法是:
加热高锰酸钾,化学式为:
2KMnO4=(△)=K2MnO4+MnO2+O2↑
二氧化锰做催化剂,使过氧化氢分解:
用催化剂MnO2并加热氯酸钾,化学式为:
2KClO3=(△,MnO2)=2KCl+3O2↑
用过氧化氢稀溶液加二氧化锰的方法:
双氧水(过氧化氢)在催化剂MnO2(或红砖粉末,土豆,水泥等)中,生成O2和H2O,化学式为:
2H2O2=(MnO2)=2H2O+O2↑
工业制法
工业制造氧气方法:
分离液态空气。
利用氮气、氧气沸点的不同,用低温分馏的方法大量制备氧气。
氧气-理化性质
物理性质
1、色,味,态:
无色无味气体(标准状况)
2、熔点:
-218.4℃,沸点:
-182.9℃
3、密度:
1.429克/升(气),1.419克/厘米 (液),1.426克/厘米 (固)
4、水溶性:
不易溶于水 标准状况下,1L水中可以溶解约30mL的氧气
5、贮存:
天蓝色钢瓶
化学性质
1.氧气跟金属反应
2Mg+O2=2MgO,剧烈燃烧发出耀眼的强光,放出大量热,生成白色固体。
3Fe+2O2=Fe3O4,红热的铁丝剧烈燃烧,火星四射,放出大量热,生成黑色固体。
2Cu+O2=2CuO,加热后亮红色的铜丝表面生成一层黑色物质。
2.氧气跟非金属反应
(炭+氧气→二氧化碳)C+O2=CO2,剧烈燃烧,发出白光,放出热量,生成使石灰水变浑浊的气体。
S+O2=SO2,发生明亮的蓝紫色火焰,放出热量,生成有刺激性气味的气体。
4P+5O2→2P2O5,剧烈燃烧,发出明亮光辉,放出热量,生成白烟。
3.氧气跟一些有机物反应
如甲烷、乙炔、酒精、石蜡等能在氧气中燃烧生成水和二氧化碳。
CH4+2O2=2CO2+2H2O
2C2H2+5O2=4CO2+2H2O
氧气-氧气用途
(1)氧是心脏的“动力源”:
氧是人体进行新陈代谢的关键物质,是人体生命活动的第一需要。
呼吸的氧转化为人体内可利用的氧,称为血氧。
血液携带血氧向全身输入能源,血氧的输送量与心脏、大脑的工作状态密切相关。
心脏泵血能力越强,血氧的含量就越高;心脏冠状动脉的输血能力越强,血氧输送到心脑及全身的浓度就越高,人体重要器官的运行状态就越好。
(2)应用于冶炼工艺中:
在炼钢过程中吹以高纯度氧气,氧便和碳及磷、硫、硅等起氧化反应,降低了钢的含碳量,这利于清除磷、硫、硅等杂质。
氧化过程中产生的热量足以维持炼钢过程所需的温度,因此,吹氧不但缩短了冶炼时间,同时提高了钢的质量。
高炉炼铁时,提高鼓风中的氧浓度可以降焦比,提高产量。
在有色金属冶炼中,采用富氧也可以缩短冶炼时间提高产量。
(3)氧气喷泉:
在美国洛杉矶等大城市,一种氧气喷泉吧随之设立。
在氧气喷泉吧里,人们手持透明氧气罐,其上插上了精巧的外接吸收装置,轻轻一吸,罐内的纯氧即喷涌而出。
带着柠檬或其他香味的氧气可连续输送20分钟。
氧气用途
(4)应用化学工业中:
在生产合成氨时,氧气主要用于原料气的氧化,例如,重油的高温裂化,以及煤粉的气化等,以强化工艺过程,提高化肥产量。
(5)应用于国防工业中:
液氧是现代火箭最好的助燃剂,在超音速飞机中也需要液氧作氧化剂,可燃物质浸渍液氧后具有强烈的爆炸性,可制作液氧炸药。
(6)医疗保健方面供给呼吸:
用于缺氧、低氧或无氧环境,例如:
潜水作业、登山运动、高空飞行、宇宙航行、医疗抢救等时。
(7)增加吸氧量可减少术后感染及止吐
美国的《新英格兰医学杂志》发表一项新的研究成果。
奥地利、美国及澳大利亚的麻醉医师报告,只要在手术中和手术后给病人增加吸氧量,病人术后感染危险将降低一半。
因为增氧可以提高免疫系统的免疫能力,可为患者的“免疫大军”提供更多“弹药”,杀死伤口部位的细菌。
止吐:
增加吸氧比使用的所有止吐药效果更为明显,且无危险和价格低廉。
氧气防止呕吐的机制可能是防止肠道局部缺血,从而阻止催吐因子的释放。
但完全用氧而不用一氧化氮是不可取的,因为这有可能使病人在手术中觉醒。
(8)高压氧治疗突发性耳聋:
高压氧不仅能改善内耳听觉器官的缺氧状态,而且还能改善内耳血液循环即组织代谢,促进听觉功能的恢复。
一旦患了突发性耳聋,应立即去医院高压氧科,因为高压氧对突发性耳聋的疗效常取决于最初的治疗时间,一般在发病后三天之内(最迟不应超过一周)治疗效果最佳。
(9)高压氧治疗牙周病:
高压氧治疗牙周病可提高牙周病局部组织的氧含量和氧的弥散距离,促进侧枝循环的重建,改善局部循环。
血管收缩效应可缓解局部肿胀。
另外,高压氧还能有效地抑制细菌,尤其是厌氧菌的生长繁殖,改善牙周组织的供血、供氧,促进新陈代谢,以利于局部组织的修复,达到抗炎、消肿、止血和除臭的目的。
吸氧
过量吸氧的负作用
早在19世纪中叶,英国科学家保尔·伯特首先发现,让动物呼吸纯氧会引起中毒,人类也同样。
人在大于0.05MPa(半个大气压)的纯氧环境中,对所有的细胞都有毒害作用,吸入时间过长,就可能发生“氧中毒”。
肺部毛细管屏障被破坏,导致肺水肿、肺淤血和出血,严重影响呼吸功能,进而使各胀器缺氧而发生损害。
在0.1MPa(1个大气压)的纯氧环境中,人只能存活24小时,就会发生肺炎,最终导致呼吸衰竭、窒息而死。
人在0.2MPa(2个大气压)高压纯氧环境中,最多可停留1.5小时~2小时,超过了会引起脑中毒,生命节奏紊乱,精神错乱,记忆丧失。
在0.3MPa(3个大气压)甚至更高的氧,人会在数分钟内发生脑细胞变性坏死,抽搐昏迷,导致死亡。
过量吸氧还会促进生命衰老。
进入人体的氧与细胞中的氧化酶发生反应,可生成过氧化氢,进而变成脂褐素。
这种脂褐素是加速细胞衰老的有害物质,它堆积在心肌,使心肌细胞老化,心功能减退;堆积在血管壁上,造成血管老化和硬化;堆积在肝脏,削弱肝功能;堆积在大脑,引起智力下降,记忆力衰退,人变得痴呆;堆积在皮肤上,形成老年斑。
氧气-缺氧
缺氧
缺氧一般分为两种:
一种是体外缺氧,一种是体内缺氧。
体外缺氧:
主要是因为外部原因造成的缺氧。
人处在一个缺少氧气的环境里,如阴天气压低,高原地区,环境污染地区以及写字楼、商场、地下室等都容易造成体外缺氧。
体内缺氧:
是指人体自身的原因,导致吸入氧气的不足,与一些老年病、工作节奏快等原因有关。
如呼吸系统疾病(气管炎、哮喘);血液循环不好(各种心脏疾病,脑供血不足、脑梗、脉管炎、静脉曲张等)。
长期处于体内缺氧状态,人体各个组织供氧不足,加速了身体的衰竭,甚至引发中风等意外,直接威胁到生命的安全。
缺氧的症状表现:
(1)轻度缺氧:
常常打哈欠,手脚冰凉,在大商场、地下设施内感到胸闷气短,心慌、喘气急促。
(2)中度缺氧:
爬楼梯两层以上胸闷气短、喘气急促;口臭、胃酸过多、便秘、皮肤干燥、睡眠不足、多梦易醒,注意力不集中,脸色苍白,心情紧张后头屑增多,出虚汗、视力下降,血压、血脂、血糖偏高,抵抗力减弱,易患感冒。
氧气-测定空气中氧气体积分数
名称
红磷燃烧实验 红磷燃烧试验
原理
红磷在密闭容器中燃烧测定空气中氧气的体积分数
方程式:
4P+5O2=(点燃)=2P2O5
现象:
黄色火焰 白烟 放出热量 水沿导管进入集气瓶中至约五分之一处停止
结论
氧气约占空气体积的五分之一(原理)(1.氮气难溶于水 2.氮气不可燃不助燃)
药品的选择:
选择能与空气中的氧气反应,而不跟氧气及其他气体起反应的固体,且反应后的生成物为固体,这样使密闭容器中气体的量减少,从而使容器中的气体压强变小,大气压将烧杯内的水压入集气瓶中。
药品的替代品:
若可燃物用硫或碳代替磷,则烧杯内的水须用NaOH溶液代替,也可起到相同的效果。
实验误差:
1.气密性良好 否则结果偏小。
2.红磷要足(过)量 否则结果偏小。
3.等到装置完全冷却再打开止水夹 否则结果偏小。
4.实验开始前加上止水夹 否则结果偏大。
5. 红磷点燃后应快速放入集气瓶中并塞紧瓶塞 否则结果偏大。
计算方法
红磷在空气中燃烧生成五氧化二磷(P2O5),但由于氧气和磷的密度相差较大(氧气仅为1.4kg/m3 ,磷的大约在2.34t/m3 )。
即使集气瓶中氧气全部被消耗,所需红磷的量也极小。
生成的五氧化二磷,密度为2.93t/m3 ,五氧化二磷溶于水,进入水中后会占一定的体积,但是由于其密度是氧气的2000多倍,所以其体积基本可以忽略不计(据计算,即使1m3 的空气中的氧气全部耗尽,所生成的五氧化二磷仅为0.5dm3 多一点,其体积为总体积的两千分之一)。
为计算方便,将空气视为由79%的N2和21%的O2构成的。
当0.21体积的氧气被脱去后,由于气体的特性,0.79体积的氮气会自动膨胀至1体积。
根据气体压强公式PV/T=nR,在本实验中由于物质的量n没变,R为一常数,温度变化Δt忽略不计,当压强为P时,体积v的情况下P1V1=P2V2,也就是说,由于氮气的体积增加了,上升了27%,瓶内气压也就自动下降为0.79个大气压。
根据气体流动的物理常识,气体会从压强较高的地方流向压强较低的地方,由于瓶内气压为0.79个大气压,瓶外水槽中大气压为1个大气压,出现压强差,水会沿着导管流入集气瓶中。
当集气瓶内的大气压恢复到和水槽中大气压相等的时候,水便不再流动。
剩余的0.21体积,则由水占据。
这里便可以清晰地看出,水的体积和之前被脱去氧气体积相等。
氧气-测定氧气含量的新方法
实验室测定氧气含量除了用红磷燃烧消耗氧气来测定外,还可以用C,S作为反应物测量,这是就需碱性溶液(如氢氧化钠或氢氧化钙溶液),因为反应的生成物都能与其反应被吸收。
氧气-物质与氧气的反应
(1)单质与氧气的反应:
1. 镁在空气中燃烧:
2Mg + O2 点燃 2MgO
2. 铁在氧气中燃烧:
3Fe + 2O2 点燃 Fe3O4
3. 铜在空气中受热:
2Cu + O2 加热 2CuO
4. 铝在空气中燃烧:
4Al + 3O2 点燃 2Al2O3
5. 氢气中空气中燃烧:
2H2 + O2 点燃 2H2O
6. 红磷在空气中燃烧:
4P + 5O2 点燃 2P2O5
7. 硫粉在空气中燃烧:
S + O2 点燃 SO2
8. 碳在氧气中充分燃烧:
C + O2 点燃 CO2
9. 碳在氧气中不充分燃烧:
2C + O2 点燃 2CO
(2)化合物与氧气的反应:
10. 一氧化碳在氧气中燃烧:
2CO + O2 点燃 2CO2
11. 甲烷在空气中燃烧:
CH4 + 2O2 点燃 CO2 + 2H2O
12. 酒精在空气中燃烧:
C2H5OH + 3O2 点燃 2CO2 + 3H2O
氧气-危险与防控
毒理学资料
1.急性毒性:
人类吸入TCLo:
100pph/14H;
2.繁殖数据:
女人怀孕后26-39周吸入TCLo:
12pph/10M生殖系统和心血管系统出现异常;
大母鼠受孕后22天吸入TDLo:
10pph/12H生殖和呼吸系统出现异常;
大母鼠受孕后22天吸入TDLo:
10pph/9H对生殖、呼吸系统和新生儿生长出现抑制作用;
小鼠受孕后8天吸入TCLo:
10pph/24H皮肤和皮下组织及生殖出现异常;
3.致突变性:
人类淋巴细胞40pph/4D对细胞遗传有影响;
啮齿动物-仓鼠卵巢20pph/3D (Continuous) 对细胞遗传有影响;
啮齿动物-仓鼠肺80pph对细胞遗传有影响;
啮齿动物-仓鼠卵巢姐妹染色体20pph复制受影响;
啮齿动物-仓鼠肺95pph/24H引起细胞突变。
4.亚急性与慢性毒性:
常压下,在80%氧中生活4d,大鼠开始陆续死亡,兔的视细胞全部损毁;在纯氧中,兔48h视细胞全部损毁,狗60h有死亡,猴3d出现呼吸困难,6~9d死亡
5.其他毒害作用:
TCLo:
100%(100%)(人吸入,14h);TCLo:
80%(大鼠吸入)。
过度吸氧负作用:
早在19世纪中叶,英国科学家保尔·伯特首先发现,如果让动物呼吸纯氧会引起中毒,人类也同样。
人如果在大于0.05MPa(半个大气压)的纯氧环境中,对所有的细胞都有毒害作用,吸入时间过长,就可能发生“氧中毒”。
肺部毛细管屏障被破坏,导致肺水肿、肺淤血和出血,严重影响呼吸功能,进而使各脏器缺氧而发生损害。
在0.1MPa(1个大气压)的纯氧环境中,人只能存活24小时,就会发生肺炎,最终导致呼吸衰竭、窒息而死。
人在0.2MPa(2个大气压)高压纯氧环境中,最多可停留小时~2小时,超过了会引起脑中毒,生命节奏紊乱,精神错乱,记忆丧失。
如加入0.3MPa(3个大气压)甚至更高的氧,人会在数分钟内发生脑细胞变性坏死,抽搐昏迷,导致死亡。
此外,过量吸氧还会促进生命衰老。
进入人体的氧与细胞中的氧化酶发生反应,可生成过氧化氢,进而变成脂褐素。
这种脂褐素是加速细胞衰老的有害物质,它堆积在心肌,使心肌细胞老化,心功能减退;堆积在血管壁上,造成血管老化和硬化;堆积在肝脏,削弱肝功能;堆积在大脑,引起智力下降,记忆力衰退,人变得痴呆;堆积在皮肤上,形成老年斑。
缺氧和富氧对人体的影响 氧气浓度(%体积) 征兆(大气压力下)
100% 致命/6分钟(绝对密闭环境,如高压氧舱或深水)
50% 致命/4~5分钟经治疗可痊愈(绝对密闭环境,如高压氧舱)
>23.5% 富氧
20.9% 氧气浓度正常
19.5% 氧气最小允许浓度
15~19% 降低工作效率,并可导致头部、肺部和循环系统问题
10~12% 呼吸急促,判断力丧失,嘴唇发紫
8~10% 智力丧失,昏厥,无意识,脸色苍白,嘴唇发紫,恶心呕吐
6~8% 8分钟
4~6% 40秒内抽搐,呼吸停止,死亡
中毒或泄漏处理
急救措施
吸入:
迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸停止,立即进行人工呼吸。
就医。
灭火方法:
用水保持容器冷却,以防受热爆炸,急剧助长火势。
迅速切断气源,用水喷淋保护切断气源的人员,然后根据着火原因选择适当灭火剂灭火。
现场处理
迅速撤离泄漏污染区人员至上风处,并进行隔离,严格限制出入。
切断火源。
建议应急处理人员戴自给正压式呼吸器,穿一般作业工作服。
避免与可燃物或易燃物接触。
尽可能切断泄漏源。
合理通风,加速扩散。
漏气容器要妥善处理,修复、检验后再用。
操作处置与储存
操作注意事项:
密闭操作。
密闭操作,提供良好的自然通风条件。
操作人员必须经过专门培训,严格遵守操作规程。
远离火种、热源,工作场所严禁吸烟。
远离易燃、可燃物。
防止气体泄漏到工作场所空气中。
避免与活性金属粉末接触。
搬运时轻装轻卸,防止钢瓶及附件破损。
配备相应品种和数量的消防器材及泄漏应急处理设备。
储存注意事项:
储存于阴凉、通风的库房。
远离火种、热源。
库温不宜超过30℃。
应与易(可)燃物、活性金属粉末等分开存放,切忌混储。
储区应备有泄漏应急处理设备。
个体防护
工程控制:
密闭操作。
提供良好的自然通风条件。
身体防护:
穿一般作业工作服。
手防护:
戴一般作业防护手套。
其他防护:
避免高浓度吸入。
贮运方法
包装方法:
钢质气瓶。
运输方法:
氧气钢瓶不得沾污油脂。
采用刚瓶运输时必须戴好钢瓶上的安全帽。
钢瓶一般平放,并应将瓶口朝同一方向,不可交叉;高度不得超过车辆的防护栏板,并用三角木垫卡牢,防止滚动。
严禁与易燃物或可燃物、活性金属粉末等混装混运。
夏季应早晚运输,防止日光曝晒。
铁路运输时要禁止溜放。
氧气-氧气的出现
地球的大气层形成初期是不含氧气的。
原始大气是还原性的,充满了甲烷、氨等气体。
大气层氧气的出现源于两种作用,一个是非生物参与的水的光解,一个是生物参与的光合作用。
生物的光合作用对大气层的影响巨大。
它造成了大气层由还原氛围向氧化氛围的转变。
使得水光解产生的氢气能重新被氧化为水回到地球而不至于扩散到外层空间去,从而防止了地球上的水的流失。
同时光合作用也加速了大气层氧气的积累,深刻地改变了地球上物种的代谢方式和体型。
大气层含氧量在石炭纪的时候一度上升到了35%。
氧气含量的增加造成了依赖于渗透方式输氧的昆虫在体型上的巨型化。
在石炭纪曾出现过翼展2英尺半的巨蜻蜓。