分析化学14.ppt
《分析化学14.ppt》由会员分享,可在线阅读,更多相关《分析化学14.ppt(27页珍藏版)》请在冰豆网上搜索。
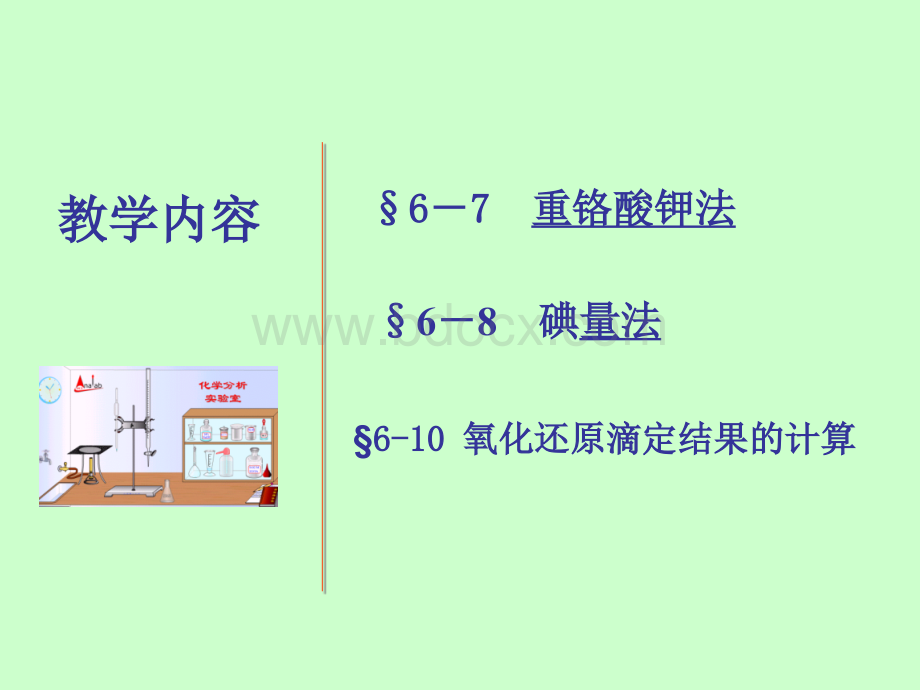
教学内容教学内容68碘碘量法量法6677重铬酸钾法重铬酸钾法6-106-10氧化还原滴定结果的计算氧化还原滴定结果的计算6-76-7重铬酸钾法重铬酸钾法三种强氧化剂的比较三种强氧化剂的比较方法方法项目项目KMnO4K2Cr2O7Ce(SO4)2酸度酸度各种酸度各种酸度强酸强酸强酸强酸半反应半反应MnO4-+8H+5e-Mn2+4H2OCr2O72-+14H+6e-2Cr3+7H2OCe4+e-Ce3+(橙橙)(无无)/V1.491.331.44指示剂指示剂自身自身氧化还原氧化还原氧还或自身氧还或自身标准溶液标准溶液间接法且不稳定间接法且不稳定直接法且稳定直接法且稳定直接法且稳定直接法且稳定应用应用还原剂氧化剂还原剂氧化剂非氧化还原物质非氧化还原物质有机物有机物还原性物质还原性物质返滴定法测有返滴定法测有机物机物同高锰酸钾法同高锰酸钾法特点特点存在诱导反应存在诱导反应污染环境污染环境(先(先处理成处理成Cr3+再再倒)倒)试剂较贵试剂较贵特点:
特点:
(1)可在盐酸介质中反应可在盐酸介质中反应,不会氧化不会氧化Cl-而发生误差而发生误差。
(2)需需要要采采用用氧氧化化还还原原指指示示剂剂(二二苯苯胺胺磺磺酸酸钠钠),终终点点时时溶溶液液由由绿绿色色(Cr3+的颜色的颜色)突变为突变为紫色紫色或紫蓝色。
或紫蓝色。
1.重铬酸钾法测定铁重铬酸钾法测定铁Cr2O72-+6Fe2+14H+=2Cr3+6Fe3+7H2O滴定终点将过早到达。
如何解决?
滴定终点将过早到达。
如何解决?
注意:
二苯胺磺酸钠的注意:
二苯胺磺酸钠的滴定至滴定至99.9%时:
时:
=Fe3+/Fe2+0.059lg(cFe()/cFe()=0.68+0.059lg(99.9/0.1)=0.86V加入加入H3PO4:
(1)降低铁电对电位降低铁电对电位,使终点指示更准确。
使终点指示更准确。
例:
在例:
在1molL-1HCl与与0.25molL-1H3PO4溶液中溶液中Fe3+/Fe2+=0.51V
(2)Fe3+生成无色生成无色Fe(PO4)23-,使终点容易观察;,使终点容易观察;重铬酸钾法测定铁是测定矿石中全铁量的标准方法。
重铬酸钾法测定铁是测定矿石中全铁量的标准方法。
COD:
(ChemicalOxygenDemand。
)量度水体受还原性物质量度水体受还原性物质(主要是有机物主要是有机物)污染程污染程度的综合性指标。
它是指水体中还原性物质所消耗度的综合性指标。
它是指水体中还原性物质所消耗的氧化剂的量,的氧化剂的量,换算成氧的质量浓度换算成氧的质量浓度(mg.L-1)。
2.水样中化学耗氧量水样中化学耗氧量(COD)的测定的测定用用KMnO4法测定时称为法测定时称为CODMn,或称为,或称为“高锰酸盐指数高锰酸盐指数”。
)以以K2Cr2O7法测定时称为法测定时称为CODCr。
(见见GB11914-1989)例:
例:
化学耗氧量(化学耗氧量(COD)的)的测定。
今取定。
今取废水水样100.0mL用用H2SO4酸化后,加入酸化后,加入25.00mL0.01667molL-1K2Cr2O7溶液,以溶液,以Ag2SO4为催化催化剂,煮沸一定,煮沸一定时间,待水,待水样中中还原原物物质较完全地氧化后,以完全地氧化后,以邻二氮二氮杂菲菲亚铁为指示指示剂,用,用0.1000molL-1FeSO4溶液滴定剩余的溶液滴定剩余的Cr2O72,用去,用去15.00mL。
计算算废水水样中化学耗氧量,以中化学耗氧量,以mgL-1表示。
表示。
CODCr=80.04(80.04(mgL-1)解:
解:
6Fe2+Cr2O72+14H+=6Fe3+2Cr3+7H2O第六章习题186.8碘碘量量法法1.碘量法的特点碘量法的特点碘量法是基于碘量法是基于I2的氧化性及的氧化性及I还原性的分析方法。
还原性的分析方法。
I3-+2e=3I-I2/2I-0.534V用用I2标准溶液直接标准溶液直接滴定强还原剂滴定强还原剂的方法是的方法是直接碘法直接碘法;利用利用I-与氧化剂作用定量析出与氧化剂作用定量析出I2,再用还原剂标准再用还原剂标准溶液与溶液与I2反应反应,测定氧化剂测定氧化剂的方法称为的方法称为间接碘法间接碘法。
一、一、概概述述2.间接碘法的间接碘法的基本反应基本反应滴定反应在中性或弱酸性中进行滴定反应在中性或弱酸性中进行:
强碱性溶液中,强碱性溶液中,I2会发生歧化反应会发生歧化反应3I2+6OH-=IO3-+5I-+3H2O强酸性溶液中,强酸性溶液中,Na2S2O3会发生分解,会发生分解,I也也容易被氧化容易被氧化S2O32-+2H+=SO2+S+H2O4I-+4H+O2=2I2+2H2OI-2e=II2+2S2O2-=2I-+S4O62-可测定的物质可测定的物质(11)凡是能与)凡是能与KIKI作用定量地析出作用定量地析出II22的氧化性物质的氧化性物质(22)碱性条件下能与过量碘作用的有机物质)碱性条件下能与过量碘作用的有机物质,如如HCHOHCHO3.碘量法的主要误差来源碘量法的主要误差来源
(1)I
(1)I2易挥发易挥发;
(2)I
(2)I-在酸性条件下容易被空气所氧化。
在酸性条件下容易被空气所氧化。
措施:
措施:
碘量瓶;加过量碘量瓶;加过量KI(比理论量大比理论量大23倍倍),生成生成I3-;滴定时不要剧烈摇动,避光,低温(滴定时不要剧烈摇动,避光,低温(25)下滴定。
)下滴定。
(3)(3)指示剂指示剂(淀粉淀粉)-在少量在少量II-存在下与存在下与II2形成蓝色吸附配合物形成蓝色吸附配合物淀粉应是淀粉应是新鲜配制新鲜配制的的,否则终点变色不敏锐否则终点变色不敏锐(消失缓慢消失缓慢);反应的灵敏度还随溶液反应的灵敏度还随溶液温度温度升高而降低升高而降低(50是是25的的1/10);不能含甲不能含甲醇醇或乙醇等或乙醇等.二、Na2S2O3标准溶液的配制与标定Na2S2O35H2O常含有少量杂质,且性质不稳定,容易常含有少量杂质,且性质不稳定,容易分解等,所以不能用直接法配制标准溶液。
分解等,所以不能用直接法配制标准溶液。
配好的配好的Na2S2O3溶液溶液不稳定,不稳定,因为因为:
水中的水中的微生物微生物可使可使NaNa22SS22OO33分解分解Na2S2O3=Na2SO3+S水中溶解的水中溶解的COCO22的作用:
的作用:
S2O2-+CO2+H2O=S+HSO3-+HCO3-1.间接法配制间接法配制水中溶解水中溶解OO22的作用:
的作用:
2S2O2-+O2=2SO42-+2S溶液保存在棕色瓶中,置于暗处放置溶液保存在棕色瓶中,置于暗处放置881414天后标定。
天后标定。
2.2.配制配制Na2S2O3时注意:
时注意:
用新煮沸用新煮沸(除氧、除除氧、除COCO22、杀菌杀菌)并冷却的蒸馏水。
并冷却的蒸馏水。
加入少量加入少量NaNa22COCO33(约约0.02%0.02%),使溶液呈弱碱性),使溶液呈弱碱性(抑抑制细菌生长制细菌生长)。
长期保存的溶液,长期保存的溶液,12个月标定一次。
个月标定一次。
3.标标定定基准物有基准物有K2Cr2O7,KBrO3,KIO3,Cu等。
用等。
用间接碘间接碘法法标定。
标定。
方法:
准确称取一定量基准物,在酸性条件下与过量方法:
准确称取一定量基准物,在酸性条件下与过量KI反应,析出的反应,析出的I2用用Na2S2O3溶液滴定,以淀粉为指示剂。
溶液滴定,以淀粉为指示剂。
有关反应如下:
有关反应如下:
Cr2O72-+6I-+14H+=2Cr3+3I2+7H2OIO3-+5I-+6H+=3I2+3H2O2Cu2+4I-=2CuI+I2I2+2S2O2-=2I-+S4O62-终点颜色变化终点颜色变化:
蓝色蓝色无色无色滴滴定定至至终终点点后后,再再过过几几分分钟钟溶溶液液又又变变蓝蓝,属属正正常常现现象。
象。
标定时注意事项:
标定时注意事项:
析出析出II22的反应的反应酸度要适宜(酸度要适宜(0.81.0mol/L),),酸度越大,酸度越大,v越快。
但酸度太大时,越快。
但酸度太大时,I-易被空气中的易被空气中的O2氧化氧化。
K2Cr2O7与与KI的的v较慢,在暗处放较慢,在暗处放5分钟分钟,再滴定。
再滴定。
淀粉淀粉指示剂指示剂应在溶液呈浅黄色应在溶液呈浅黄色(大部分(大部分I2已反应)时已反应)时加入加入,否则指示剂会吸留否则指示剂会吸留I2使终点拖后。
使终点拖后。
这是由于这是由于I-I2空气空气CuSO4中铜的测定:
中铜的测定:
2Cu2+4I-=2CuI+I2CuI强烈地吸附强烈地吸附I2,会使测定结果偏低。
会使测定结果偏低。
加入加入KSCN可以改善这种情况:
可以改善这种情况:
CuI+KSCN=2CuSCN+KI注意:
注意:
KSCN只能在接近终点时加入只能在接近终点时加入!
否则否则SCN-可能被氧化而使结果偏低。
可能被氧化而使结果偏低。
三、三、应用及计算应用及计算例:
分析铜矿试样例:
分析铜矿试样0.6000g,用去用去Na2S2O3溶液溶液20.00mL,已知已知1mLNa2S2O3相当于相当于0.004175gKBrO3,计算计算Na2S2O3溶液的准确浓度及试样中溶液的准确浓度及试样中Cu2O的质量分的质量分数。
(数。
(已知已知MKBrO3=167.01MCu2O=143.09)(习题习题1313)解:
(1)标定反应标定反应BrO3-+6I-+6H+=3I2+3H2O+BrI2+2S2O2-=2I-+S4O62-nNa2S2O3=6nKBrO31BrO3-3I26S2O2-cNa2S2O3=0.1500mol/L1Cu2O2Cu2+1I22S2O2-=35.78%2Cu2+4I-=2CuI+I2I2+2S2O2-=2I-+S4O62
(2)测定反应测定反应6.10氧化还原滴定结果的计算氧化还原滴定结果的计算例例1:
用:
用25.00mLKMnO4溶液恰能氧化一定量的溶液恰能氧化一定量的KHC2O4H2O,而同量而同量KHC2O4H2O又恰能被又恰能被20.00mL0.2000molL-1KOH溶液中和,求溶液中和,求KMnO4溶液的浓度。
溶液的浓度。
解:
解:
2MnO4-+5C2O42-+16H+=2Mn2+10CO2+8H2OnKMnO4=(2/5)nC2O42-=(2/5)nHC2O42-KHC2O4+KOH=K2C2O4+H2OnKHC2O4H2O=nKOH=(cV)KOH已知两次作用的已知两次作用的KHC2O4H2O的量相同的量相同故故(cV)KMnO4=2/5cKOHVKOH即即cKMnO425.00=2/50.200020.00cKMnO4=0.06400molL-1例例2:
2:
以以KIO3为为基基准准物物采采用用间间接接碘碘量量法法标标定定0.1000molL-1Na2S2O3溶溶液液的的浓浓度度。
若若滴滴定定时时,欲欲将将消消耗耗的的Na2S2O3溶溶液液的的体积控制在体积控制在25mL左右左右,问应当称取,问应当称取KIO3多少克多少克?
1IO3-3I2-6S2O32-解:
反应式为解:
反应式为:
IO3-+5I-+6H+=3I2+3H2OI2+2S2O32-=2I-+S4O62-因此因此:
应称取应称取KIO3的量为的量为:
mKIO3=1/6(cV)Na2S2O3MKIO3=1/60.10002510-3214.0=0.0892g例例3:
称称取取含含KI之之试样1.000g,溶溶于于水水。
加加10mL0.05000molL-1KIO3溶溶液液处理理,反反应后后煮煮沸沸驱尽尽所所生生成成的的I2,冷冷却却后后,加加入入过量量KI溶溶液液与与剩