高中化学 钠元素及其化合物讲义1 精.docx
《高中化学 钠元素及其化合物讲义1 精.docx》由会员分享,可在线阅读,更多相关《高中化学 钠元素及其化合物讲义1 精.docx(16页珍藏版)》请在冰豆网上搜索。
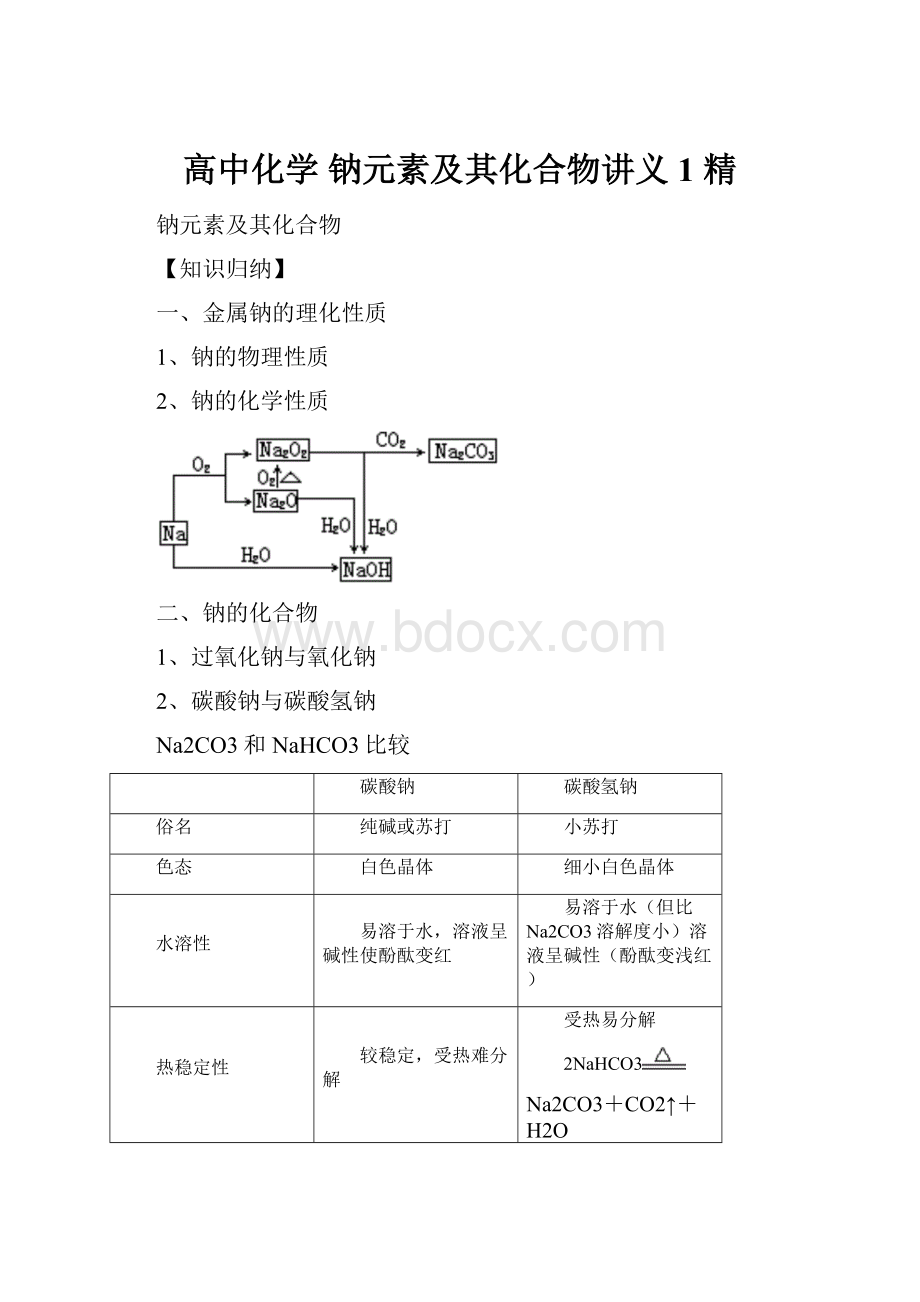
高中化学钠元素及其化合物讲义1精
钠元素及其化合物
【知识归纳】
一、金属钠的理化性质
1、钠的物理性质
2、钠的化学性质
二、钠的化合物
1、过氧化钠与氧化钠
2、碳酸钠与碳酸氢钠
Na2CO3和NaHCO3比较
碳酸钠
碳酸氢钠
俗名
纯碱或苏打
小苏打
色态
白色晶体
细小白色晶体
水溶性
易溶于水,溶液呈碱性使酚酞变红
易溶于水(但比Na2CO3溶解度小)溶液呈碱性(酚酞变浅红)
热稳定性
较稳定,受热难分解
受热易分解
2NaHCO3
Na2CO3+CO2↑+H2O
与酸反应
CO
+H+
HCO
HCO
+H+
CO2↑+H2O
HCO
+H+
CO2↑+H2O
相同条件下放出CO2的速度NaHCO3比Na2CO3快
与碱反应
Na2CO3+Ca(OH)2
CaCO3↓+2NaOH
反应实质:
CO
与金属阳离子的复分解反应
NaHCO3+NaOH
Na2CO3+H2O
反应实质:
HCO
+OH-
H2O+CO
与H2O和CO2的反应
Na2CO3+CO2+H2O
2NaHCO3
CO
+H2O+CO2
HCO
不反应
与盐反应
CaCl2+Na2CO3
CaCO3↓+2NaCl
Ca2++CO
CaCO3↓
不反应
主要用途
玻璃、造纸、制皂、洗涤
发酵、医药、灭火器
转化关系
典型例题
1.一小块金属钠长时间置于空气中,可能有下列现象,这些现象出现的先后顺序是( )
①变成白色粉末 ②变暗 ③变成白色固体 ④变成液体
A.①②③④ B.②③④①
C.②③①④D.③②④①
解析:
钠在空气中发生如下变化:
Na→Na2O→NaOH→Na2CO3·10H2O→Na2CO3。
反应现象为:
钠由银白色变暗,之后变成白色固体(NaOH),白色固体潮解变成液体,与空气中的CO2、H2O结合形成白色晶体(Na2CO3·10H2O),最后晶体风化,变成白色粉末(Na2CO3)。
答案:
B
2.在烧杯中加入水和苯(苯的密度为0.88g/cm3,与水互不相溶,且不与钠反应)各50mL,将一小粒金属钠(密度为0.97g/cm3)投入烧杯中,观察到的现象可能为( )
A.钠在水层中反应并四处游动
B.钠停留在苯层中不发生反应
C.钠在苯的液面上反应并四处游动
D.钠在苯与水的界面处反应并可能上浮下沉
解析:
苯与水互不相溶,且钠的密度介于苯和水之间;加入钠后,钠处在苯与水的中间。
由于钠能与水反应,生成氢气,氢气附着在钠的周围,浮力增大,钠上浮进入苯层,氢气放出后,浮力减小,钠又回到水层,这样上浮下沉至反应完全。
答案:
D
3.在一定条件下,将钠与氧气反应的生成物1.5g溶于水,所得溶液恰好能被80ml浓度为0.50mol·L-1的HCl溶液中和,则该生成物的成分是()
A.Na2OB.Na2O2C.Na2ONa2O2D.Na2O2NaO2
3、C
4.向紫色石蕊试液中加入过量Na2O2粉末振荡,可观察到的现象是()
A.溶液仍为紫色B.最终溶液褪色,而无其它现象
C.溶液最终变蓝色D.溶液中有气泡产生,溶液最终变为无色
5.设阿伏加德罗常数的值为NA,下列说法正确的是()
A.1mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为NA
B.1molNa2O2与足量CO2反应时,转移2NA个电子
C.1mol·L-1的NaOH溶液中含Na+数目为NA
D.1molNa2O2中含有的阴离子数目为2NA
6.(双选)过氧化钠可做为氧气的来源,常温常压下为二氧化碳与过氧化钠反应,若固体质量增加了28克,反应中有关质量的物理量正确的是()
A.二氧化碳44克,氧气16克
B.二氧化碳88克,氧气32克
C.碳酸钠106克,氧气16克
D.碳酸钠106克,氧气32克
4、D5、A6、AB
7.除去括号内的杂质,所选用的试剂或方法不正确的是()
A.Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
B.NaHCO3溶液(Na2CO3),应通入过量的CO2气体
C.Na2O2粉末(Na2O),将混合物在氧气中加热
D.Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
D
8.将过量CO2通入NaOH溶液中反应,然后将得到的溶液蒸干并灼烧最后剩余固体成分为()
A.Na2CO3B.Na2CO3和NaOHC.NaHCO3D.NaHCO3和Na2CO3
A
巩固训练
1.2.3g纯净的金属钠在干燥的空气中被氧化后得到3.5g固体,由此判断其产物是( )
A.只有Na2OB.只有Na2O2
C.Na2O和Na2O2D.无法确定
解析:
若2.3g钠全部生成Na2O,质量为3.1g;若2.3g钠全部生成Na2O2,质量为3.9g,因为3.1g<3.5g<3.9g,故氧化产物应为Na2O和Na2O2的混合物。
答案:
C
2.将金属钠分别投入下列物质的稀水溶液中,能生成白色沉淀的是( )
A.HClB.K2SO4
C.MgCl2D.CuCl2
解析:
在考虑钠与碱、盐水溶液反应的问题时,注意钠与水反应的同时,还要考虑生成的NaOH与溶液中溶质的反应。
钠与四种溶液反应都生成氢气;CuCl2溶液中会有蓝色沉淀生成,只有氯化镁溶液中可生成白色沉淀。
答案:
C
3.下列关于钠的性质叙述中,不正确的是( )
A.切下一小块钠,投入水中,钠熔成小球,说明钠与水反应有热量放出
B.从钠能与水反应可推知钠也能与盐酸反应
C.钠在空气中燃烧生成氧化钠
D.切开一块钠,呈银白色,很快变暗,说明钠常温下能与氧气反应
解析:
钠在空气中燃烧时发生反应:
2Na+O2
Na2O2,故C选项错误。
答案:
C
4.[双选题]关于Na2O2与CO2、H2O反应的叙述正确的是( )
A.Na2O2与CO2反应中,Na2O2只作还原剂,CO2作氧化剂
B.Na2O2与H2O反应中,Na2O2既作氧化剂又作还原剂
C.Na2O2与CO2反应中,1molNa2O2转移2mol电子
D.Na2O2与水反应中,1molNa2O2转移1mol电子
解析:
Na2O2与CO2、H2O反应中,既作氧化剂又作还原剂,且1molNa2O2反应均转移1mol电子。
故选B、D。
答案:
BD
5.1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
A.Na2CO3 B.Na2O2 Na2CO3
C.NaOH Na2CO3D.Na2O2 NaOH Na2CO3
解析:
由题意可知,首先发生反应:
2NaHCO3
Na2CO3+H2O+CO2↑,生成H2O和CO2各1mol;然后H2O和CO2与Na2O2反应:
2Na2O2+2H2O===4NaOH+O2↑,2Na2O2+2CO2===2Na2CO3+O2,CO2和H2O完全反应需消耗2molNa2O2,但题中只有1molNa2O2,应优先考虑与CO2的反应:
1molNa2O2先与1molCO2反应,生成1molNa2CO3和0.5molO2。
最后残留的固体是Na2CO3。
答案:
A
6.下列叙述中正确的是( )
A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成
B.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1∶2
C.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D.向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出
解析:
A项,CaCO3+CO2+H2O===Ca(HCO3)2,产物与NaHCO3不反应。
B项,发生反应:
CO
+H+===HCO
,不生成CO2。
C项,等质量的NaHCO3和Na2CO3分别与足量盐酸反应时,NaHCO3产生的CO2多。
D项,向饱和Na2CO3溶液中通入CO2时发生反应:
Na2CO3+CO2+H2O===2NaHCO3↓,反应中消耗H2O,且生成的NaHCO3溶解度小、质量多,故NaHCO3会结晶析出。
答案:
D
7.[双选题]有两个无标签的试剂瓶,分别装有Na2CO3和NaHCO3固体,有四位同学为鉴别它们采用以下不同方法,其中可行的是( )
A.分别将它们配制成溶液,再加入澄清石灰水
B.分别将它们配制成溶液,再加入NaOH溶液
C.分别将它们配制成溶液,再加入CaCl2溶液
D.分别加热,再用石灰水检验是否有CO2产生
解析:
A项中发生的反应分别为:
Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2O,两者现象相同(产生白色沉淀);B项中只发生反应:
NaHCO3+NaOH===Na2CO3+H2O,但无明显现象;C项Na2CO3与CaCl2发生反应:
Na2CO3+CaCl2===CaCO3↓+2NaCl,产生白色沉淀,NaHCO3与CaCl2不反应,可以鉴别;D项将固体物质分别加热后,只发生反应:
2NaHCO3
Na2CO3+H2O+CO2↑,产生的CO2能使澄清石灰水变浑浊。
答案:
CD
8.下列对于过氧化钠的叙述中,正确的是( )
A.过氧化钠能与酸反应生成盐和水,所以过氧化钠是碱性氧化物
B.过氧化钠能与水反应,所以过氧化钠可以作很多气体的干燥剂
C.过氧化钠与水反应时,过氧化钠是氧化剂,水是还原剂
D.过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂
解析:
A项:
产物中还有O2生成,故不是碱性氧化物,B项,Na2O2与H2O反应产生O2,故不能作干燥剂,Na2O2与水、CO2的反应中,Na2O2既是氧化剂又是还原剂。
D项正确。
答案:
D
9.用光洁的铂丝蘸取某无色溶液在无色火焰上灼烧,直接观察时看到火焰呈黄色,下列判断正确的是( )
A.只含Na+
B.一定含Na+,可能含有K+
C.既含有Na+,又含有K+
D.可能含有Na+,可能还含有K+
解析:
钠的焰色是黄色,K的焰色是紫色,观察K的焰色时需要透过蓝色钴玻璃,以滤去黄色光的干扰,该实验中没有通过蓝色钴玻璃观察说明一定含Na+,不能确定是否含K+。
答案:
B
10.将一小块钠投入到FeCl3溶液中,此时观察到的现象是__________________________________________________________,有关的化学方程式是__________________________________________________________。
解析:
钠与盐溶液反应分两个过程,一是钠与水反应,二是NaOH与盐的反应。
答案:
钠浮于液面上,熔成闪亮的小球,四处游动,发出嘶嘶的响声,溶液中有红褐色沉淀析出 2Na+2H2O===2NaOH+H2↑,3NaOH+FeCl3===Fe(OH)3↓+3NaCl或2FeCl3+3H2O+6Na===2Fe(OH)3↓+3H2↑+6NaCl
11.(10分)下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。
填写下列空白:
(1)写出化学式:
A______________,B______________,D______________。
(2)以上反应中属于氧化还原反应的有______________(填序号)。
(3)写出反应⑤的离子方程式:
____________________________________。
写出反应⑥的化学方程式:
___________________________________。
解析:
由题给条件知A为单质钠,再由图示关系可以看出,B是A与O2在点燃条件下生成且焰色反应为黄色,故B为Na2O2,C为NaOH,D为Na2CO3,E为NaHCO3。
答案:
(1)Na Na2O2 Na2CO3
(2)①②③④
(3)OH-+CO2===HCO
2NaHCO3
Na2CO3+CO2↑+H2O
12.A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃性气体。
而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。
D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。
请回答下列问题:
(1)写出A、C、F的化学式
A________;C________;F________。
(2)写出F和H反应的化学方程式____________________________________。
(3)写出下列反应的离子方程式:
①D+盐酸_________________________________;
②B+水___________________________________。
解析:
由焰色反应为黄色,且A、B、C、D均与盐酸反应生成E,知E为NaCl,B还生成一种可燃性气体知B为Na,C、D还生成气体H使澄清石灰水变浑浊,知C、D为Na2CO3或NaHCO3,F和H(CO2)反应生成C和另一种气体,则F为Na2O2、C为Na2CO3,因而D为NaHCO3,D和A反应可生成Na2CO3,则A为NaOH。
答案:
(1)NaOH Na2CO3 Na2O2
(2)2Na2O2+2CO2===2Na2CO3+O2
(3)①HCO
+H+===H2O+CO2↑
②2Na+2H2O===2Na++2OH-+H2↑
提升训练
1.①纯净的碳酸钠ag;②碳酸钠与碳酸氢钠的混合物ag,两者相比下列各种情况的描述正确的是( )
A.分别和盐酸完全反应时,混合物的耗酸量大
B.分别和盐酸完全反应时,纯净的碳酸钠放出的CO2多
C.分别溶于水,再加入足量澄清石灰水,混合物得到的沉淀质量大
D.分别配成等体积溶液,混合物溶液中的Na+的物质的量浓度大
解析:
同质量的Na2CO3比NaHCO3耗酸量要多,但是产生的CO2要少,故A、B项均错误;同质量的两组物质,混合物含的碳元素较多,故最终转化成CaCO3沉淀的质量就大,C项正确;同质量的Na2CO3比NaHCO3所含Na+物质的量大,故配成等体积溶液后纯净的碳酸钠溶液中的Na+物质的量浓度大,故D项错误。
答案:
C
2.把2.3gNa投入到97.7g水中,所得溶液中溶质的质量分数为()
A.2.3%B.4%C.大于4%D.小于4%
3.将金属钠投入下列溶液中,既有气体又有沉淀析出的是()
A.BaCl2B.(NH4)2SO4C.Fe2(SO4)3D.NH4HSO4
2、C3、C
4.为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1g样品加热,其质量变为w2g,则该样品的纯度(质量分数)是( )
A.
B.
C.
D.
解析:
依据NaHCO3受热分解的化学方程式,结合反应前后固体质量差可列式求解:
2NaHCO3
Na2CO3+H2O↑+CO2↑ Δm
2×84 106 18 44 62
m(NaHCO3) (w1-w2)g
m(NaHCO3)=
g,
m(Na2CO3)=w1-m(NaHCO3)=
g。
答案:
A
5.“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验。
实验操作:
钠与氯气反应的装置可作如图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。
先给钠预热,到钠熔融成小球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。
以下叙述错误的是
A.反应生成的大量白烟是氯化钠晶体
B.浸有NaOH溶液的棉球用于吸收未反应的氯气,以免污染空气
C.用淀粉碘化钾溶液滴在管外的棉球,可以判断氯气是否被完全吸收
D.钠着火燃烧产生苍白色火焰
6.等质量的两块钠,第一块在足量氧气中加热,第二块在足量氧气(常温)中充分反应,则
下列说法正确的是()
A.第一块钠失去电子多
B.两块钠失去电子一样多
C.第二块钠的反应产物质量最大
D.两块钠的反应产物质量一样大
答案:
5、D6、B
7.1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体是()
A.Na2CO3B.Na2O2、Na2CO3
C.NaOH、Na2CO3D.Na2O2、NaOH、Na2CO3
A
8.CO与H2的混合气体3g在足量氧气中燃烧后,在150℃时将混合气体通过足量的Na2O2后,Na2O2增重的质量为()
A.1.5gB.3gC.6gD.无法计算
B
9.将O2、CH4、Na2O2放入密闭容器中,在150℃条件下电火花引发恰好完全反应后,容器中的压强为零。
原O2、CH4、Na2O2物质的量之比为()
A.1∶2∶6B.2∶1∶6C.1∶2∶8D.2∶1∶4
A
10.将一定质量的钠、氧化钠、过氧化钠的混合物与足量的水反应,得到0.36g混合气体,通过放电完全反应,则混合物中钠、氧化钠、过氧化钠的质量比可能为()
A.23∶62∶7B.92∶93∶156C.23∶124∶78D.46∶93∶78
B
11.取ag某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体增加的质量大于ag。
下列物质中满足以上结果的是:
( )
①H2②CO③C6H12O6④C2H5OH⑤HCOOCH3⑥C12H22O11
A.①②③④⑤⑥B.①②③⑤C.③④⑤⑥D.④⑥
B
12.在一定条件下,使CO和O2的混合气体26g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14g,则原混合气体中O2和CO的质量比可能是( )。
A.9∶4B.1∶1
C.7∶6D.6∶7
D
13.某溶液中含有HCO
、CO
、SO
、Na+、NO
五种离子。
若向其中加入Na2O2粉末充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是( )
A.NO
B.CO
、NO
C.SO
、NO
D.CO
、NO
、Na+
C
14.下列叙述中正确的是()
A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成
B.向Na2CO3溶液中加入含等物质的量的HCl的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1∶2
C.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D.向Na2CO3饱和溶液中通入足量CO2,有NaHCO3结晶析出
D
15.(10分)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示。
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是________(填装置序号)。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式:
________________________________________________________________________;
与实验Ⅲ相比,实验Ⅳ的优点是__________(填选项序号)。
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ比Ⅲ操作简便
D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是________(填化学式)。
解析:
(1)Na2CO3、NaHCO3均能与盐酸反应生成使澄清石灰水变浑浊的CO2气体,但等质量的Na2CO3与NaHCO3跟过量盐酸反应时,NaHCO3与盐酸反应更剧烈且产生气体的量多,故实验Ⅰ不能鉴别Na2CO3与NaHCO3,而实验Ⅱ可以。
(2)NaHCO3受热易分解:
2NaHCO3
Na2CO3+CO2↑+H2O,Na2CO3受热不分解,可用加热方法鉴别,对比实验Ⅲ,实验Ⅳ可以同时进行两个对比实验,现象明显。
(3)将NaHCO3置于小试管B,Na2CO3置于大试管A,加热时D中澄清石灰水不变浑浊,C中变浑浊,说明Na2CO3比NaHCO3稳定。
答案:
(1)Ⅱ
(2)2NaHCO3
Na2CO3+CO2↑+H2O D (3)NaHCO3