新高考化学反应原理综合题.docx
《新高考化学反应原理综合题.docx》由会员分享,可在线阅读,更多相关《新高考化学反应原理综合题.docx(33页珍藏版)》请在冰豆网上搜索。
新高考化学反应原理综合题
化学反应原理综合题
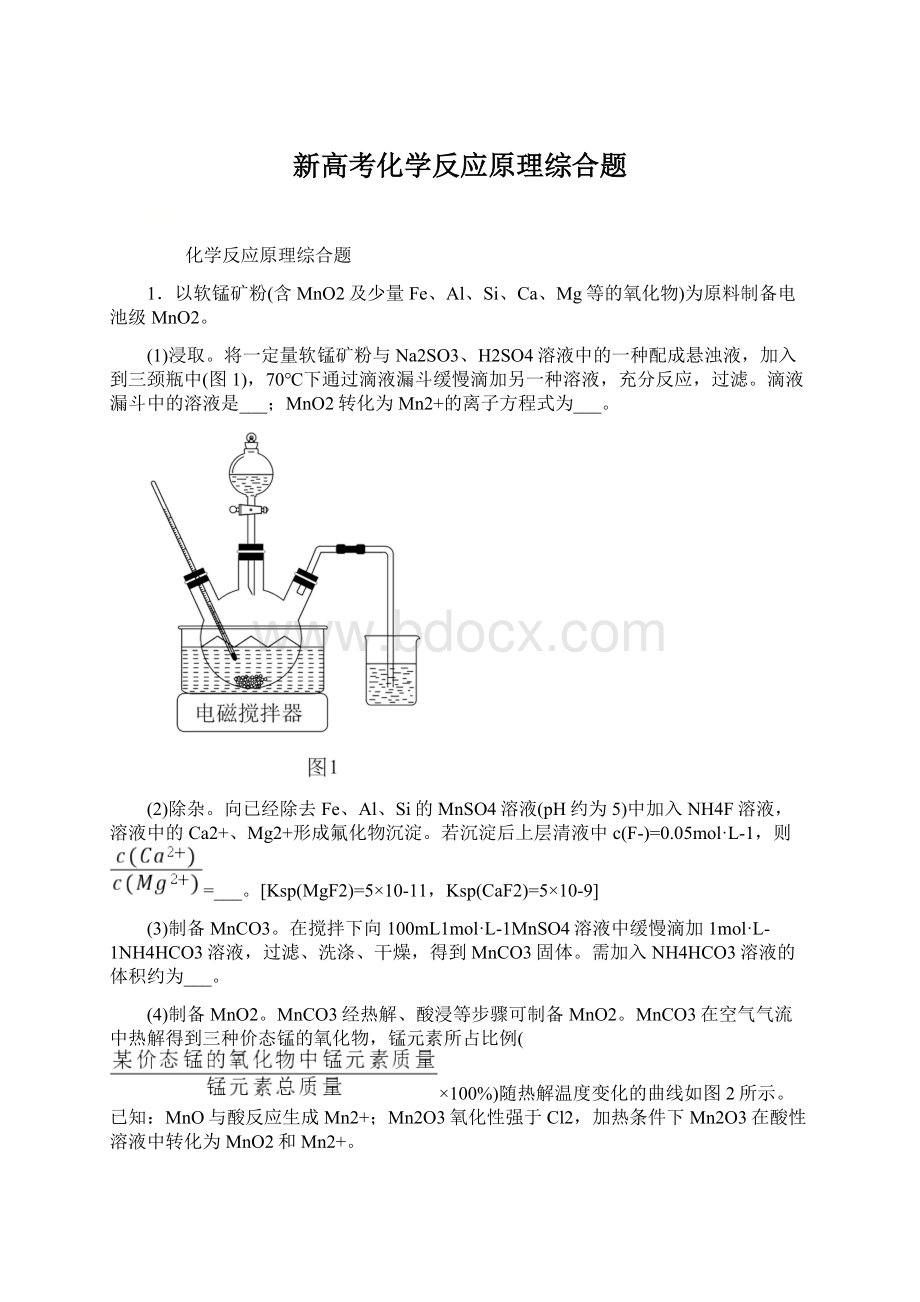
1.以软锰矿粉(含MnO2及少量Fe、Al、Si、Ca、Mg等的氧化物)为原料制备电池级MnO2。
(1)浸取。
将一定量软锰矿粉与Na2SO3、H2SO4溶液中的一种配成悬浊液,加入到三颈瓶中(图1),70℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤。
滴液漏斗中的溶液是___;MnO2转化为Mn2+的离子方程式为___。
(2)除杂。
向已经除去Fe、Al、Si的MnSO4溶液(pH约为5)中加入NH4F溶液,溶液中的Ca2+、Mg2+形成氟化物沉淀。
若沉淀后上层清液中c(F-)=0.05mol·L-1,则=___。
[Ksp(MgF2)=5×10-11,Ksp(CaF2)=5×10-9]
(3)制备MnCO3。
在搅拌下向100mL1mol·L-1MnSO4溶液中缓慢滴加1mol·L-1NH4HCO3溶液,过滤、洗涤、干燥,得到MnCO3固体。
需加入NH4HCO3溶液的体积约为___。
(4)制备MnO2。
MnCO3经热解、酸浸等步骤可制备MnO2。
MnCO3在空气气流中热解得到三种价态锰的氧化物,锰元素所占比例(×100%)随热解温度变化的曲线如图2所示。
已知:
MnO与酸反应生成Mn2+;Mn2O3氧化性强于Cl2,加热条件下Mn2O3在酸性溶液中转化为MnO2和Mn2+。
为获得较高产率的MnO2,请补充实验方案:
取一定量MnCO3置于热解装置中,通空气气流,___,固体干燥,得到MnO2。
(可选用的试剂:
1mol·L-1H2SO4溶液、2mol·L-1HCl溶液、BaCl2溶液、AgNO3溶液)。
2.甲烷是重要的资源,通过下列过程可实现由甲烷到氢气的转化。
(1)500℃时,CH4与H2O重整主要发生下列反应:
CH4(g)+H2O(g)CO(g)+3H2(g)
CO(g)+H2O(g)H2(g)+CO2(g)
已知CaO(s)+CO2(g)=CaCO3(s)ΔH=-178.8kJ·mol-1。
向重整反应体系中加入适量多孔CaO,其优点是___。
(2)CH4与CO2重整的主要反应的热化学方程式为
反应I:
CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH=246.5kJ·mol-1
反应II:
H2(g)+CO2(g)=CO(g)+H2O(g)ΔH=41.2kJ·mol-1
反应III:
2CO(g)=CO2(g)+C(s)ΔH=-172.5kJ·mol-1
①在CH4与CO2重整体系中通入适量H2O(g),可减少C(s)的生成,反应3CH4(g)+CO2(g)+2H2O(g)=4CO(g)+8H2(g)的ΔH=___。
②1.01×105Pa下,将n起始(CO2):
n起始(CH4)=1:
1的混合气体置于密闭容器中,不同温度下重整体系中CH4和CO2的平衡转化率如图1所示。
800℃下CO2平衡转化率远大于600℃下CO2平衡转化率,其原因是___。
(3)利用铜—铈氧化物(xCuO·yCeO2,Ce是活泼金属)催化氧化可除去H2中少量CO,催化氧化过程中Cu、Ce的化合价均发生变化,可能机理如图2所示。
将n(CO):
n(O2):
n(H2):
n(N2)=1:
1:
49:
49的混合气体以一定流速通过装有xCuO·yCeO2催化剂的反应器,CO的转化率随温度变化的曲线如图3所示。
①Ce基态原子核外电子排布式为[Xe]4f15d16s2,图2所示机理的步骤(i)中,元素Cu、Ce化合价发生的变化为___。
②当催化氧化温度超过150℃时,催化剂的催化活性下降,其可能原因是___。
3.研究CO2与CH4反应使之转化为CO和H2,对减缓燃料危机和减弱温室效应具有重要的意义。
工业上CO2与CH4发生反应Ⅰ:
CH4(g)+CO2(g)=2CO(g)+2H2(g) ∆H1.在反应过程中还发生反应Ⅱ:
H2(g)+CO2(g)=H2O(g)+CO(g) ∆H2=+41kJ·mol−1。
(1)已知部分化学键的键能数据如下表所示:
化学键
C-H
H-H
C=O
C≡O(CO)
键能(kJ·mol-1)
413
436
803
1076
则∆H1=_______kJ·mol−1,反应I在一定条件下能够自发进行的原因是_______,在密闭容器中加入CO2与CH4发生反应,下列能够判断反应反应I达到平衡状态的是_______(填标号)。
A.一定温度下,容积固定的容器中,密度保持不变
B.容积固定的绝热容器中,温度保持不变
C.一定温度和容积固定的容器中,平均相对分子质量不变
D.一定温度和容积固定的容器中,H2和H2O物质的量之和保持不变
(2)将1molCH4与1molCO2在2L密闭容器中反应制取CO和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。
①923K时CO2的平衡转化率大于CH4的原因是_______。
②计算923K时反应Ⅰ的化学平衡常数K=_______(计算结果保留小数点后两位)。
③1200K以上CO2和CH4的平衡转化率趋于相等的原因可能是_______。
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。
250~300℃时,温度升高而乙酸的生成速率降低的原因是_______。
4.(2021·山东·模拟预测)CO2的回收利用对减少温室气体排放,改善人类生存环境具有重要意义。
(1)利用CO2和CH4重整可制合成气(主要成分为CO、H2),重整过程中部分反应的热化学方程式如下:
①CH4(g)═C(s)+2H2(g)△H=+75.0kJ•mol-1
②CO2(g)+H2(g)═CO(g)+H2O(g)△H=+4l.0kJ•mol-1
③CO(g)+H2(g)═C(s)+H2O(g)△H=-131.0kJ•mol-1
则反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H=___________。
(2)CO2可经过催化氢化合成乙烯。
反应的化学方程式为:
2CO2(g)+6H2(g)CH2=CH2(g)+aM(g)△H。
在2L密闭容器中充入2molCO2和nmolH2,在一定条件下发生反应,CO2的转化率与温度、投料比X{X=}的关系如图所示:
①M的化学式为___________,a=___________。
②A、B两点对应的平衡常数:
Ka___________Kb(填“>”“<”或“=”)
③当X=X2时,C点处V正___________V逆。
(填“>”“<”或“=”)
④合成乙烯的反应能够自发进行的条件是___________。
⑤若X=2、T=300K,当反应进行到50min时,CO2的转化率为25%,则反应速率v(H2)=___________。
5.(2021·浙江·模拟预测)工业上通过电解饱和食盐水为基础制取氯气等产品。
请回答:
(1)电解饱和食盐水的离子方程式_______。
(2)电解时用盐酸控制阳极区溶液的pH在2~3。
用化学平衡移动原理解释盐酸的作用_______。
(3)工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为TiO2)为原料生产TiCl4,相应的化学方程式为:
I.TiO2(s)+2Cl2(g)⇌TiCl4(g)+O2(g)ΔH1=+181kJ·mol−1
II.2C(s)+O2(g)⇌2CO(g)ΔH2=-221kJ·mol−1
反应的总式为:
TiO2(s)+2Cl2(g)+2C(s)⇌2CO(g)+TiCl4(g)ΔH3
在温度为T时,向2.0L恒容密闭容器中充入1.0molCl2,并加入足量的TiO2和C,反应经过一段时间后达到平衡。
反应过程中测定的部分数据见下表:
t/s
0
50
150
250
350
n(TiCl4)/mol
0
0.16
0.19
0.20
0.20
结合以上信息,回答下列问题:
①结合数据,说明氯化过程中加碳的理由_______。
②前50s,Cl2的反应速率v(Cl2)=_______mol·L−1·s−1
③下列措施能提高Cl2的平衡转化率的是_______。
A.保持恒容通入惰性气体
B.在反应器中增加C和TiO2的含量
C.反应开始时在原容器中加入2molCl2
D.增大容器体积以减小体系压强
6.(2021·湖南·模拟预测)含氮化合物广泛存在于自然界,是一类常见的化合物。
(1)汽车尾气是城市主要空气污染物,汽车内燃机工作时发生反应:
,是导致汽车尾气中含有NO的原因之一、已知或CO可以催化还原NO以达到消除污染的目的。
写出与反应生成和的热化学方程式是______,判断该反应自发进行的条件:
______(填“高温自发”或“低温自发”)。
(2)已知当质量一定时,增大固体催化剂的表面积可提高化学反应速率。
如图表示在其他条件不变时,反应中NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
①则该反应△H______0(填“>”或“<”)。
②若催化剂的表面积,在该图中画出c(NO)在、条件下达到平衡过程中的变化曲线______。
(3)尿素是一种重要的化工原料,工业上可用氨和二氧化碳来合成尿素:
。
一定条件下,往10L恒容密闭容器中充入2mol和1mol。
①该反应10min后达到平衡,测得容器中气体密度为,平衡常数K=______;
②达到平衡后,再往容器中加入2mol和1mol,则达到新平衡时反应物的转化率______(填“增大”、“减小”或“不变”);
(4)是一种新型绿色硝化剂,其制备可以采用电解法。
图1是硼氢化钠燃料电池,图2是电解制备装置。
则电极a应连接电极______(填c或d),写出电极a的反应______。
7.(2021·安徽合肥·一模)CO2是一种廉价的碳资源,其综合利用可以减少碳排放,对保护环境有重要意义。
回答下列问题:
(1)碱液吸收。
用NaOH溶液捕获CO2,若所得溶液中c()∶c()=2∶1,则溶液pH=_______。
(室温下,H2CO3的K1=4×l0-7;K2=5×10-11)。
(2)催化转化。
以CO2、H2为原料在催化剂作用下合成CH3OH涉及的主要反应如下,答下列问题:
Ⅰ.CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH1=-49.5kJ/mol
Ⅱ.CO(g)+2H2(g)CH3OH(g)ΔH2=-90.4kJ/mol
Ⅲ.CO2(g)+H2(g)CO(g)+H2O(g)ΔH3
①ΔH3=____kJ/mol。
②一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,经tmin达到平衡时,容器中CH3OH(g)为amol,CO为bmol,这段时间内以H2O(g)表示的化学反应速率为______________mol∙L-1∙min-1(用含a、b、V、t的代数式表示)。
③不同压强下,按照n(CO2)∶n(H2)=1∶3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度(T)的变化关系如下图所示。
其中纵坐标表示CH3OH的平衡产率的是____(填“X”或“Y”);压强p1、p2、p3由大到小的顺序为____;温度高于T1时,Y几乎相等的原因是____。
④为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为____(填标号)。
A.低温、低压 B.高温、高压 C.低温、高压 D.高温、低压
(