中考化学综合题及参考答案.docx
《中考化学综合题及参考答案.docx》由会员分享,可在线阅读,更多相关《中考化学综合题及参考答案.docx(16页珍藏版)》请在冰豆网上搜索。
中考化学综合题及参考答案
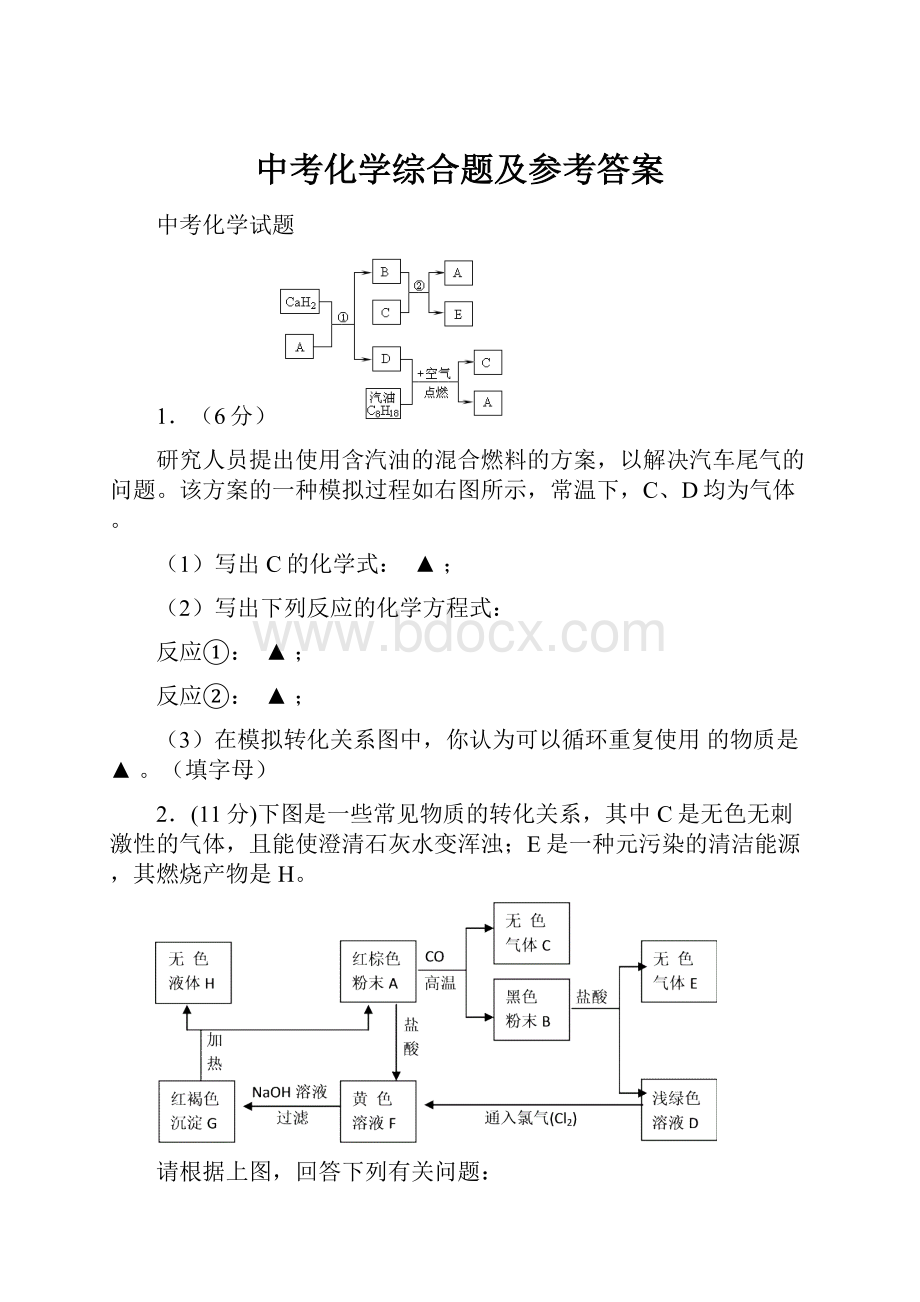
中考化学试题
1.(6分)
研究人员提出使用含汽油的混合燃料的方案,以解决汽车尾气的问题。
该方案的一种模拟过程如右图所示,常温下,C、D均为气体。
(1)写出C的化学式:
▲;
(2)写出下列反应的化学方程式:
反应①:
▲;
反应②:
▲;
(3)在模拟转化关系图中,你认为可以循环重复使用的物质是▲。
(填字母)
2.(11分)下图是一些常见物质的转化关系,其中C是无色无刺激性的气体,且能使澄清石灰水变浑浊;E是一种元污染的清洁能源,其燃烧产物是H。
请根据上图,回答下列有关问题:
(1)红棕色粉末A和气体C、E的化学式分别为:
A▲、C▲、E:
▲。
(2)G转化为H和A的反应类型是▲反应;B转化成E和D的反应类型是▲反应。
(3)①A与盐酸反应的化学方程式为:
▲;
②D和氯气化合生成F的化学方程式为:
▲。
(4)以上图中无色气体C为中心,延展如下图:
①请写出实现这两个转化的另一反应物J、K的化学式:
J▲、K▲。
②请完善由CO和CaCO3分别转变成无色气体C的转化关系图,在箭号上注明必要的反应条件和其它反应物。
3.(9分)“钾泻盐”的化学式为MgSO4·KCl·xH2O,是一种制取钾肥的重要原料,它溶于水得到KCl与MgSO4的混合溶液。
某化学活动小组为了测定“钾泻盐”中KCl的质量分数,设计了如下两种实验方案:
方案一:
方案二:
试回答下列问题:
(1)你认为方案▲比较合理,理由是▲。
(2)请选择上述方案中的数据,计算24.85g钾泻盐样品中MgSO4的质量。
(写出计算过程)▲ 。
(3)请选择上述方案中的数据,计算24.85g钾泻盐样品中KCl的质量分数。
(写出计算过程)▲。
4.“节能减排”是可持续发展的一项重要举措。
下列图标中,属于节能标志的是
ABCD
一些与燃烧和爆炸有关的图标
5.(6分)右图中的物质均是初中化学常见物质,其中A是常见的无色液体,F是大理石的主要成分,甲是生活里常用的燃料。
根据它们之间的转化关系(有些反应条件、反应物、生成物已省略)。
回答下列问题:
(1)C的化学式是_____;
(2)D→E的化学方程式是:
_________________________;
(3)F→D的化学方程式是_______________,该反应的基本类型是_____反应。
6.化学为体育不仅雪中送炭,而且锦上添花。
举重、体操等项目的运动员在比赛前常用白色的“镁粉”搓手,这是因为“镁粉”质轻、吸水性好,可做防滑剂。
“镁粉”的有效成份是碱式碳酸镁,它不可燃,300℃即分解,其分解的化学方程式是:
Mg5(OH)2(CO3)4△5MgO+X+4CO2↑,则X的化学式是_____;根据这些信息,还能推断出“镁粉”的另一种用途是_____。
7.(6分)现称取变质的氢氧化钠样品10g,配制成溶液,再向其中加入CaCl2溶液(反应的化学方程式为:
Na2CO3+CaCl2=CaCO3↓+2NaCl)。
反应时CaCl2溶液与沉淀的质量关系如图所示。
请解决以下问题:
(1)计算样品中NaOH的质量;
(2)计算所加CaCl2溶液的溶质质量分数;
(3)恰好完全反应时烧杯中溶液的pH______7(选填“>”、“<”或“=”)
8.(15分)叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
【应用研究】
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为_______。
【制备研究】
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和
气体X,该反应的化学方程式为2NaNH3+N2O=NaN3+NaOH+X,实验室检验X
气体使用的试纸是湿润________。
【Na2CO3质量分数测定】
工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图
装置(已知H2SO4溶液与NaN3,反应不生成气体)。
(3)装置A的作用是_____。
设计的实验步
骤为:
①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,_______;⑤再次称量装置C。
计算碳酸钠含量至少需要测定______
(填数字)个数据。
根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因
_______。
M
【NaN3纯度测定】
精确称量0.140gNaN3样品,设计如图装置,测定其纯度。
已知2NaN3→3N2
(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。
(4)检查该装置气密性的方法是连接好装置,从水准瓶
注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差_____(填“变大”、“变小”或“不变”),说明气密性良好。
(5)使小试管中的NaN3样品与M溶液接触的操作是
______。
(6)使用冷水冷凝的目的是______。
反应前应将液面调
节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是_______。
(7)常温下测得量气管读数为67.2mL(N2的密度为
1.25g/L),则实验中选用的量气管规格合适的是_____(填字母序号)。
A.100mLB.1LC.2L
(8)计算NaN3样品的纯度(写出计算过程)。
9.(6分)下图表示某些物质间转化关系。
其中A、D是由相同元素组成的固体,且A为紫黑色,C为黑色粉末,B、E为常见气体;X与F是由相同元素组成的无色液体,且X具有消毒杀菌作用;Y是一种红色金属。
请回答下列问题:
(1)A的化学式是▲;
(2)C物质在反应③中的作用▲;
(3)写出反应②、④、⑥的化学方程式:
②▲;④▲;⑥▲;
(4)若将合成气中两气体按分子数之比为1:
1进行化合(原子利用率为100%),可合成多种有机化工产品,写出其中一种可能产品的化学式▲。
10.(4分)已知A、B、C、D、E五种物质均为初中化学中常见的化合物,它们相互转化的关系如图所示。
(1)如果A、B均为黑色固体,C是造成温室效应的主要气体。
则E的化学式
是,A与B反应的化学方程式可能是。
(2)如果C是一种常见的建筑材料,A溶液与B溶液反应的现象是,D与E反应的化学方程式可能为。
11.(6分)今年全国人大和政协会议使用了一种含碳酸钙的“石头纸”:
为测定其中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品。
分别在5只烧杯中进行了实验,实验数据见下表(假设纸张其他成分既不溶于水,也不与水反应):
烧杯①
烧杯②
烧杯③
烧杯④
烧杯⑤
加入样品的质量/g
10
10
10
10
10
加入稀盐酸的质量/g
10
20
30
40
50
充分反应后生成气体的质量/g
0.88
1.76
X
3.52
3.52
(1)表中X的值为;
(2)求样品中碳酸钙的质量分数;
(3)烧杯④中物质充分反应后所得溶液的质量为g。
12、(5分)小梅同学学习了单质、氧化物、酸、碱、盐性质后,发现许多不同类别的物质反应时能生成盐,于是她构建了甲图所示的知识网络图。
甲乙
(1)请你把甲图中①②处补充完整,要求不能与图中已有信息重复。
①;②。
(2)乙图中A~H都是初中化学中常见的物质,已知A、B为黑色固体,D为红色固体单质,F为红色粉末,它们的转化关系如乙图所示。
请回答:
①物质B的化学式为。
②写出E+F→G的化学方程式。
③写出一个能实现G+H→D的化学方程式。
13.21.(6分)有A、B、C、D、E五种常见物质,它们有如下图所示关系
已知:
C是一种金属,气体D可以使澄清石灰水变浑浊。
(1)写出物质的名称:
A 、C 、E 。
(2)请按要求写出化学方式:
A和B反应:
;该反应的基本反应类型为 。
14.(7分)天燃气矿有时会发生“井喷”事故,喷出的气体中含有大量的硫化氢(H2S)气体,造成了人员伤亡和较大的经济损失。
蛋类腐败时会产生一种无色、有臭鸡蛋气味的硫化氢气体,它的密度比空气大,能溶于水,其水溶液叫氢硫酸。
硫化氢有剧毒。
硫化亚铁(FeS)是一种黑色块状固体,把稀硫酸滴在硫化亚铁表面,会产生硫化氢气体,实验室常利用这个反应制取硫化氢。
请填写下列空白:
(1)上述内容中,属于硫化氢物理性质的是;
(2)实验室制取少量硫化氢气体时,应选用下图中的装置,收集时选用装置(用序号回答),气体由(填导管口代号)导入集气瓶;
(3)收集完气体后,因H2S有剧毒,需对H2S尾气进行特别处理,以防止污染环境。
现有如下方法,其中处理H2S尾气的效果最好的是(填序号)。
15.(6分)已知A、B、C、D是四种化合物,甲、乙、丙是三种单质;A是含碳化合物,其相对分子质量小于20。
在一定条件下,它们之间存在如下转化关系:
(1)写出A、C、甲、乙四种物质的化学式:
A,C,甲,乙;
(2)写出物质D与甲反应生成C的化学方程式。
16.(4分)A、B、C、D、E是初中化学中常见的不同物质,
其中A为黑色固体。
其转化关系如图所示:
(1)A的化学式为,B的化学式为。
(2)若C为难溶性钙盐,写一个由E→D的化学方程式。
(3)图中所示的所有转化的化学反应中,一定不包含的基本反应类型是反应。
17.A、B、C、D、E是初中化学常见的五种不同类别的物质,其中A、B、C中含有相同元素,B是导致“温室效应”的一种气体。
图中“--”表示相连的物质在一定条件下可以发生反应,“→”表示物质间存在转化关系。
(1)物质D是(写化学式)_________________;它的一种用途是_________________。
(2)写出图中有关反应的化学方程式:
A→B____________________________________________;
C+E________________________________________________,其基本反应类型。
1
(1)CO2(1分)
(2)①CaH2+2H2O====Ca(OH)2+2H2↑(2分)
②Ca(OH)2+CO2====CaCO3↓+H2O(2分)
(3)AC(1分)
2.(11分)
(1)A:
Fe2O3、C:
CO2、E:
H2 (每空1分,共3分)
(2)分解反应 置换反应 (每空1分,共2分)
(3)①Fe2O3+6HCl=2FeCl3+3H2O②2FeCl2+Cl2=2FeCl3(每空1分,共2分)
(4)① C, Ca(OH)2(每空1分,共2分)
②
(由CO或CaCO3转化为CO2的其他合理途径也行)
3.(9分)
(1)二(1分)
方案二两种物质都能测定,而方案一只能测定硫酸镁不能测定氯化钾。
(1分)
(2)解:
设该样品中MgSO4的质量为X
MgSO4+Ba(NO3)2=BaSO4↓+Mg(NO3)2 (1分)
120233
X23.30g
120:
233=X:
23.30g (1分)
X=12.00g
答:
该样品中MgSO4的质量为12.00g(1分)
(3)解:
设该样品中KCl的质量为Y
AgNO3+KCl=AgCl↓+KNO3(1分)
74.5143.5
Y14.35g
74.5:
143.5=Y:
14.35g(1分)
Y=7.45g
该样品中KCl的质量分数=7.45g/24.85g×100%=29.98%(1分)
答:
该样品中KCl的质量分数为29.98%
4.B
5.(6分)化学方程式2分,其余每空l分。
(1)H2
(2)C02+2NaOH=Na2C03+H20等
(3)CaC03+2HCl=CaCl2+H20+C02↑复分解反应
(或CaC03高温CaO+C02↑分解反应)
6.H20阻燃剂
7.(6分)
(1)解:
设样品中碳酸钠的质量为x,加入的氯化钙溶液中的溶质质量为y
Na2C03+CaCl2=CaC03↓+2NaCl
106 111 100
x Y 5g
106/100=x/5g
x=5.3g………………………………1分
该样品中NaOH的质量为l0g-5.3g=4.7g……………………1分
(2)111/y=100/5g
y=5.55g………………………………………………………l分
所加CaCl2溶液的溶质质量分数=5.55g/50g×l00%=111%1分
答:
样品中NaOH的质量为4.7g,所加CaCl2溶液的溶质质量分数为ll.1%
设、答完整1分
(3)>…………………………………………………………1分
9.(6分,每空1分)
(1)KMnO4
(2)催化剂或催化作用
(3)②CH4+2O2
CO2+2H2O
④2Cu+O2+H2O+CO2=Cu2(OH)2CO3
⑥Fe2O3+3CO
2Fe+3CO2(写成FeO、Fe3O4、FexOy的形式且正确给分)
(4)CH2O或C2H4O2、C3H6O3、C4H8O4、C6H12O6(其它合理答案均给分,元素顺序不限)
10.(4分)
(1)O2C+2CuO
2Cu+CO2↑(2C+2Fe3O4
3Fe+2CO2↑)
(2)溶液变浑浊或生成白色沉淀CO2+2NaOH==Na2CO3+H2O(其他合理即可)
11.(6分)
(1)2.64…………………(1分)
(2)(4分)解:
设10g样品中碳酸钙的质量为x……………………………(0.5分)
CaCO3+2HCl==CaCl2+H2O+CO2↑………………………………………(1分)
10044
x3.52g
x=8g……………………………………………(1分)
………
此石头纸中碳酸钙的质量分数为:
………(1分)
答…………………………(0.5分)
(3)(1分)44.48
12.(5分)
(1)①酸+盐②金属+盐(①、②无顺序要求)
13.(6分)
(1)氧化铜 铜 一氧化碳
(2)C+2CuO
2Cu+CO2↑ 置换反应
14.(7分)
(1)无色、有臭鸡蛋气味的气体,密度比空气大,能溶于水(2分)
(2)B(2分);D(1分);b(1分)
(3)H(1分)
15.(6分)
(1)A:
CH4(1分)C:
CO2(1分)甲:
O2(1分)乙:
H2(1分)
(2)2CO+O2
2CO2(2分)
16.
(1)CCO
17.
(1)NaOH(或Ca(OH)2)用于造纸(或可作建筑材料)
(2)C+O2
CO2;CaCO3+2HCl=CaCl2+H2O+CO2↑(或Na2CO3+H2SO4=Na2SO4+H2O+CO2↑),复分解反应