初中化学计算题试题含答案.docx
《初中化学计算题试题含答案.docx》由会员分享,可在线阅读,更多相关《初中化学计算题试题含答案.docx(16页珍藏版)》请在冰豆网上搜索。
初中化学计算题试题含答案
初中化学计算题试题含答案
一、初中化学计算题
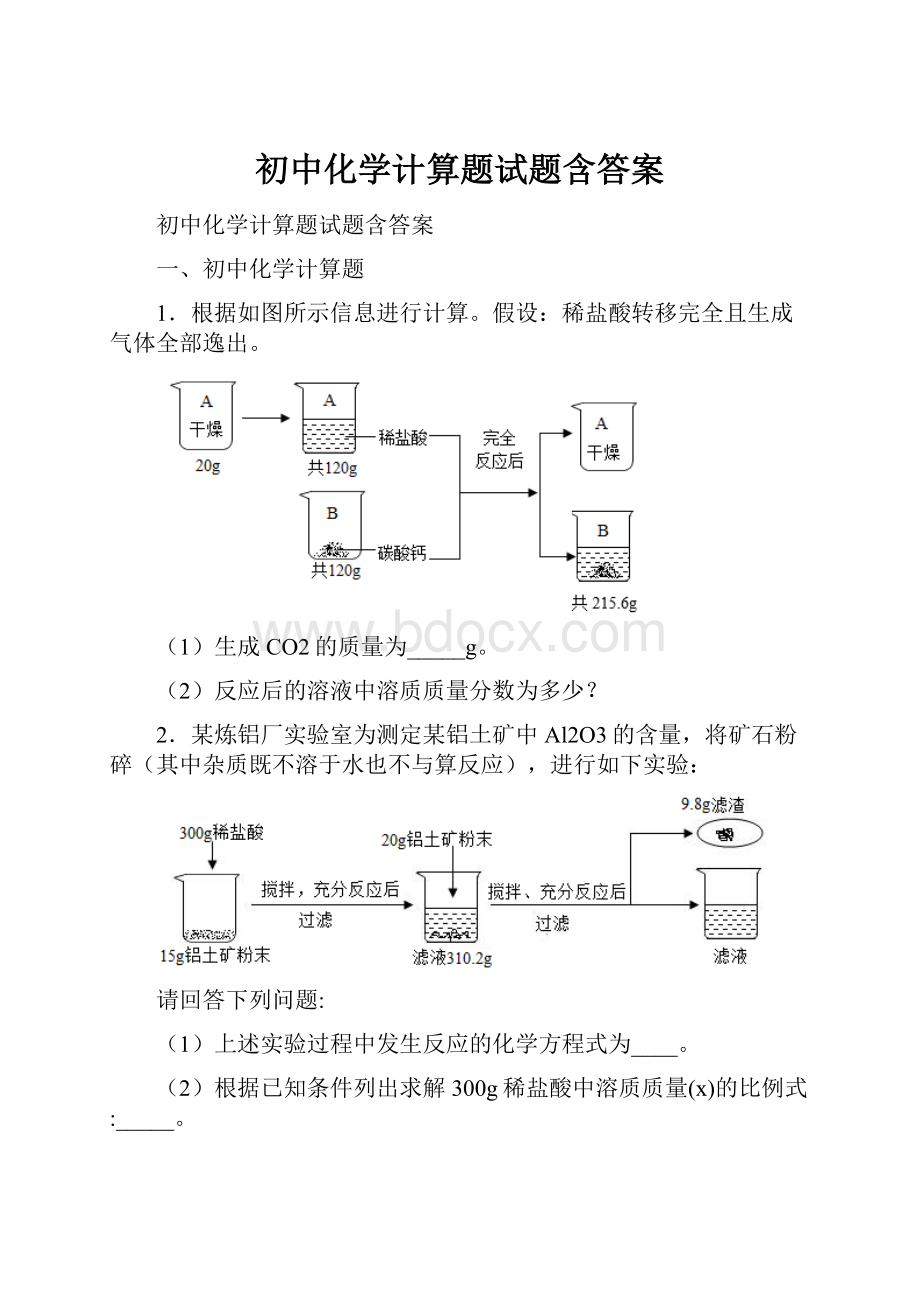
1.根据如图所示信息进行计算。
假设:
稀盐酸转移完全且生成气体全部逸出。
(1)生成CO2的质量为_____g。
(2)反应后的溶液中溶质质量分数为多少?
2.某炼铝厂实验室为测定某铝土矿中Al2O3的含量,将矿石粉碎(其中杂质既不溶于水也不与算反应),进行如下实验:
请回答下列问题:
(1)上述实验过程中发生反应的化学方程式为____。
(2)根据已知条件列出求解300g稀盐酸中溶质质量(x)的比例式:
_____。
(3)配制上述所用的稀盐酸,需要质量分数为36.5%的浓盐酸和水的质量最简整数比为_____。
(4)铝土矿中Al2O3的质量分数是_____。
(5)若将最终所得溶液蒸发掉水20.4g,所得不饱和溶液中溶质的质量分数为_____。
(6)该炼铝厂每天用上述铝土矿300t来生产生铝。
则理论上日产含镁46%的镁铝合金的质量为_____。
3.某化学兴趣小组对胃药“碳酸氢钠片”进行了探究,具体做法如下:
Ⅰ.取一片胃药研碎,加水完全溶解得100g溶液;
Ⅱ.配制100g溶质质量分数0.365%的稀盐酸模拟胃酸;
Ⅲ.取上述20g碳酸氢钠溶液加入锥形瓶,再逐滴滴加稀盐酸,用数据传感技术测得溶液pH变化如下图。
请回答下列问题:
(1)当滴入稀盐酸质量为5g,混合溶液呈_______(填“酸”、“碱”或“中”)性。
当滴入稀盐酸质量为15g,混合溶液中溶质是_______。
用7.3%的稀盐酸和蒸馏水,为了配制100g溶质质量分数0.365%的稀盐酸,需要量取_______mL蒸馏水。
(2)步骤Ⅲ中向锥形瓶中滴入10g溶质质量分数0.365%稀盐酸时,两种物质恰好完全反应〔胃药中其它成分不参加反应)请依据实验数据计算每片胃药中碳酸氢钠的质量,写出必要的计算过程____。
4.为测定某纯碱(Na2CO3)样品中(含有少量的氯化钠杂质)碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(产生的气体全部逸出)。
产生气体的质量与滴入稀盐酸的质量关系如图所示,试计算:
⑴A点产生气体的质量为;
⑵试样中碳酸钠的质量分数(结果精确到0.1%);
⑶B点时,烧杯内溶液中溶质的化学式。
5.化学兴趣小组选择某石灰石样品进行了下列实验:
他们取样品20g放入质量为100g的锥形瓶中,往瓶内分3次加入稀盐酸(样品中的杂质不与稀盐酸反应),并称量了三次加入稀盐酸反应结束时的质量。
有关实验数据如下表。
请计算:
次数
1
2
3
加入稀盐酸的质量/g
50
50
50
反应后的总质量
166.7
213.4
263.4
(1)反应共产生气体的质量为________g。
(2)稀盐酸溶质的质量分数。
6.化学兴趣小组的同学为测定某珍珠粉中碳酸钙的质量分数,称取12.5g样品进行四次高温煅烧、冷却、称量剩余固体质量的重复操作(杂质不参加反应),记录数据如下表:
操作次序
第一次
第二次
第三次
第四次
剩余固体质量/g
10.8
9.6
8.1
8.1
试计算该珍珠粉中碳酸钙的质量分数。
7.实验室有瓶标签模糊的烧碱溶液,小军测量其溶质质量分数的操作如下:
①取一洁净的锥形瓶称量,其质量为25.5g,往其中注入一定量上述烧碱溶液,并滴入1滴酚酞溶液后,又称量锥形瓶,质量为37.5g;
②取质量分数为24.5%的稀硫酸逐滴滴入上述锥形瓶中,边滴边振荡,当观察到溶液由红色变为无色时,停止滴液。
再次称量锥形瓶,质量为51.0g
请解答下列问题:
(1)所取烧碱溶液的质量=______g。
(注:
滴入酚酞的质量忽略不计)
(2)反应所消耗的稀硫酸质量=_______g。
(3)通过计算确定该瓶烧碱溶液的溶质质量分数。
(列出计算过程)___________
(4)问题讨论:
小亮做同样的实验得到的结果与小军的结果有差异。
于是小亮测自己实验后锥形瓶内溶液的pH,pH=6.2,则小亮的结果比小军的_______(选填“偏大”或“偏小”或“无影响”),原因是______。
8.某化学兴趣小组为了测定实验室用大理石和稀盐酸制备CO2后溶液的组成,取50g反应后的溶液,向其中加入10%的Na2CO3溶液,先出现气泡,后出现白色沉淀。
反应过程中加入Na2CO3溶液质量与生成的气体及沉淀质量关系如图。
(1)生成沉淀的质量是g。
(2)50g溶液中CaCl2的质量分数是?
(写出计算过程)
(3)X=。
(4)C点对应的溶液的溶质是(填化学式)。
9.73g10%的盐酸跟80g某浓度的氢氧化钠溶液恰好完全反应,将反应后的溶液蒸发掉108.8g水后,冷却到20℃时,溶液恰好达到饱和。
求:
(1)原氢氧化钠溶液中溶质的质量分数。
(2)20℃时,所得饱和溶液中溶质的质量分数。
(结果保留到1%)
10.电解法是工业上制铜的主要方法:
控制一定条件,电解硫酸铜溶液,析出的铜附着在阴极板上,化学方程式为:
2CuSO4+2H2O
2Cu↓+O2↑+2H2SO4。
取一定质量的硫酸铜溶液,在实验室中模拟工业条件进行电解,当析出12.8gCu时,得到384g硫酸铜质量分数为5%的溶液。
(注:
本题不考虑气体在溶液中的溶解)回答下列问题:
(1)反应后所得溶液中的溶质为(填化学式)。
(2)向电解后得到的溶液中加入一定量的某种物质,充分反应后,所得溶液的质量、溶质质量分数均与原硫酸铜溶液相同,则这种物质可能是下列物质中的(填选项编号)。
A.CuB.CuOC.Cu(OH)2
(3)求原硫酸铜溶液中溶质的质量分数(结果精确至0.1%)。
【参考答案】***试卷处理标记,请不要删除
一、初中化学计算题
1.A
解析:
(1)4.4
(2)反应后溶质为氯化钙,设生成氯化钙的质量为x,参加反应碳酸钙的质量为y
溶液的质量为:
120g-20g+10g-4.4g=105.6g
反应后的溶液中溶质质量分数为
答:
反应后的溶液中溶质质量分数为10.5%。
【分析】
溶质质量分数的计算。
【详解】
(1)由图分析的反应前A+B=240g,反应后A+B=20g+215.6g=235.6g,减少的质量为二氧化碳的质量,二氧化碳的质量为240g-235.6g=4.4g,故填:
4.4g;
(2)解析见答案。
【点睛】
固体和气体不算入溶液的质量。
2.A
解析:
(1)
;
(2)
;(3)200:
127;(4)68%;(5)17.8%;(6)110.16t
【分析】
氧化铝和稀盐酸反应生成氯化铝和水。
【详解】
(1)上述实验过程中发生反应是氧化铝和稀盐酸反应生成氯化铝和水,反应的化学方程式为
。
(2)第一次参加反应的氧化铝质量为
,第二次参加反应的氧化铝质量为
,300g稀盐酸完全反应,共消耗氧化铝的质量为
设300g稀盐酸中溶质质量为x
故300g稀盐酸中溶质质量(x)的比例式为
。
(3)稀盐酸溶液中溶质质量为
,需要质量分数为36.5%的浓盐酸的质量为
,36.5%的浓盐酸中水的质量为
,故最简整数比为
。
(4)第一次参加反应的氧化铝质量为
,第二次参加反应的氧化铝质量为
,第一次反应中稀盐酸过量,15g铝土矿中氧化铝完全反应,铝土矿中Al2O3的质量分数为
(5)设稀盐酸完全反应后,生成氯化铝的质量为y
若将最终所得溶液蒸发掉水20.4g,所得不饱和溶液中溶质的质量分数为
。
(6)该炼铝厂每天用上述铝土矿300t来生产生铝。
则理论上日产含镁46%的镁铝合金的质量为
。
【点睛】
3.C
解析:
碱NaCl、HCl95解:
设20g碳酸氢钠溶液中含碳酸氢钠的质量为x
x=0.084g
则一片胃药中含有的碳酸氢钠的质量为0.084g
=0.42g
答:
每片胃药中碳酸氢钠的质量0.42g。
【分析】
pH>7显碱性,pH=7显中性,pH<7显酸性;根据图可以看出没有加入盐酸时溶液pH大于8,说明碳酸氢钠溶液显碱性;消耗的盐酸的质量为10g时pH=7显中性,反应恰好完成。
【详解】
(1))当滴入稀盐酸质量为5g,pH>7显碱性;当滴入稀盐酸质量为15g,pH<7显酸性,此时溶液中溶质有盐酸和碳酸氢钠反应生成的氯化钠NaCl和过量的稀盐酸HCl;
用7.3%的稀盐酸和蒸馏水来配制100g溶质质量分数0.365%的稀盐酸,溶液稀释前后溶质质量不变,需要蒸馏水的质量为
,水的体积为95g÷1g/mL=95mL。
(2)见答案。
4.C
解析:
(1)2.2g
(2)88.3%
(3)NaCl、HCl
【详解】
(1)根据质量守恒定律,A点产生二氧化碳的质量为6g+36.5g-40.3g=2.2g。
(2)设试样中Na2CO3的质量为x。
x=5.3g
试样中Na2CO3的质量分数为:
×100%≈88.3%
答:
试样中碳酸钠的质量分数为88.3%。
(3)B点时盐酸过量,溶液中的溶质为HCl和生成的NaCl。
5.
(1)6.6
(2)解:
设稀盐酸溶质的质量分数为x
答:
稀盐酸溶质的质量分数为10.95%。
【详解】
(1)碳酸钙和稀盐酸反应生成二氧化碳气体,反应后总质量的减少就是生成二氧化碳的质量;第1次生成气体质量为20g+100g+50g-166.7g=3.3g;第2次生成气体质量为166.7g+50g-213.4g=3.3g;第3次生成气体质量为213.4g+50g-263.4g=0g;可知第1、2次盐酸恰好反应,消耗盐酸50g+50g=100g,反应共产生气体的质量为3.3g+3.3g=6.6g;第3次稀盐酸过量。
(2)见答案。
6.解:
分析表格数据可知,碳酸钙完全分解后生成二氧化碳的质量为:
12.5g-8.1g=4.4g
设珍珠粉中碳酸钙的质量分数为x
答:
珍珠粉中碳酸钙的质量分数为80%。
【详解】
12.5g样品最终剩余8.1g,根据化学方程式可知,减少的质量为生成的二氧化碳的质量,据此根据化学方程式可以计算出碳酸钙的质量分数。
7.H
解析:
12g13.5g22.5%偏大滴加的稀硫酸过量
【详解】
(1)由①叙述可知,所取烧碱溶液的质量为37.5g-25.5g=12g;
(2)由②叙述可知,反应所消耗的稀硫酸质量为51g-37.5g=13.5g;
(3)设烧碱溶液中氢氧化钠的质量为x。
x=2.7g
烧碱溶液的溶质质量分数为:
(4)问题讨论:
小亮做同样的实验得到的结果与小军的结果有差异。
于是小亮测自己实验后锥形瓶内溶液的pH,pH=6.2,则小亮的结果比小军的偏大,原因是滴加的稀硫酸过量,造成计算的氢氧化钠的质量偏大,而溶液的质量不变,故质量分数偏大。
8.C
解析:
(1)5;
(2)11.1%;(3)2.2g;(4)NaCl、Na2CO3
【详解】
(1)由生成的气体及沉淀质量关系图可知,实验室用大理石和稀盐酸制备CO2后溶液为稀盐酸与氯化钙的混合溶液,向其中加入10%的Na2CO3溶液,稀盐酸先与碳酸钠溶液反应生成氯化钠、水和二氧化碳,稀盐酸反应完,碳酸钠再与氯化钙溶液反应生成碳酸钙沉淀和氯化钠,生成沉淀的质量是5g;
(2)解:
设溶液中CaCl2质量为y
解得:
y=5.55g
CaCl2的质量分数=
答:
50g溶液中CaCl2的质量分数是11.1%;
(3)由图可知,53g10%的Na2CO3溶液恰好能与样品中的盐酸完全反应生成二氧化碳的质量为x,53g10%的Na2CO3溶液中溶质Na2CO3的质量=53g×10%=5.3g;
解:
设生成二氧化碳的质量为x,
解得:
x=2.2g
所以图中x的值为2.2g;
(4)稀盐酸先与碳酸钠溶液反应生成氯化钠、水和二氧化碳,然后碳酸钠与氯化钙溶液反应生成碳酸钙沉淀和氯化钠,b点是碳酸钠与氯化钙溶液恰好完全反应,b点对应的溶液的溶质是NaCl。
C点对应的溶液的溶质是NaCl、Na2CO3。
9.
(1)10%;
(2)26%
【详解】
解:
盐酸溶质的质量=
,设参加反应的氢氧化钠的质量为x,生成氯化钠的质量为y,
,
x=8g,y=11.7g
原氢氧化钠溶液中溶质的质量分数
20℃时,所得饱和溶液中溶质的质量分数
10.H
解析:
(1)H2SO4、CuSO4;
(2)B;(3)12.8%
【分析】
(1)据反应的化学方程式进行相关判断;
(2)根据质量守恒定律,使所得溶液的质量、溶质质量分数均与原硫酸铜溶液相同,需要保证反应前后溶液的质量不变;
(3)根据铜的质量结合化学方程式计算硫酸铜的质量,进一步计算原硫酸铜溶液中溶质的质量分数。
【详解】
(1)根据电解的反应方程式以及题干描述,反应后得到H2SO4和CuSO4的混合溶液,故答案为:
H2SO4、CuSO4;
(2)由反应方程式可知反应过程中溶液变化为每消耗1分子的硫酸铜,就少1个铜原子和1氧原子,所以使所得溶液的质量、溶质质量分数均与原硫酸铜溶液相同,需要每生成1分子的硫酸铜,增加1个铜原子和1氧原子;
A.铜与硫酸不反应,故A错误;
B.氧化铜与硫酸反应时,每生成1分子的硫酸铜,增加1个铜原子和1氧原子,故B正确;
C.氢氧化铜与硫酸反应时,每生成1分子的硫酸铜,增加1个铜原子和2个氧原子及2个氢原子,故C错误。
答案为B。
(3)设电解掉的CuSO4的质量为x;电解生成氧气的质量为y;
,解得:
x=32g,y=3.2g,
原硫酸铜溶液质量为:
384g十12.8g+3.2g=400g,
原溶液中硫酸铜的质量为:
32g+384g
5%=51.2g,
原溶液中硫酸铜的质量分数为:
,故答案为:
12.8%
【点睛】
计算硫酸铜的质量分数时,关键要算对溶液的质量和溶质的质量。