高考化学专题复习铝及其化合物.docx
《高考化学专题复习铝及其化合物.docx》由会员分享,可在线阅读,更多相关《高考化学专题复习铝及其化合物.docx(15页珍藏版)》请在冰豆网上搜索。
高考化学专题复习铝及其化合物
第三章金属及其化合物
第二节铝及其重要化合物
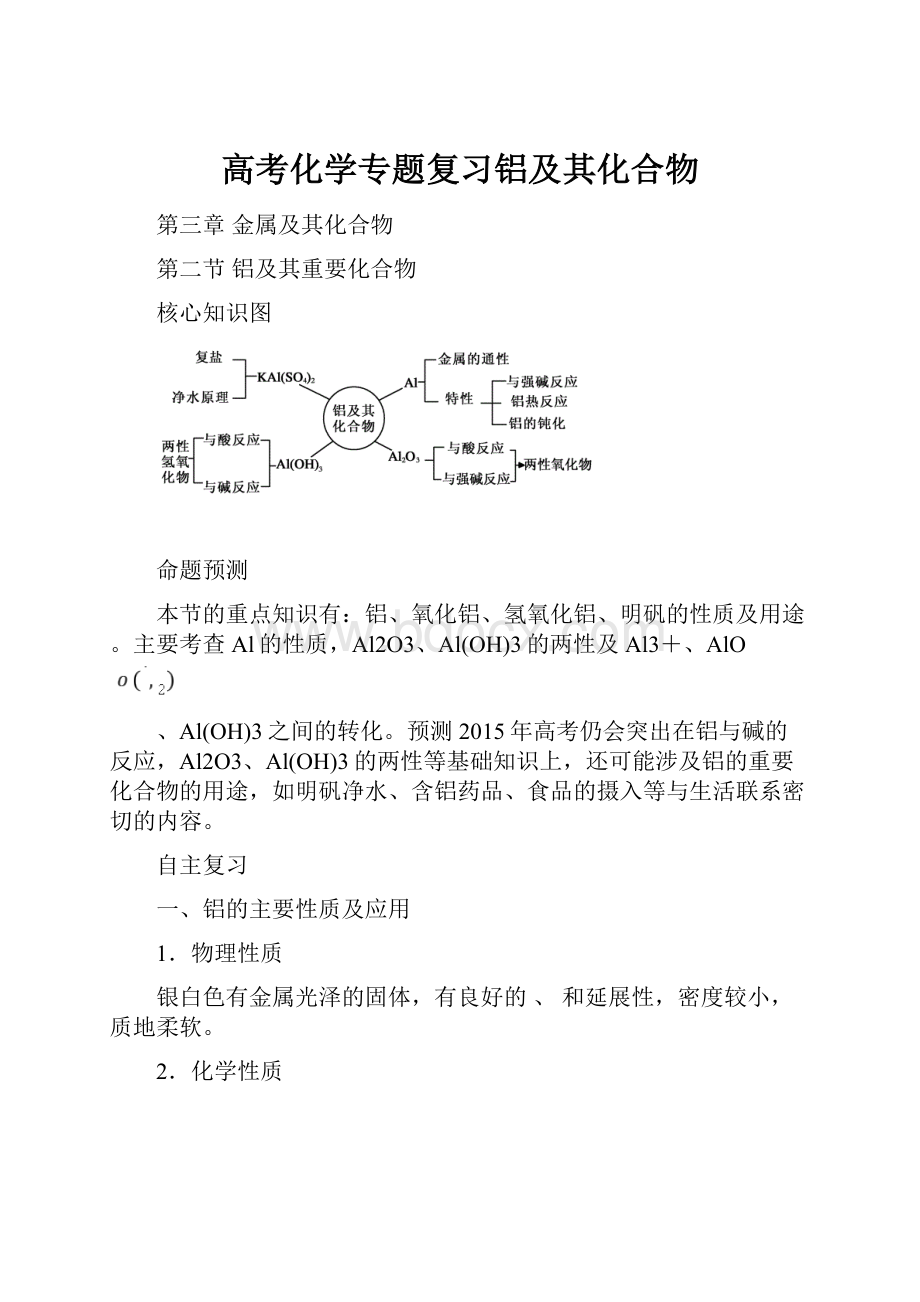
核心知识图
命题预测
本节的重点知识有:
铝、氧化铝、氢氧化铝、明矾的性质及用途。
主要考查Al的性质,Al2O3、Al(OH)3的两性及Al3+、AlO
、Al(OH)3之间的转化。
预测2015年高考仍会突出在铝与碱的反应,Al2O3、Al(OH)3的两性等基础知识上,还可能涉及铝的重要化合物的用途,如明矾净水、含铝药品、食品的摄入等与生活联系密切的内容。
自主复习
一、铝的主要性质及应用
1.物理性质
银白色有金属光泽的固体,有良好的、和延展性,密度较小,质地柔软。
2.化学性质
写出图中有关反应的化学方程式或离子方程式:
②
④
⑤
即时即练
1.铝分别与足量的盐酸和NaOH溶液反应,当放出的H2在同温同压下相等时,消耗的盐酸与NaOH的物质的量之比为( )
A.1:
1 B.2:
1
C.3:
1D.1:
3
2.镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图。
反应中镁和铝的( )
A.物质的量之比为3:
2
B.质量之比为3:
2
C.摩尔质量之比为2:
3
D.反应速率之比为2:
3
二、铝的重要化合物的主要性质及应用
1.氧化铝
(1)色固体,溶于水,具有很高的。
(2)化学性质(用离子方程式表示):
(3)用途:
是一种比较好的耐火材料,还可制作各种宝石。
2.氢氧化铝
(1)色胶状不溶于水的固体,有较强的性。
(2)化学性质:
写出图中有关反应的化学方程式或离子方程式:
①;
②;
③。
(3)制备:
①向铝盐溶液中加氨水,离子方程式为:
。
②向偏铝酸盐溶液中通入足量CO2,离子方程式为:
。
3.明矾净水原理
明矾的化学式为:
,其净水的原理涉及到的离子方程式表示为:
。
即时即练
铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,从铝土矿中提纯净Al2O3的工艺流程如下:
讨论回答下列问题:
(1)写出①、②中可能发生反应的离子方程式:
①_________________________________________________,
②_________________________________________________。
(2)步骤②中不用氨水沉淀Fe3+的原因:
_____________________________________________。
自主评估
1.镁、铝单质的化学性质以相似性为主,但也存在某些较大差异性,下列物质能用于证明二者存在较大差异性的是( )
①CO2 ②盐酸 ③NaOH溶液 ④水
A.①④B.②③
C.①③D.②③④
2.(2013·南昌一模)某溶液能与Al粉反应放出H2,该溶液中可能大量共存的离子组是( )
A.NH
、Ba2+、HCO
、Cl-
B.K+、Al3+、S2-、ClO-
C.Na+、Fe3+、Cl-、SO
D.NH
、Mg2+、SO
、NO
3.下列说法中正确的是( )
A.铝合金门窗及餐具坚固耐用,所以铝不活泼,不易与其他物质反应
B.铝不能与Fe3O4发生置换反应
C.铝片放入氢氧化钠溶液中的离子方程式Al+2OH-===AlO
+H2↑
D.可以用氢氧化钠溶液来除去铁粉中的铝粉
4.用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是( )
①加盐酸溶解;②加烧碱溶液溶解;③过滤;④通入过量CO2生成Al(OH)3沉淀;⑤加入盐酸生成Al(OH)3沉淀;⑥加入过量烧碱溶液
A.①⑥⑤③B.②③④③
C.②③⑤③D.①③⑤③
5.现代建筑门窗常用古铜色的硬铝制造,取硬铝样品进行如下实验(每一步所加试剂都是过量的)
由此可以推知,下列各组可能是硬铝组成的是( )
A.Al、Cu、Mg、SiB.Al、Mg、Si、Zn
C.Al、Fe、C、CuD.Al、Si、Zn、Na
6.某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。
下列说法正确的是( )
A.NaOH溶液可以用氨水来代替
B.溶液a中含有Al3+、K+、Cl-、Na+、OH-
C.溶液b中只含有NaCl
D.向溶液a中滴加盐酸需控制溶液的pH
7.易拉罐的主要成分为铝合金,其中以铝铁合金和铝镁合金最为常见。
现取几小块易拉罐碎片进行下列实验,其中实验方案与现象、结论正确的是( )
序号
实验方案
现象、结论
A
加入盐酸
产生无色气体,含铝、铁、镁三种元素
B
加入NaOH溶液
有无色气体产生,含有镁铝两种元素
C
加入盐酸后,所得溶液中再加入少量NaOH溶液
产生白色沉淀,含有镁元素
D
用盐酸溶解并放置一会儿后,加入KSCN溶液
溶液呈血红色,含有铁元素
8.A、B、C、D、E五种化合物均含有同一种短周期常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E易溶于水。
若取A溶液灼烧,焰色反应为紫色(透过蓝色钴玻璃片)。
(1)写出化学式:
A________,B________,C________,D________,E________。
(2)写出下列反应的离子方程式:
A→B:
____________________________________________________________________。
A→D:
_____________________________________________________________________。
课堂师生互动
考点1铝与酸、碱的反应及相关计算
【生之思】
1.等质量的铝分别与足量的盐酸和氢氧化钠溶液反应,产生的H2量哪种物质多?
2.等浓度、等体积的盐酸和NaOH溶液分别与足量的铝粉反应,哪种物质产生的H2多?
产生H2的体积比是多少?
3.相同质量的镁铝合金分别与足量的盐酸和NaOH溶液反应,哪种物质产生的H2多?
4.如何除去镁粉中的少量铝粉?
【师之导】
铝与酸、碱反应的定量关系
铝分别与盐酸、NaOH溶液反应的原理:
2Al+6HCl===2AlCl3+3H2↑,
2Al+2NaOH+2H2O===2NaAlO2+3H2↑。
(1)等量的铝与足量盐酸和足量氢氧化钠溶液反应,产生H2的体积比为
=
。
(2)足量铝分别与等物质的量的盐酸和氢氧化钠溶液反应,产生H2的体积比为
=
。
(3)一定量的铝分别与一定量的盐酸和NaOH溶液反应,若产生H2的体积比为
<
<
,则必定是:
铝与盐酸反应时,铝过量而盐酸不足;铝与NaOH溶液反应时,铝不足而NaOH溶液过量。
例题1甲、乙两烧杯中各盛有100mL3mol/L盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得甲、乙两烧杯中产生的气体体积之比为1:
2,则加入铝粉的质量为( )
A.5.4gB.3.6g
C.2.7gD.1.6g
【考点过关】
1.等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为56(相同条件下),则甲、乙两烧杯中的反应情况可能是( )
A.甲、乙中都是铝过量
B.甲中铝过量,乙中碱过量
C.甲中酸过量,乙中铝过量
D.甲中酸过量,乙中碱过量
2.将一定量的镁铝合金样品分成两等份,一份加入足量NaOH溶液中,充分反应后,收集到标准状况下气体6.72L;另一份加入到足量稀盐酸中,充分反应后,收集到标准状况下气体11.2L。
则原合金样品中镁的质量为( )
A.4.8gB.6g
C.9.6gD.12g
考点2含铝化合物之间的转化及应用
【生之思】
1.仅用试管和胶头滴管能否区分AlCl3溶液和NaOH溶液?
2.如何分离Al2O3和Fe2O3的混合物?
3.以AlCl3溶液为原料制备Al(OH)3,用NaOH溶液好还是用氨水好?
4.既能与盐酸反应,又能与NaOH溶液反应的物质有哪些?
【师之导】
1.Al3+、Al(OH)3、AlO
之间的转化
2.应用
(1)判断离子共存:
Al3+只能存在于强酸性溶液中,不能与显碱性的物质大量共存,AlO
只能存在于强碱性溶液中,不能与显酸性的物质大量共存,所以Al3+与AlO
不能大量共存。
(2)鉴别(利用滴加顺序不同,现象不同):
AlCl3溶液中滴加NaOH溶液现象为:
先生成白色沉淀,后沉淀溶解。
NaOH溶液中滴加AlCl3溶液现象为:
开始无明显现象,后产生白色沉淀,继续滴加沉淀不溶解。
(3)分离提纯:
①利用Al能溶于强碱溶液,分离Al与其他金属的混合物。
②利用Al2O3能与强碱反应,分离Al2O3与其他金属氧化物的混合物。
3.转化关系中的“量”
利用电荷守恒记忆,即:
(1)Al3+
Al(OH)3
AlO
,Al3+
余一个负电荷生成AlO
。
(2)AlO
恰好反应生成Al(OH)3
带3个正电荷Al3+,
AlO
余3个正电荷生成Al3+。
例题2下列各组物质,不能按
(“―→”表示反应一步完成)关系转化的是( )
选项
a
b
c
A
Al2O3
NaAlO2
Al(OH)3
B
AlCl3
Al(OH)3
NaAlO2
C
Al
Al(OH)3
Al2O3
D
MgCl2
Mg(OH)2
MgO
【考点过关】
3.向20mL1mol/L的Al2(SO4)3溶液中加入30mLKOH溶液,充分反应得到0.78g沉淀,则KOH溶液的物质的量浓度可能是( )
A.1mol/LB.3mol/L
C.5mol/LD.7mol/L
4.(2013·广东江门市调研题)相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱的量最多的是( )
A.AlB.Al(OH)3
C.AlCl3D.Al2O3
学科素养提升
数学结合思想在本节解题中的应用
以化学知识为载体,将化学问题抽象成数学问题,利用数学工具通过计算和推理,解决化学问题,是图像分析法的解题特点。
“镁、铝图像题”是接触到最多的图像题。
1.可溶性铝盐溶液与NaOH溶液反应的图像
2.偏铝酸盐溶液与盐酸反应的图像
操作
偏铝酸盐溶液中逐滴加入稀盐酸至过量
盐酸中逐滴加入偏铝酸盐溶液至过量
现象
立即产生白色沉淀→渐多→最多→渐少→消失
无沉淀(有但即溶)→出现沉淀→渐多→最多→沉淀不变
图像
3.向Mg2+与Al3+的酸性溶液中逐渐加入强碱溶液
4.图像题的解答要领
(1)转化过程中要遵循化学方程式中的化学计量数的对应关系。
(2)看清纵横坐标的含义,对图像进行全面分析。
(3)对于一些复杂问题可先分解后组合,进行图像的叠加工作;只有抓住一些关键点(最高点、最低点、转折点等)和变化趋势,才能顺利地解决图像问题。
典型例题把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(m)关系如图所示:
(1)混合物中NaOH的质量为____________,混合物中AlCl3的质量为____________,混合物中MgCl2的质量为________。
(2)P点表示盐酸的体积是________。
【过关训练】
1.(2012·云南省重点高中高三联考)某同学研究铝及其化合物的性质时设计了如下两个实验方案。
方案①:
2.7gAl
X溶液
Al(OH)3沉淀
方案②:
2.7gAl
Y溶液
Al(OH)3沉淀
NaOH和HCl的浓度均是3mol·L-1,如图是向X溶液和Y溶液中分别加入NaOH和HCl时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法不正确的是( )
A.a曲线表示的是向X溶液中加入NaOH溶液
B.在O点时两方案中所得溶液浓度相等且都显碱性
C.a、b曲线表示的反应都是非氧化还原反应
D.X溶液显酸性,Y溶液显碱性
2.将Na2O2逐渐加入到含有Al3+、Mg2+、NH
的混合液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如图所示,则原混合液中Al3+、Mg2+、NH
的物质的量分别是( )
A.2mol、3mol、8molB.3mol、2mol、8mol
C.2mol、3mol、4molD.3mol、2mol、4mol