专题二化学平衡等反应原理.docx
《专题二化学平衡等反应原理.docx》由会员分享,可在线阅读,更多相关《专题二化学平衡等反应原理.docx(20页珍藏版)》请在冰豆网上搜索。
专题二化学平衡等反应原理
专题二:
化学平衡等反应原理
【例题1】2009年广东卷20.
甲酸甲酯水解反应方程式为:
HCOOCH3(l)+H2O(l)HCOOH(l)+CH3OH(l)△H>0
某小组通过试验研究该反应(反应过程中体积变化忽略不计)。
反应体系中各组分的起始量如下表①:
组分
HCOOCH3
H2O
HCOOH
CH3OH
物质的量/mol
1.00
1.99
0.01
0.52
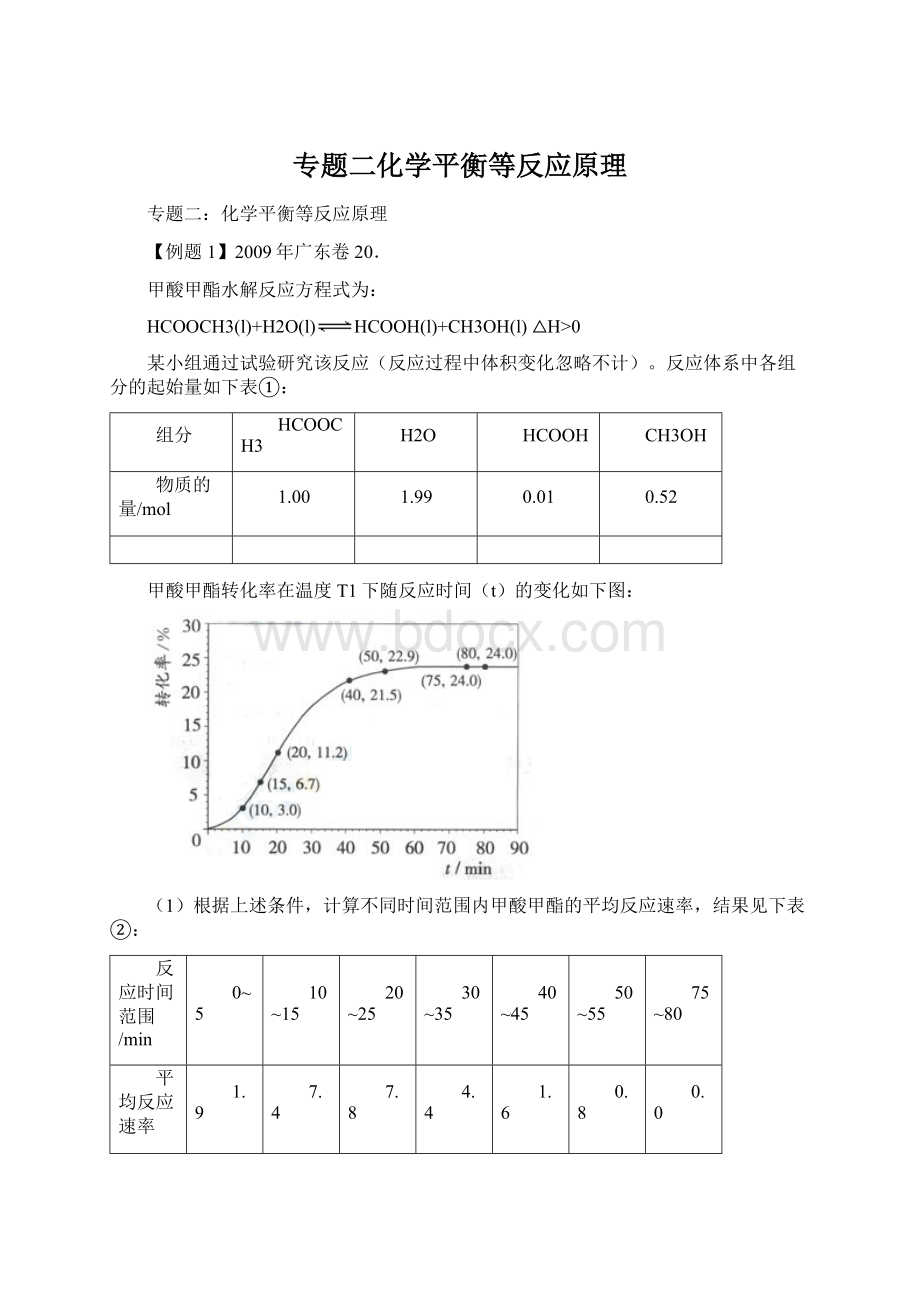
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:
(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表②:
反应时间范围/min
0~5
10~15
20~25
30~35
40~45
50~55
75~80
平均反应速率
/(10-3mol·min-1)
1.9
7.4
7.8
4.4
1.6
0.8
0.0
请计算15-20min范围内甲酸甲酯的减少量为mol,甲酸甲酯的平均反应速率为mol·min-1(不要求写出计算过程)。
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因:
。
(3)上述反应的平衡常数表达式为:
,则该反应在温度T1下的K值为。
(4)其他条件不变,仅改变温度为T2(T2大于T1),在上图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
【分析】
本题作为广东高考化学平衡原理的考查方式具有鲜明的代表性:
①重点考查学生对化学反应速率概念、化学平衡的了解,及其外在影响因素(如浓度、温度等)的规律认识和理解;②考查学生对化学平衡常数简单计算的能力;③考查学生获取图表信息的能力(包括对图表的观察、分析能力以及对图表中实验数据的处理能力)、知识迁移运用能力、绘制结果示意图的能力及文字表达能力。
第
(1)小题考查重点是化学反应速率及其计算;图表分析运用与数据处理能力。
先看懂图像横纵坐标的含义,再根据两个坐标点的数据(15,6.7)和(20,11.2)知道在15-20min这5分钟内甲酸甲酯的转化率从6.7%升高到11.2%,结合甲酸甲酯的起始量(1.00mol)即可计算出甲酸甲酯的减少量:
1.00mol×(11.2%-6.7%)=0.045mol
计算15-20min范围内甲酸甲酯的平均反应速率,一般的常规思维:
根据第1问在图像中求算的15-20min内甲酸甲酯的减少量,再结合速率公式v==求算出甲酸甲酯的平均反应速率,但是题目中没有体积V的数据。
(那应该怎么办?
)再次仔细审题“甲酸甲酯的平均反应速率为mol·min-1”,题目要求的速率单位中没有体积因素,因此速率公式v===0.009mol·min-1。
思考:
另外有同学根据题目中“表②”的数据:
反应时间范围/min
0~5
10~15
15~20
20~25
30~35
40~45
50~55
75~80
平均反应速率
/(10-3mol·min-1)
1.9
7.4
?
7.8
4.4
1.6
0.8
0.0
认为表格中的速率变化存在等差数列关系:
从10~15min为7.4×10-3mol·min-1,20~25min为7.8×10-3mol·min-1,推测15~20min为7.6×10-3mol·min-1。
请问该同学的推断是否合理?
如果不正确,请指出他的问题出在哪里。
第
(2)小题考查重点是化学反应速率影响因素及其影响下的变化规律。
将问题分解:
①“反应速率在不同阶段的变化规律”,②“产生该变化规律的原因”。
(作为文字表达的题目,分析清晰题目作答的角度,遵循“踩点得分”的意识很重要。
)
思考问题答案的方向在哪?
——图像还是表格数据?
反应时间范围/min
0~5
10~15
15~20
20~25
30~35
40~45
50~55
75~80
平均反应速率
/(10-3mol·min-1)
1.9
7.4
9.0
7.8
4.4
1.6
0.8
0.0
如果从“表格”入手应该存在“小→大→小”的变化规律,即该反应过程分为三个阶段:
反应初期、反应中期、反应后期。
如果从“图像”入手,体现速率的因素是“曲线的斜率”,斜率的变化规律是:
“斜率小→斜率大→斜率小”。
原因怎么解释?
情景是陌生的,甚至有些异常。
越是这样越要冷静下来,回归最基本的工具——反应速率理论,一定是浓度、温度、压强、催化剂、接触面积等造成的。
然后我们开始思考:
问题1:
外界条件时刻都在影响着反应速率,什么情况下才会出现反应速率中途加快呢?
反应物浓度从一开始就是减小的趋势,若反应器大小不发生变化,又没有中途增加反应物的话,浓度不可能造成反应速率中途增大;温度是有可能的,如果反应本身放热会导致体系温度升高,使反应速率增大;压强的影响本质上是浓度的影响,而且对非气态体系可以不考虑;催化剂的作用也是有可能的,我们接触过反应产物本身有催化作用的情形(如酸性高锰酸钾溶液与草酸的反应)。
对于接触面积,反应开始后一般不会显著变化,个别情况也有(如未打磨的金属片表面的覆盖物)。
结合本题,只可能是催化剂的作用。
问题2:
起催化作用的物质是生成物,而生成物有两种,起催化作用的是谁?
组分
HCOOCH3
H2O
HCOOH
CH3OH
物质的量/mol
1.00
1.99
0.01
0.52
催化剂需要与反应物充分接触才可能起作用,所以催化剂的量当然会影响催化作用。
反应体系中HCOOH和CH3OH的起始量存在显著差异,基本可以推断HCOOH才是催化剂,因为催化作用是在反应进行了一段时间后才体现的。
当然我们学过有机化学反应中酯一般是在酸性或碱性条件下水解,这样或许较容易联想到HCOOH起催化作用。
知识卡片:
自催化反应
反应产物对反应速率有加快作用的反应称为自催化反应。
在自催化反应中,反应速率既受反应物浓度的影响,又受反应产物浓度的影响。
自催化作用的特点是:
1.反应开始进行得很慢(称诱导期),随着起催化作用的产物的积累反应速度迅速加快,而后因反应物的消耗反应速度下降;2.自催化反应必须加入微量产物才能启动;3.自催化反应必然会有一个最大反应速率出现。
组织答案时,一般应将前提条件、前因后果表述清楚,其中的化学原理分析做到用词准确、书写规范。
本小题参考答案:
该反应中甲酸具有催化作用。
①反应初期:
虽然甲酸甲酯量较大,但甲酸量很小,催化效果不明显,反应速率较慢;
②反应中期:
甲酸量逐渐增多,催化效果显著,反应速率明显增大;
③反应后期:
甲酸量增加到一定程度后,浓度对反应速率的影响成为主导因素,特别是逆反应速率的增大,使总反应速率减小,直至为零。
第(3)小题考查重点是化学平衡常数的计算。
求算化学平衡常数的一般步骤是:
写出化学平衡常数的表达式,根据“三段式”求出平衡状态下各物质的物质的量浓度,代入表达式计算。
切记要选取已达平衡状态的数据。
HCOOCH3(l)+H2O(l)HCOOH(l)+CH3OH(l)
起始(mol)1.001.990.010.52
变化(mol)0.240.240.240.24
(0.25/V)•(0.76/V)
平衡(mol)0.761.750.250.76
(0.76/V)•(1.75/V)
==0.14
第(4)小题考查重点是温度对化学平衡建立的过程和最终平衡状态的影响;运用图形的表达能力。
用图像表达时,要慎重考虑:
何处起点?
趋势走向?
何处拐点?
何处终点?
文字标注是否清晰?
(这些要素都包含重要的化学信息)
起点的含义是反应刚开始,不论反应条件有何差异反应物的转化率都是从0开始;反应一旦开始立刻就有了快慢问题,且反应初段不同温度的体系中各物质的浓度仍然是很接近的,催化剂的影响也不会有显著区别,所以温度是影响反应初段曲线走势的最主要因素;反应进程的中后期,影响因素就比较多了,此时应该准确定位曲线的终点(平衡转化率的关系),以便使整个曲线的趋势不会有太大偏差。
【反思】
在上述例题的解答过程中,哪些思路和技能是在其他试题中应继续坚持的?
【拓展】(2007年广东卷改)
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:
2SO2(g)+O2(g)2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。
计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有(填字母)
A升高温度B降低温度C增大压强
D减小压强E加入催化剂F移出氧气
(3)反应:
2SO2(g)+O2(g)2SO3(g)△H<0SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图。
(4)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。
酸溶过程中需保持溶液足够酸性,其原因是____
______________________________________________________________________________。
答案:
(1)解:
2SO2(g)+O2(g)2SO3(g)
起始浓度/mol·L-10.0500.0300
平衡浓度/mol·L-1(0.050-0.040)(0.030-0.040/2)0.040
=0.010=0.010
所以,K===1.6×103mol·L-1。
(SO2)=×100%=80%。
归纳:
①由“三段式”求出变化的物质的量和各物质在平衡状态下的物质的量浓度,②求出平衡转化率,③写出的表达式,代入数值求出K值的结果。
(2)B、C。
(3)
(4)Fe2+、Fe3+在溶液中存在水解,Fe2++2H2OFe(OH)2+2H+,Fe3++3H2OFe(OH)3+3H+,保持溶液足够酸性可抑制Fe2+、Fe3+的水解,并能防止Fe2+被氧化成Fe3+。
【例题2】化学平衡的调控在生活、生产和科学研究领域中具有重要作用。
Ⅰ.硅酸钠水溶液俗称水玻璃,是制备硅胶和木材防火材剂等的原料。
(1)取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。
写出实验现象并给予解释。
Ⅱ.羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,3种钙盐的溶解度随溶液pH的变化如下图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(2)图中所示3种钙盐在人体中最稳定的存在形式是_______________________(填化学式),
理由是:
___________。
(3)糖黏附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。
结合化学平衡移动原理,分析其原因
。
Ⅲ.
(4)硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是
A.两个不同温度中,363K时Ksp(SrSO4)较小
B.在283K时,向SrSO4的浊液中逐滴加入1.0mol/LNa2SO4溶液,Ksp(SrSO4)随
c(SO42-)的增大而减小
C.向b点的溶液中加