初三化学酸和碱的中和反应提高达标检测卷.docx
《初三化学酸和碱的中和反应提高达标检测卷.docx》由会员分享,可在线阅读,更多相关《初三化学酸和碱的中和反应提高达标检测卷.docx(20页珍藏版)》请在冰豆网上搜索。
初三化学酸和碱的中和反应提高达标检测卷
初三化学酸和碱的中和反应提高达标检测卷
一、初中化学酸和碱的中和反应选择题
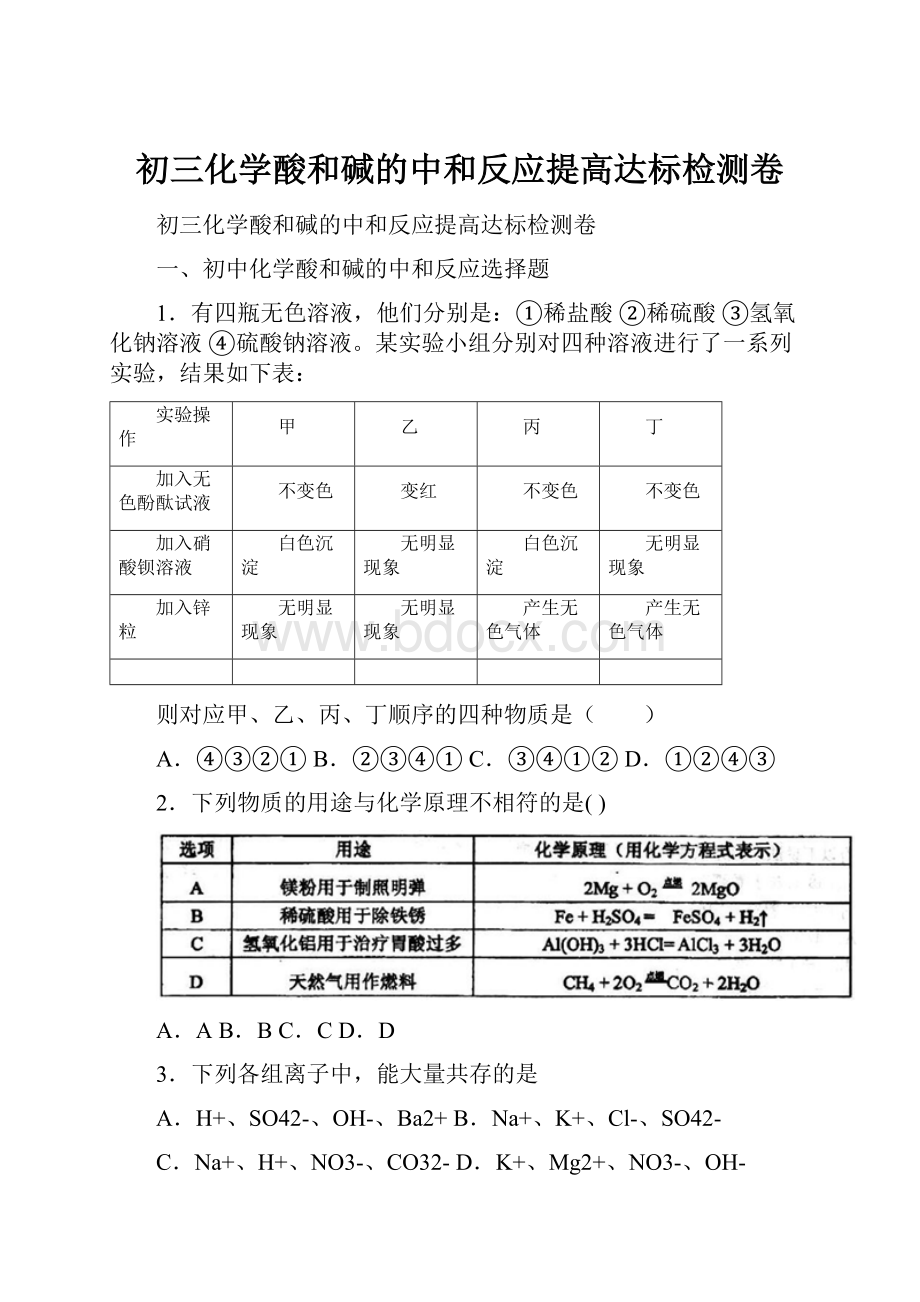
1.有四瓶无色溶液,他们分别是:
①稀盐酸②稀硫酸③氢氧化钠溶液④硫酸钠溶液。
某实验小组分别对四种溶液进行了一系列实验,结果如下表:
实验操作
甲
乙
丙
丁
加入无色酚酞试液
不变色
变红
不变色
不变色
加入硝酸钡溶液
白色沉淀
无明显现象
白色沉淀
无明显现象
加入锌粒
无明显现象
无明显现象
产生无色气体
产生无色气体
则对应甲、乙、丙、丁顺序的四种物质是( )
A.④③②①B.②③④①C.③④①②D.①②④③
2.下列物质的用途与化学原理不相符的是()
A.AB.BC.CD.D
3.下列各组离子中,能大量共存的是
A.H+、SO42-、OH-、Ba2+B.Na+、K+、Cl-、SO42-
C.Na+、H+、NO3-、CO32-D.K+、Mg2+、NO3-、OH-
4.氯气用于自来水的消毒和杀菌,其与水的反应式为:
Cl2+H2O→HCl+HClO请选择一种试剂来证明某瓶水是蒸馏水还是自来水:
A.酚酞试液B.氯化钡溶液
C.氢氧化钠溶液D.硝酸银溶液
5.推理是化学学习的一种方法,以下推理正确的是()
A.单质中只含有一种元素,因此只含有一种元素的物质一定是单质
B.碱性溶液能使酚酞试液变红色,因此能使酚酞试液变红色的溶液的pH一定大于7
C.在化合物里,正负化合价的代数和为零,所以在同一化合物中金属元素显正价,则非金属元素一定显负价
D.稀有气体元素的原子最外层电子数为8(氦除外),因此微粒
一定是稀有气体元素的原子
6.下列物质加入到石灰水中,有白色沉淀产生的是
A.纯碱B.盐酸C.氯化钠D.硫酸铜
7.夏日炎炎,蚊虫猖獗。
蚊虫叮咬后会在皮肤中释放蚁酸,蚁酸又名“乙酸”,具有一定的腐蚀性,会刺激皮肤红肿起泡。
为缓解症状,适合涂抹的物质是
A.食醋B.柠檬汁C.氢氧化钠溶液D.肥皂水
8.业制镁的方法为:
将含碳酸钙的贝壳制成石灰乳;在海水(含氯化镁)中加入石灰乳,过滤;在氢氧化镁中加入盐酸,结晶;电解熔融氯化镁得到镁。
该方法中涉及的化学反应不包括
A.分解反应B.化合反应C.置换反应D.复分解反应
9.逻辑推理是学好化学的重要思维方法,下面是从小明同学学习笔记中摘录出来的一些推理,你认为正确的一句是
A.同种元素的原子具有相同质子数,所以具有相同质子数的两种粒子一定是同种元素
B.由同种分子构成的物质是纯净物,所以纯净物一定由同种分子构成
C.中和反应生成了盐和水,所以能生成盐和水的反应一定是中和反应
D.金属活动性强的金属能将较弱的金属从其化合物溶液中置换出来,金属铁能与硫酸铜溶液反应,所以铁的活动性强于铜的活动性
10.如图是碳和碳的化合物的转化关系:
C
CO2→H2CO3
CaCO3
CO2
其各步转化的基本反应类型从左到右依次是()
A.化合、分解、置换、复分解B.置换、化合、复分解、分解
C.复分解、化合、分解、置换D.分解、置换、化合、复分解
11.下列有关pH的说法正确的是( )
A.pH的大小与一定量溶液中所含H+或OH﹣的数量有关
B.向氢氧化钠溶液中加水后,溶液的pH增大
C.用pH试纸测得某酸性溶液pH为3.4
D.用NaOH改良pH小于7的土壤,有利于某些农作物的生长
12.下列反应中属于中和反应的是( )
A.Zn+2HCl═ZnCl2+H2↑B.AgNO3+HCl═AgCl↓+HNO3
C.Mg(OH)2+2HCl═MgCl2+2H2OD.2NaOH+SO3═Na2SO4+H2O
13.下列各组离子在溶液中可以大量共存且能形成无色溶液的是
A.Na+、H+、SO42-、Cl-B.NH4+、K+、OH-、NO3-
C.H+、Ba2+、SO42-、NO3-D.Fe3+、H+、SO42-、Cl-
14.建立宏观和微观之间的联系是一种科学的思维方式。
下列解释不正确的是
A.金刚石、石墨物理性质存在明显差异的原因是它们的原子排列方式不同
B.警用缉毒犬能根据气味发现毒品,是因为分子在不断运动
C.压瘪的乒乓球放入热水中重新鼓起,是因为球内的气体分子体积增大
D.酸有一些相似的性质,是因为在不同的酸溶液中都含有H+
15.食醋中含有醋酸,下列使用食醋肯定不能达到目的是( )
A.除去水壶壁上的水垢
B.加入紫色石蕊溶液,溶液变红
C.除去菜刀上的铁锈
D.鉴别黄金饰品中是否含有铜
16.下列各组离子能在pH=3的溶液中大量共存的是
A.NH4+、Na+、NO3-、CO32-B.NO3-、Cu2+、SO42-、OH-
C.Mg2+、K+、SO42-、Cl-D.Ca2+、Na+、HCO3-、Cl-
17.“微观—宏观—符号”三重表征是化学独特的表示物质及其变化的方法。
如图是金属钠投入水中所发生反应的微观示意图,以下解释或说法不正确的是
A.该反应属于置换反应
B.钠原子在该反应过程中得到电子
C.该反应前后元素的种类没有发生变化
D.反应后的溶液呈碱性,因为溶液中存在OH-
18.稀盐酸和滴有酚酞溶液的氢氧化钠溶液发生反应时,溶液的变化如图所示。
下列有关该实验的说法不正确的是( )
A.B点表示稀盐酸和氢氧化钠溶液恰好完全反应
B.该实验是将稀盐酸滴入氢氧化钠溶液中
C.B点和C点时,溶液均呈现无色
D.C点时,溶液中只含有一种溶质
19.推理是学习中常用的思维方法,下列推理正确的是( )
A.某物质燃烧生成CO2和H2O,则该物质的组成中一定含有碳、氢、氧元素
B.通过小磁针静止时S极的指向能够判断磁场中某点的磁场方向
C.将玻璃罩内的空气逐渐抽出,听到铃声逐渐变小,由此推理得出真空不能传声
D.中和反应能生成盐和水,则生成盐和水的反应一定是中和反应
20.分类是学习化学的方法之一,下列物质按单质、盐、混合物的顺序排列的是( )
A.氮气、硫酸钠、空气
B.红磷、碳酸钙、冰水混合物
C.黄铜、苏打、牛奶
D.氢气、石油、熟石灰
21.下列各组物质中,能发生复分解反应且反应前后溶液总质量变小的是( )
A.铁和硫酸铜溶液
B.氢氧化钠溶液和盐酸
C.稀硫酸和氯化钡溶液
D.碳酸钠溶液和氯化钾溶液
22.类推是常用的思维方法。
以下类推正确的是( )
A.离子是带电荷的粒子,所以带电荷的粒子一定是离子
B.有机物都含碳元素,所以含碳元素的化合物一定是有机物
C.中和反应生成盐和水,所以生成盐和水的反应一定是中和反应
D.单质由同种元素组成,所以由同种元素组成的纯净物一定是单质
23.下列各组离子在水中一定能大量共存,并形成无色溶液的是( )
A.A13+、Na+、Cl-、NO3-B.Cu2+、H+、SO42-、Cl-
C.K+、Ca2+,OH-、CO32-D.Na+、H+、CO32-、OH-
24.下列物质能使紫色石蕊溶液变蓝的是( )
A.CO2B.SO2C.NH3D.NO2
25.在托盘天平两边各放一只等质量的烧杯,调节至平衡。
在两只烧杯里分别放入同体积、同质量分数的稀盐酸然后向左右两烧杯中分别加入质量相等的碳酸钙粉末和M粉末。
左盘烧杯中稀盐酸和碳酸钙粉末均恰好完全反应,反应停止后,天平仍然保持平衡。
则托盘天平右盘烧杯中加入的M粉末可能是()
A.碳酸氢钠B.氢氧化钙C.碳酸镁D.氧化铝
26.下列物质在敞口容器中放置一段时间后,质量增加并有新物质产生的是( )
A.浓硫酸B.苛性钠固体C.浓盐酸D.碳酸钠晶体
27.能在pH=11的溶液中大量共存,且溶液为无色透明的一组物质是( )
A.AlCl3、CuSO4、NaClB.BaCl2、NaCl、NaOH
C.CaCl2、Na2CO3、AgNO3D.K2SO4、NaNO3、NH4Cl
28.下列各组物质是按混合物、单质、氧化物的顺序排列的是
A.水、氮气、氢氧化钠B.冰水混合物、镁条、干冰
C.空气、氧气、水D.石油、铜、碳酸钙
29.下列化学反应属于复分解反应是( )
A.CH4+2O2
CO2+2H2OB.3Fe+2O2
Fe3O4
C.NaOH+HCl═NaCl+H2OD.H2CO3═CO2↑+H2O
30.某电镀厂排出的废水中含有较多的硫酸铜(CuSO4)。
若要从硫酸铜中获得金属铜,以减少废水对环境的污染,可选择下列物质中的
A.稀盐酸B.氢氧化钠C.铁粉D.银粉
【参考答案】***试卷处理标记,请不要删除
一、初中化学酸和碱的中和反应选择题
1.A
【解析】
【详解】
分别加入无色酚酞试液后,稀盐酸、稀硫酸、硫酸钠溶液分别显酸性、酸性、中性,不能使酚酞溶液变色,氢氧化钠溶液显碱性,能使无色酚酞溶液变红色,所以乙是氢氧化钠溶液;硫酸、硫酸钠能与硝酸钡溶液反应生成白色沉淀,且稀硫酸能与锌反应生成气体,硫酸钠与锌不能反应,则甲是硫酸钠溶液,丙是稀硫酸,丁是稀盐酸,则对应甲、乙、丙、丁顺序的四种物质是④③②①,故选A。
2.B
【解析】可根据各物质的成分及化学性质,对比用途进行分析比较,铁锈主要成分是氧化铁。
解:
A、镁燃烧发出发出耀眼的白光可用于制照明弹。
正确;
B、铁锈成分是三氧化二铁,反应原理为:
2Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;不正确;
C、胃酸的主要成分是盐酸,氢氧化铝可用于治疗胃酸过多。
正确;
D、甲烷燃烧放出大量的热量,所以可以用来做燃料。
正确。
故选B。
点睛:
物质性质与用途的关系,性质决定用途。
3.B
【解析】共存就是物质间不能结合生成沉淀、水、气体。
A中氢离子和氢氧根离子结合生成水,硫酸根离子和钡离子结合生成硫酸钡沉淀;B、四种离子间都不会结合生成沉淀、水、气体。
C氢离子和碳酸根离子结合生成水和二氧化碳气体;D镁离子和氢氧根离子结合生成氢氧化镁沉淀。
选B
4.D
【解析】氯气用于自来水的消毒和杀菌,其与水的反应式为:
Cl2+H2O→HCl+HClO,所以自来水中有盐酸,
酚酞试液在酸性溶液中和中性溶液中都不变色;氯化钡和盐酸不反应;氢氧化钠和盐酸反应,但无明显现象;硝酸银和盐酸反应生成氯化银白色沉淀。
选D
5.B
【解析】试题分析:
A、含有一种元素的纯净物是单质,物质不一定是纯净物,错误;B、酚酞遇碱性溶液变红,使酚酞溶液变红的是碱性溶液,正确;C、NaClO中Cl元素的化合价是+1,错误;D、核外有10个电子的微粒也可能是离子,错误。
故选B
考点:
规律的推理
视频
6.A
【解析】石灰水的主要成分是氢氧化钙,
A、纯碱是碳酸钠的俗称,碳酸钠与氢氧化钙反应生成碳酸钙白色沉淀,故正确;
B、盐酸与氢氧化钙反应生成氯化钙和水,无现象,故错误;
C、氯化钠与氢氧化钙不反应,无现象,故错误;
D、硫酸铜与与氢氧化钙反应生成硫酸钙和氢氧化铜蓝色沉淀,故错误。
7.D
【解析】
乙酸是一种酸性物质,为缓解疼痛,需要用碱性物质来中和。
A、食醋呈酸性,不符合题意;B、柠檬酸呈酸性,不符合题意;C、虽然氢氧化钠溶液呈碱性,但是氢氧化钠溶液有腐蚀性,不符合题意;D、肥皂水呈碱性,且无腐蚀性,符合题意。
故选D。
8.C
【解析】
①把贝壳制成石灰乳的方程式:
CaCO3
CaO+CO2↑;CaO+H2O=Ca(OH)2;涉及的反应有分解、化合;
②在引入的海水中加入石灰乳,方程式是:
MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2,发生了复分解反应;
③将沉淀物与盐酸反应,方程式是:
Mg(OH)2+2HCl═MgCl2+2H2O,发生了复分解反应;
④电解熔融氯化镁,得到金属镁,方程式是:
MgCl2
Mg+Cl2↑为分解反应;
没有涉及的反应为置换反应。
9.D
【解析】A、由元素的定义可知,质子数相同的粒子一定不一定属于同种元素,例如,水分子与铵根离子质子数相同但不是同种元素,要说明的是同种元素须指明是原子做前提,错误;B、由同种分子构成的物质是纯净物,纯净物不一定由同种分子构成,例如,铁是由同种原子构成的纯净物,错误;C、中和反应生成了盐和水,但能生成盐和水的反应一定是中和反应,如二氧化碳与氢氧化钙溶液的反应,错误;D、金属活动性强的金属能将较弱的金属从其化合物溶液中置换出来,金属铁能与硫酸铜溶液反应,所以铁的活动性强于铜的活动性,正确。
点睛:
逻辑推理是一种科学的学习方法,但应注意推理的合理性、正确性。
解决这类题可从找反例入手。
10.B
【解析】根据所学知识和题中信息知,其各步转化的基本反应类型从左到右依次是碳和氧化铜反应生成铜和二氧化碳,属于置换反应;二氧化碳和水反应生成碳酸,属于化合反应;碳酸和氢氧化钙反应生成碳酸钙白色沉淀和水,属于复分解反应;碳酸钙高温分解生成氧化钙和二氧化碳,属于分解反应。
故选B。
点睛∶化学反应基本反应类型包括化合反应,分解反应,置换反应和复分解反应。
11.A
【解析】
【详解】
A、pH的大小与一定量溶液中所含H+或OH﹣的数量有关,说法正确;B、向氢氧化钠溶液中加水后,氢氧化钠溶液被稀释,浓度减小,pH减小,说法错误;C、pH试纸只能精确到整数,不能精确到小数点后一位,说法错误;D、一般使用熟石灰改良酸性土壤,而不是使用氢氧化钠,说法错误。
故选A。
12.C
【解析】
A、Zn+2HCl═ZnCl2+H2↑,金属与酸的反应,属于置换反应,不属于中和反应,故选项错误.
B、AgNO3+HCl═AgCl↓+HNO3,是酸与盐的反应,不是酸与碱的反应,不属于中和反应,故选项错误.
C、Mg(OH)2+2HCl═MgCl2+2H2O,反应物是酸和碱,生成物是盐和水,属于中和反应,故选项正确.
D、2NaOH+SO3═Na2SO4+H2O,是非金属氧化物与碱的反应,不是酸与碱的反应,不属于中和反应,故选项错误.故选C.
【点评】本题难度不大,掌握中和反应的特征(反应物是酸和碱,生成物是盐和水)是正确解答此类题的关键.
13.A
【解析】A.因该组离子之间不反应,则能够大量共存,并且没有有色离子,故A正确;
B.因NH4+、OH-能结合生成氨气和水,则不能共存,故B错误;
C.因Ba2+、SO42-能结合生成硫酸钡沉淀,则不能共存,故C错误;
D.因Fe3+溶液为黄色,故D正确。
点睛:
离子或物质的共存问题就是指当不同的离子或物质存在于同一溶液中时,如果不能相互结合生成沉淀或气体或水等特殊物质,则说明它们是能够共存的;例如,氢氧化钠和硝酸钾在同一溶液中是能够共存的。
如果能够相互结合生成沉淀或气体或水等特殊物质的话,则说明它们是不能够共存的;例如,氢氧化钠和稀盐酸在同一溶液中是不能够共存的(因为其中的氢氧离子和氢离子能够相互结合生成水)。
14.C
【解析】
试题分析:
压瘪的乒乓球放入热水中重新鼓起,不是因为球内的气体分子体积增大,而是分子之间的间隔变大。
故选C.
考点:
分子的性质
15.D
【解析】
【详解】
A、水垢的主要成分是碳酸钙,能与醋酸反应,使用食醋能达到除去水垢的目的,选项正确;
B、食醋显酸性,能使紫色石蕊溶液变红,选项正确;
C、铁锈的主要成分是氧化铁,能与醋酸反应,使用食醋能达到除锈的目的,选项正确;
D、铜位于金属活动性顺序表中氢的后面,不能与醋酸反应,使用食醋不能达到目的,选项错误,故选D。
16.C
【解析】pH=3的溶液中含有氢离子。
A、CO32-能与H+结合产生二氧化碳气体和水,不能共存,错误;B、OH-能与H+结合产生水,Cu2+与OH-结合生成氢氧化铜的沉淀,不能共存,错误;C、四种离子相互间不能结合生成沉淀、气体和水,正确;D、HCO3-和H+能结合产生二氧化碳气体和水,不能大量共存,错误;故选C。
点睛:
离子间能结合生成沉淀、气体和水,则离子不能共存。
17.B
【解析】
【详解】
A、根据图示,该反应是钠和水反应生成氢氧化钠和氢气,属于置换反应,故正确;
B、钠离子带一个单位正电荷,由钠原子失去一个电子形成钠离子,故B错误;
C、根据质量守恒定律,化学反应前后元素种类不变,故正确;
D、反应后溶液中存在OH-,溶液呈碱性,正确。
18.D
【解析】
【分析】
A、根据B点时溶液的pH等于7,进行分析判断。
B、根据图象中pH值的变化是从大于7逐渐的减小到小于7,进行分析判断。
C、B点和C点时,溶液的pH分别等于7、小于7,进行分析判断。
D、根据C点时溶液的pH小于7,进行分析判断。
【详解】
A、B点时溶液的pH等于7,表示稀盐酸和氢氧化钠溶液恰好完全反应,故选项说法正确。
B、由图象可知,pH值是开始时大于7逐渐的减小到7然后小于7,可知原溶液显碱性,然后不断的加入酸性溶液,使pH减小,说明是把稀盐酸滴加到氢氧化钠溶液中,故选项说法正确。
C、B点和C点时,溶液的pH分别等于7、小于7,分别显中性、酸性,溶液均呈现无色,故选项说法正确。
D、C点时溶液的pH小于7,溶液显酸性,说明稀盐酸过量,所得溶液中的溶质为HCl和NaCl,故选项说法错误。
故选D。
【点睛】
本题难度不是很大,主要考查了中和反应及其应用,掌握溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应是正确解答本题的关键
19.C
【解析】
【分析】
质量守恒定律,反应前后元素种类不变,原子个数不变,原子种类不变,酸碱中和反应能生成盐和水。
【详解】
A.根据质量守恒定律,反应前后元素种类不变,某物质燃烧生成二氧化碳和水,反应物是该物质与氧气,生成物是二氧化碳和水,所以该物质中一定含有碳、氢元素,可能含氧元素,故A不正确;
B.通过小磁针静止时N极的指向能够判断磁场中某点的磁场方向,故B不正确;
C.将玻璃罩内的空气逐渐抽出,听到铃声逐渐变小,由此推理得出真空不能传声,故C正确;
D.酸碱中和反应能生成盐和水,生成盐和水的反应不一定是中和反应,如二氧化碳与氢氧化钠溶液反应,故D不正确。
故选C。
【点睛】
酸碱能发生中和反应生成盐和水,金属氧化物和酸,非金属氧化物和碱都能生成盐和水。
20.A
【解析】
【分析】
单质是由一种元素组成的纯净物;盐是由金属离子或铵根离子和酸根离子组成的化合物;混合物是由多种物质组成的。
【详解】
A、氮气属于单质;硫酸钠属于盐;空气中含有氧气、氮气等属于混合物,故A正确;
B、红磷属于单质,碳酸钙属于盐;冰水,只有水一种物质,属于纯净物,故B不正确;
C、黄铜属于合金,是混合物;苏打属于盐;牛奶属于混合物,故C不正确;
D、氢气属于单质;石油属于混合物;熟石灰属于碱,故D不正确。
故选A。
【点睛】
物质分为混合物和纯净物,纯净物包括单质和化合物。
21.C
【解析】
【分析】
根据反应前后溶液组成的改变,利用反应的化学方程式或质量守恒定律,对反应后所得溶液质量进行分析,判断所得溶液的质量比反应前溶液的总质量的大小关系。
【详解】
A、铁和硫酸铜溶液反应生成硫酸亚铁溶液和铜,反应的化学方程式为Fe+CuSO4═FeSO4+Cu,属于置换反应,故A不正确;
B、氢氧化钠溶液和盐酸反应生成氯化钠和水,但没有气体或沉淀生成,混合后溶液质量不变,故B不正确;
C、稀硫酸和氯化钡溶液生成硫酸钡沉淀和盐酸,属于复分解反应,由于生成了沉淀,则溶液的质量会减少,故C正确。
D、碳酸钠溶液和氯化钾溶液交换成分没有沉淀、气体或水生成,不反应,故D不正确;故选C。
【点睛】
物质间发生化学反应时溶液质量的变化,明确物质间的反应、溶解物质的质量与所析出物质的质量的差值是正确解题的关键,当析出质量大于所溶解质量时,所得溶液质量会小于反应前溶液。
22.D
【解析】
试题分析:
A、离子是带电的离子或原子团,但带电荷的粒子不一定是离子,如质子带电但不是离子;B、有机物是含有碳元素的化合物,但含碳元素的化合物一定是有机物,如一氧化碳、二氧化碳等;C、中和反应是酸与碱生成盐和水的反应,但生成盐和水的反应不一定是中和反应,如金属氧化物和酸的反应,生成盐和水,但不是中和反应;D、单质是同种元素组成的纯净物,所以单质由同种元素组成;
考点:
原子和离子的相互转化;中和反应及其应用;单质和化合物的判别;有机物与无机物的区别.
23.A
【解析】
【详解】
A、四种离子间不能结合成沉淀、气体或水,能大量共存,且不存在有色离子,故选项正确;
B、四种离子间不能结合成沉淀、气体或水,能大量共存,但Cu2+的水溶液呈蓝色,故选项错误;
C、Ca2+、CO32-两种离子能结合成碳酸钙沉淀,不能大量共存,故选项错误;
D、H+与CO32-、OH-,分别能结合成水和二氧化碳、水,不能大量共存,故选项错误
【点睛】
该题为离子共存题,遵循原则是“反应不共存,共存不反应”,解题思路是:
先读题干,找出题目限制的条件(如本题的无色溶液中有色离子不能存在),再看选项,各离子之间是否反应生成沉淀、气体、水
24.C
【解析】
【详解】
A.二氧化碳溶于水并与水反应生成碳酸,碳酸显酸性,能使紫色的石蕊试液变红色,故错误;
B.二氧化硫溶于水并与水反应生成亚硫酸,亚硫酸显酸性,能使紫色的石蕊试液变红色,故错误;
C.氨气溶于水并与水反应生成氨水,氨水显碱性,能使紫色的石蕊试液变蓝色,故正确;
D.二氧化氮溶于水并与水反应生成亚硝酸,亚硝酸显酸性,能使紫色的石蕊试液变红色,故错误。
故选:
C。
【点睛】
石蕊遇酸变红,遇碱变蓝。
25.C
【解析】
【详解】
根据题意可知天平要平衡,左右两盘减少的质量必须相等,这四个选项中的B氢氧化钙、D氧化铝与盐酸反应不会生成气体,A碳酸氢钠、C碳酸镁与盐酸反应都会生成二氧化碳,所以右盘加入的物质应从A和C中选。
已知左盘碳酸钙与盐酸恰好完全反应,假设两盘放入的固体质量都是100份质量,两盘放入的盐酸溶质的质量都是73份质量,根据上述数据可知左盘减少的二氧化碳是44份质量,而100份碳酸氢钠与73份盐酸反应生成二氧化碳的质量大于44份质量,100份质量的碳酸镁与73份质量的盐酸反应生成二氧化碳的质量等于44份质量。
故选:
C。
26.B
【解析】
A.浓硫酸在敞口容器中放置一段时间后因吸水而质量增加,但没有新的物质生成,是物理变化;B.苛性钠固体在敞口容器中放置一段时间后,和空气中的二氧化碳反应生成碳酸钠,质量增加;C.浓盐酸在敞口容器中放置一段时间后,因挥发质量减少;D.碳酸钠晶体在敞口容器中放置一段时间后会发生分解反应,失去结晶水,而质量减少;选B
27.B
【解析】
pH=11的溶液呈碱性。
A.AlCl3、CuSO4溶液呈蓝色、NaCl。
B.BaCl2、NaCl、NaOH。
能在pH=11的溶液中大量共存,且溶液为无色透明的。
C.CaCl2和Na2CO3反应生成碳酸钙沉淀、和AgNO3反应生成氯化银沉淀。
D.K2SO4、NaNO3、NH4Cl在碱性溶液中,生成氨气。
点睛∶本题主要考查复分解反应的条件。
28.C
【解析】
A、水是由水分子构成的纯净物,氢氧化钠由三种元素组成,不属于氧化物,错误;B、冰水混合物是水的两种状态混合物,但只含有水这种物质,属于纯净物,错误;C、空气由多种物质组成,属于混合物,氧气是由同种元素形成的纯净物,属于单质,水是由氢氧元素组成的纯净物,属于氧化物,正确;D、碳酸钙由三种元素组成,不属于氧化物,错误。
故选C。
29.C
【解析】
【详解】