江苏省高考化学二轮 专题八 反应热与电化学最新讲义.docx
《江苏省高考化学二轮 专题八 反应热与电化学最新讲义.docx》由会员分享,可在线阅读,更多相关《江苏省高考化学二轮 专题八 反应热与电化学最新讲义.docx(15页珍藏版)》请在冰豆网上搜索。
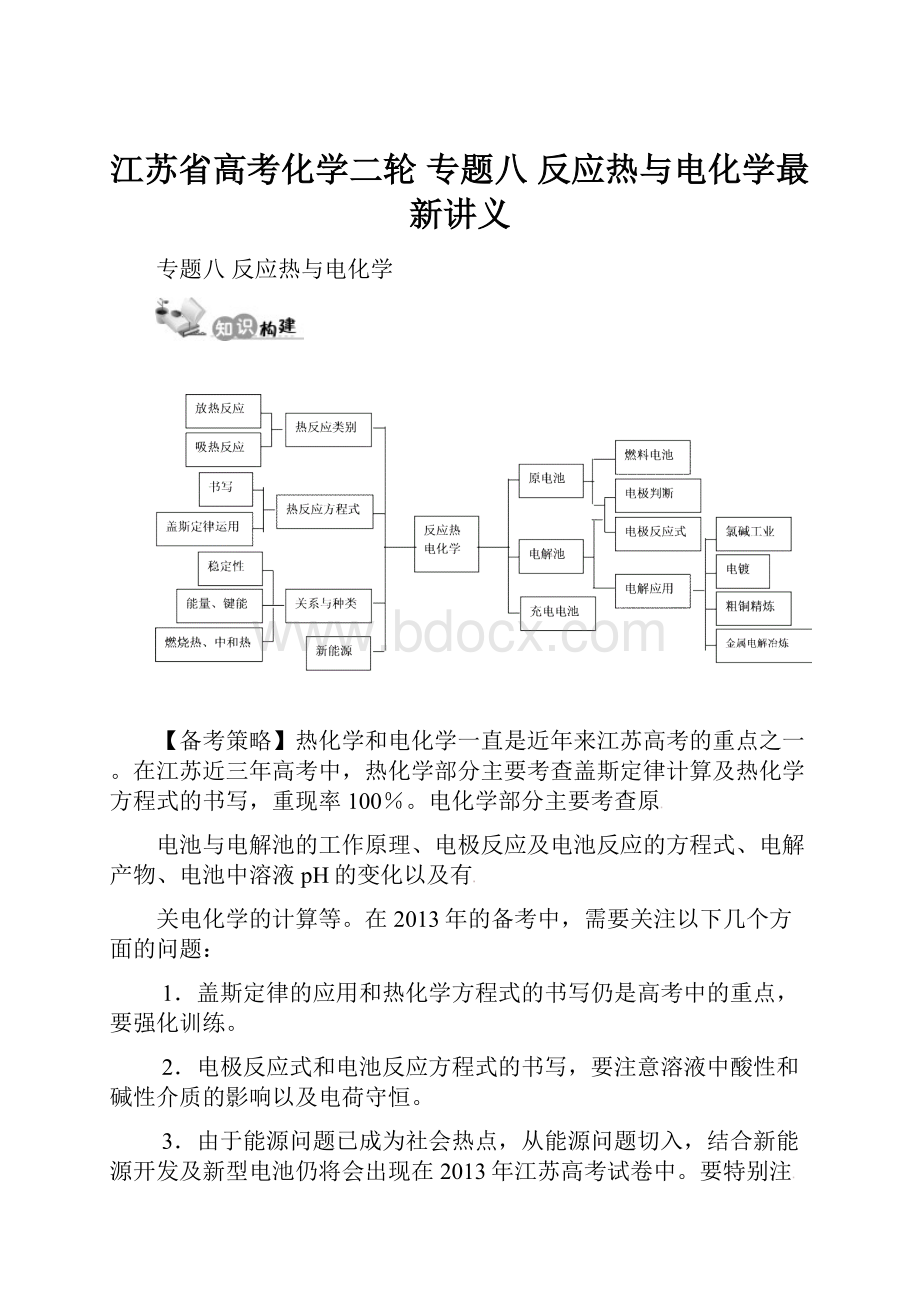
江苏省高考化学二轮专题八反应热与电化学最新讲义
专题八反应热与电化学
【备考策略】热化学和电化学一直是近年来江苏高考的重点之一。
在江苏近三年高考中,热化学部分主要考查盖斯定律计算及热化学方程式的书写,重现率100%。
电化学部分主要考查原
电池与电解池的工作原理、电极反应及电池反应的方程式、电解产物、电池中溶液pH的变化以及有
关电化学的计算等。
在2013年的备考中,需要关注以下几个方面的问题:
1.盖斯定律的应用和热化学方程式的书写仍是高考中的重点,要强化训练。
2.电极反应式和电池反应方程式的书写,要注意溶液中酸性和碱性介质的影响以及电荷守恒。
3.由于能源问题已成为社会热点,从能源问题切入,结合新能源开发及新型电池仍将会出现在2013年江苏高考试卷中。
要特别注
意第Ⅱ卷中的化学反应中的能量变化与电化学相结合的综合问题的训练。
类型一、反应热与热化学方程式
例1.
(1)下图是NO2和CO反应生成CO2和N2过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
。
(2)我国实施“嫦娥探月”行动的长征火箭中使用偏二甲肼[(CH3)2N—NH2]作为燃料,其与过氧化氢发生反应放出大量热量(CH3)2N—NH2(l)+8H2O2
(1)=N2(g)+2CO2(g)+12H2O(g)△H=—2500kJ/mol。
如果1mol偏二甲肼与过氧化氢发生上述反应生成液态水,则反应中放出的热量Q2500kJ(填“<”、“>”或“=”)。
【考点透视】反应热与能量
1.从宏观上分析,反应热的形成原因是反应物具有的总能量与生成物具有的总能量的相对大小;从微观上分析,反应热形成原因是断键时吸收的热量与成键时放出的热量的相对大小,注意从图示上去理解。
2.热化学方程式是表示反应已完成的数量。
由于△H与反应完成物质的量有关,所以方程式中化学式前面的化学计量数必须与△H相对应,如果化学计量数加倍,则△H也要加倍。
当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
3.从能量角度比较物质的稳定性:
物质本身具有的能量越高,其稳定性越差。
【变式训练1】(2012·江苏卷)某反应的反应过程中能量变化如右图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。
下列有关叙述正确的是
A.该反应为放热反应
B.催化剂能改变反应的焓变
C.催化剂能降低反应的活化能
D.逆反应的活化能大于正反应的活化能
类型二、盖斯定量的应用
例2.(2012·金陵中学模拟有删减)氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
(1)现代工业以天然气为原料,采用甲烷部分氧化法制H2,其反应式为:
CH4(g)+1/2O2(g)=CO(g)+2H2(g)△H1=—35.6kJ.mol-1.......①
试判断常温下,上述反应能否自发进行:
(填“能”或“否”)。
有研究认为甲烷部分氧化的机理为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H2=—890.3kJ·mol-1 ......②
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H3=+247.3kJ·mol-1......③
试结合反应①确定下面热化学反应方程式中的△H:
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=kJ·mol-1
【总结提升】
1.热化学方程式的书写规则
(1)书写热化学方程式时一定要注明物质的聚集状态,否则反应热无实际意义。
(2)热化学方程式中的△H值一定要与方程式中的计量系数成比例,且要注明正、负和单位。
(3)热化学方程式的计量系数只表示物质的量,可以为分数或小数,但高考表述时,考生们最好还是写最简整数,以免计算时造成不必要的麻烦。
(4)一般来说热化学方程式必须注明反应条件,如不注明反应的温度和压强,则应将温度和压强分别视为25℃和1.01×105Pa。
2.利用盖斯定律进行△H计算时的注意事项
(1)合理进行方程式的叠加
热化学方程式的叠加类似于整式的运算,叠加时应遵循数学的运算规则,当需要将某一热化学方程式同乘以某一化学计量数时,各物质前的化学计量数和△H需同乘以该化学计量数。
(2)“△H”在进行加、减、乘等运算时,一定要注意其符号的改变,即△H的运算包括数值和符号的双重运算。
【变式训练2】(2012·宿迁模拟有删减))甲醇被称为21世纪的新型燃料,甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
已知:
①CH4(g)+H2O(g)=CO(g)+3H2(g)△H1=+206.2kJ·mol-1
②CH4(g)+
O2(g)=CO(g)+2H2(g)△H2=-35.4kJ·mol—1
③CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H3=+165.0kJ·mol-1
CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为。
放电
充电
类型三、可充电电池工作原理
例3.(2012·苏州模拟)镍氢碱性电池的总反应式是HM+NiO(OH)
NiO+M+H2O(HM表示合金M贮存氢后的简式)。
根据此反应式判断,下列叙述正确的是
A.电池放电时,电池负极周围溶液的OH-不断增大
B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原
D.电池充电时,阳极反应为NiO-e-+OH-=NiO(OH)
【考点透视】可充电电池工作原理
(1)注意正逆方向的含义,需要指出的是充电电池总反应式不是可逆反应。
(2)电池放电时,作为原电池,失电子(化合价升高)的反应物是负极反应物,得电子(化合价降低)的反应物是正极反应物。
(3)电池充电时,作为电解池,失电子(化合价升高)的反应物是阳极反应物,得电子(化合价降低)的反应物是阴极反应物。
(4)电池充电时,电池的负极连接电源的负极,电池的正极连接电源的正极。
【变式训练3】(2012宝应县检测)右图是铅蓄电池充、放电时的工作示意图,已知放电时电池反应为:
PbO2+Pb+4H++2SO42—=2PbSO4+2H2O。
下列有关说法正确的是
A.K与N相接时,能量由电能转化为化学能
B.K与N相接时,H+向负极区迁移
C.K与M连接时,所用电源的a极为负极
D.K与M相接时,阳极附近的pH逐渐增大
类型四、电化学综合
例4.(2012·淮阴中学模拟)
(1)如下图所示,其中甲池的总反应式为:
2CH3OH+3O2+4KOH=2K2CO3+6H2O
下列说法正确的是
A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B.甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O=CO32-+8H+
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,一定能使CuSO4溶液恢复到原浓度
D.甲池中消耗280mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
(2)O3可由臭氧发生器(原理如右图所示)电解稀硫酸制得。
①图中阴极为(填“A”或“B”)。
②若C处通入O2,则A极的电极反应式为:
。
③若C处不通入O2,D、E处分别收集到15.68L和有6.72L气体(标准状况下),则E处收集的气体中O2和O3的体积之比为(忽略O3的分解)。
【技巧与归纳】
1.燃料电池的电极反应式和总反应方程式的书写步骤:
(1)写出燃烧反应正确的化学方程式;
(2)根据电解质溶液的酸碱性改写燃料电池总反应;
(3)写出正极的电极反应式(一般较简单);
(4)由燃料电池总反应方程式减去正极的电极反应式得到负极的电极反应式。
2.原电池电极反应式的书写除注意正确判断正、负极外,还应充分考虑介质的影响。
一般而言,中性溶液中反应物不可出现H+和OH一;酸性溶液中反应物、生成物不会有OH一;碱性溶液中反应物、生成物不会有H+;水溶液中不会出现O2-。
特别要注意的是介质还能影响正、负极的改变,如Mg-A1-NaOH原电池中,Mg为正极,Al为负极。
3.电解池的电极反应和总反应式的书写方法
(1)先检查阳极电极材料和确定溶液中的离子种类;
(2)由放电顺序确定放电产物和电极反应;
(3)将电极反应相加得总反应式。
【变式训练4】(2012·淮安四模有删改)
过氧化氢和臭氧都是常见的绿色氧化剂,在工业生产中有着重要的用途。
(1)据报道以硼氢化合物NaBH4(B的化合价为+3价)和H2O2作原料的
燃料电池,可用作通信卫星电源。
负极材料采用Pt/C,正极材料采用
MnO2,其工作原理如图7所示。
该电池放电时正极的电极反应式
为:
;以MnO2做正极材料,可能是因为▲。
(2)高铁酸钾K2FeO4还可制作充电电池,原理为:
3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH
①该电池充电时阳极电极反应式为____,②该电池工作时消耗3molZn,同时电解饱和食盐水,产生的氢气物质的量是。
1.参照反应Br+H2
HBr+H的能量变化示意图,下列叙述正确的是()
A.该反应的△H=+(E1一E2)kJ/molB.加入催化剂,该化学反应的反应热变大
C.反应物的总能量高于生成物的总能量D.升高温度可增大正反应速率,降低逆反应速率
2.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。
如下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:
下列说法正确的是( )
A.1molN2(g)和1molO2(g)反应放出的能量为180kJ
B.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.NO是一种
酸性氧化物,能与NaOH溶液反应生成盐和水
3.(2012无锡期末)
.如右图所示,将两烧杯中电极用导线相连,四
个电极分别为Mg、Al、Pt、C。
当闭合开关S后,以下表述正确的是()
A.电流表指针不发生偏转
B.Al、Pt两极有H2产生
C.甲池pH减小,乙池pH增加
D.Mg、C两极生成的气体在一定条件下可以恰好完全反应
4.(2012·安徽理综卷)某兴趣小组设计如下微型实验装置。
实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流发A指针偏转。
下列有关描述正确的是
A.断开K2,闭合K1时,总反应的离子方程式为:
2H+2Cl-=Cl2↑+H2↑
B.断开K1,闭合
K2时,石墨电极附近溶液变红
C.断开K1,闭合K2时,铜电极上的电极反应为:
Cl2+2e-=2Cl-
D.断开K1,闭合K2时,石墨电极作正极
5.(2012苏南四市二模)在汽车上安装催化转化器可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)相互反应生成无毒害物质,减少汽车尾气污染。
(1)N2(g)+O2(g)=2NO(g)
△H1=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g)△H2=-221.0kJ·mol-1
C(s)+O2(g)=CO2(g)△H3=-393.5kJ·mol-1
写出NO(g)与CO(g)反应的热化学方程式:
。
(2)CO分析仪以燃料电池为工作原理,其装置如图10所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。
下列叙述错误的是(填序号)。
A.负极的电极反应式为:
CO+O2-―2e-=CO2
B.工作时O2-在固体介质中由电极a流向电极b
图10
C.工作时电子由电极a通过电流计流向电极b
D.电流计中显示的电流越大,汽车尾气中CO的含量越高
专题八 反应热与电化学
【例1】
(1)NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234kJ/mol
(2)>
解析:
(1)反应物是NO2(g)和CO(g),产物是CO2(g)和NO(g),属于放热反应
(2)由于H2O(g)===H2O(l) ΔH<0,故Q>2500kJ。
【变式训练1】 C 解析:
反应物能量低于生成物能量,是吸热反应,选项A错误;催化剂改变反应路径,不改变反应的焓变,选项B错误、选项C正确;从图标看逆反应的活化能小于正反应的活化能,选项D错误。
【例2】
(1)能
(2)250
解析:
(1)该反应的ΔS>0,ΔG=ΔH1-TΔS<0,则能自发进行。
(2)ΔH=2ΔH1-
(ΔH3+ΔH2)=+250.3kJ/mol。
【变式训练2】 CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH3=+247.4kJ·mol-1
解析:
CH4(g)+CO2(g)===2CO(g)+H2(g) ΔH=-ΔH3+2ΔH1=-165.0kJ·mol-1+2×206.2kJ·mol-1=+247.4kJ·mol-1。
【例3】 CD 解析:
电池放电时,负极反应式是H-e-+OH-===H2O,负极周围溶液的OH-减小,选项A错误;正极反应式是NiO(OH)+e-===NiO+OH-,镍元素被还原,选项B错误;充电时,阳极反应式是:
NiO+OH--e-===NiO(OH),选项D正确;充电时,阴极反应式是H2O+e-===H+OH-,氢元素被还原,选项C正确。
【变式训练3】 C 解析:
K与N相接时,构成原电池,由化学能转化为电能,选项A错误,此时负极反应式是Pb+SO
-2e-===PbSO4,正极反应式是PbO2+4H++SO
+2e-===PbSO4+2H2O,H+向正极区迁移,选项B错误;K与M连接时,构成电解池,原电池的负极变为电解池的阴极,则a是电源的负极,选项C正确,阳极反应式是PbSO4+2H2O-2e-===PbO2+4H++SO
,溶液中的c(H+)增大,pH减小,选项D错误。
【例4】
(1)D
(2)①A ②O2+4H++4e-===2H2O ③2︰1
解析:
(1)甲池是原电池,乙丙池是电解池,选项A错误。
(2)甲池中是碱性介质,电极反应式不能出现
H+,选项B错误;乙池中的电解方程式是2CuSO4+2H2O
2Cu+O2↑+2H2SO4,再加入CuO即可恢复到原浓度,加入Cu(OH)2固体,水量增加,选项C错误;丙池中的化学方程式是MgCl2+H2O
Mg(OH)2
+H2↑+Cl2↑,根据电子转移:
O2~2Mg(OH)2,n[Mg(OH)2]=2n(O2)=0.025mol,m[Mg(OH)2]=0.025mol×58g/mol=1.45g,选项D正确。
(2)图示装置是电解池,E出口产生O3,由H2O→O3,是阳极产物,故B是阳极,则A是阴极;通入O2的A极的电极反应式是O2+4H++4e-===2H2O;不通入O2的A极的电极反应式是2H+2e-===2H2↑,n(H2)=15.68L/22.4L·mol-1=0.70mol,n(O2)+n(O3)=6.72L/22.4
L·mol-1=0.30mol,根据电子转移守恒,4n(O2)+6n(O3)=2n(H2)=1.4mol,n(O2)=0.20mol,n(O3)=0.10mol,V(O2)∶V(O3)=2∶1。
【变式训练4】
(1)H2O2+2e-===2OH- 除了作电极材料,MnO2还对电极反应具有催化作用
(2)①Fe(OH)3-3e-+5OH-===FeO
+4H2O ②3mol
解析:
(1)根据图示信息,该燃料电池的总方程式是NaBH4+2H2O2===NaBO2+4H2O,正极反应物是H2O2,MnO2对其具有催化作用。
(2)①充电的阳极反应物是Fe(OH)3。
②n(e-)=6mol,电解饱和食盐水时的阴极反应式是
2H2O+2e-===H2↑+2OH-,n(H2)=3mol。
随堂训练
1.A 解析:
反应物吸收的能量与产物释放的能量差值就是该反应的焓变,图像中反应物吸收的能量大于产物释放的能量,该反应为吸热反应;催化剂只能加快反应速率,不能影响反应的热效应;升高温度可以加快反应速率,正、逆反应速率同时加快,但是加快的程度不同。
2.B 解析:
该反应的热化学方程式是N2(g)+O2(g)===NO(g) ΔH=(946+498-2×632)kJ/mol=+180kJ/mol,属于吸热反应,选项A错误;吸热反应的反应物总能量小于生成物
的总能量,选项B正确;N2(g)和O2(g)的反应条件是放电,选项C错误;NO是不成盐氧化物,选项D错误。
3.CD 解析:
甲池是原电池,Al是负极,Mg是正极,反应的化学方程式是2Al+2NaOH+2H2O===2NaAlO2+3H2↑,正极生成氢气,溶液的pH减小,选项A、B错误;乙池是电解池,Pt是阴极,C是阳极,反应的化学方程式是2H2O===2H2↑+O2↑,随着水的减少,pH增大,选项C正确;Mg、C两极生成的气体分别是H2和O2,其物质的量之比是2∶1,恰好完全反应,选项D正确。
4.D 解析:
断开S2,闭合S1时,装置为电解池,两极均有气泡产生,则反应为2Cl-+2H2O
H2↑+2OH-+Cl2↑,石墨为阳极,铜为阴极,因此石墨电极处产生Cl2,在铜电极处产生H2,附近产生OH-,溶液变红,故A、B两项均错误;断开S1、闭合S2时,为原电池反应,铜电极反应为H2-2e-+2OH-===2H2O,为负极,而石墨电极反应为Cl2+2e-===2Cl-,为正极,故C项错误,D项正确。
5.
(1)2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=-746.5kJ·mol-1
(2)B 解析:
(1)方程式是2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=2ΔH3-ΔH2-ΔH1=-746.5kJ·mol-1。
(2)该燃料电池的总方程式是2CO+O2===2CO2,负极反应物是CO,电极反应式为CO+O2--2e-===CO2,正极反应式是O2+4e-===2O2-,选项A的说法正确;工作时O2-在固体介质中由电极b流向电极a,选项B错误;
电子由负极(a)流向正极(b),选项C的说法正确;电流计显示的电流越大,汽车尾气中CO的含量越高,选项D的说法正确。