化学式和化合价Word文件下载.docx
《化学式和化合价Word文件下载.docx》由会员分享,可在线阅读,更多相关《化学式和化合价Word文件下载.docx(18页珍藏版)》请在冰豆网上搜索。
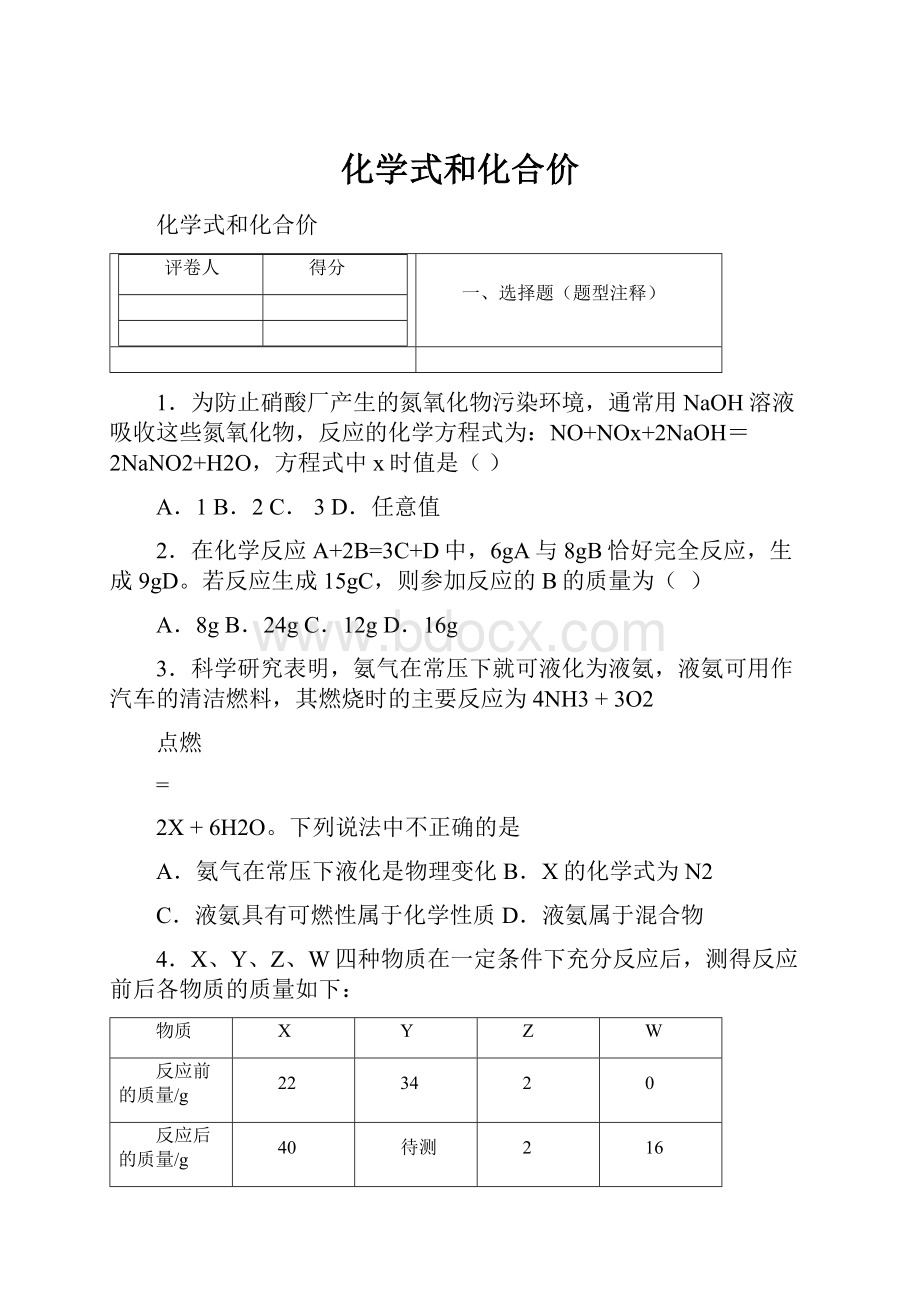
A.H2OB.SO2C.COD.CO2
6.在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如下表所示,下列说法错误的是
物 质
a
b
c
d
反应前质量(g)
10
反应后质量(g)
21
A.该反应是化合反应,d可能是催化剂
B.a、b两种物质中元素种类一定与c物质中元素种类相同
C.b物质可能是单质
D.反应后a物质的质量为3g
7.关于化学方程式CH4+2O2
CO2+2H2O的描述正确的是( )
A.甲烷加氧气在点燃条件下,反应生成二氧化碳和水
B.1个甲烷和2个氧气在点燃条件下,生成1个二氧化碳和2个水
C.1个CH4分子和2个O2分子在点燃条件下,生成1个CO2分子和2个H2O分子
D.1gCH4和2gO2在点燃条件下,生成1gCO2和2gH2O
8.在一个密闭容器中放入M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,则关于此反应认识不正确的是()
A.该变化的基本反应类型是分解反应
B.反应后物质M的质量为13g
C.反应中N、P的质量比为5:
4
D.物质Q可能是该反应的催化剂
9.关于2CO+O2
2CO2的叙述正确的是( )
A.一氧化碳加氧气点燃等于二氧化碳
B.一氧化碳和氧气在点燃条件下反应生成二氧化碳
C.两个一氧化碳分子加一个氧分子等于两个二氧化碳分子
D.2g一氧化碳和1g氧气反应生成2g二氧化碳
10.某纯净物X在空气中燃烧,反应的化学方程式为:
3X+2O2
2CO+CO2+3H2O,则X的化学式(分子式及有机物的结构简式等都可称为化学式)为( )
A.C3H6B.CH3OHC.HCHOD.HCOOH
11.二氧化氯(ClO2)是消毒剂.可用氯酸钠(NaClO3)和盐酸反应制得二氧化氯,化学方程式2NaClO3+4HCl=2ClO2↑+Cl2↑+2X+2NaCl:
,请推断x的化学式为( )
A.HClOB.NaOHC.H2OD.HClO3
12.下列应用和相应的原理(用化学方程式表示)及基本反应类型都正确的是()
A.煤炉内产生蓝色火焰的反应:
2C+O2
2CO化合反应
B.焦炭用于炼铁:
3C+Fe2O3
Fe+3CO2↑置换反应
C.检验二氧化碳:
CO2+2NaOH=Na2CO3+H2O复分解反应
D.用稀盐酸除去铁锈:
Fe2O3+6HCl=2FeCl3+3H2O复分解反应
13.下列化学方程式中,书写正确的是()
A.H2O2
H2O+O2↑
B.Zn+2HCl=ZnCl2+H2↑
C.4Fe+3O2
2Fe2O3
D.CaCO3=CO2+CaO
14.下列化学方程式正确的是()
A.铁屑溶于稀硫酸:
2Fe+3H2SO4=Fe2(SO4)3+3H2↑
B.铁丝在氧气中燃烧:
3Fe+2O2=Fe3O4
C.木炭在不充足的氧气中燃烧:
2CO
D.分解过氧化氢溶液:
H2O2
H2↑+O2↑
15.下列化学方程式能正确表示所述内容的是( )
A.铁丝在氧气中燃烧:
4Fe+3O2
B.实验室制备CO2:
CaCO3
高温
CaO+CO2↑
C.盐酸除铁锈:
Fe2O3+6HCl═2FeCl3+3H2O
D.CO2通入CaCl2溶液中:
CO2+CaCl2+H2O═CaCO3↓+2HCl
16.相同质量的下列物质①Zn②ZnO③Zn(OH)2④ZnCO3,分别跟质量分数都相同且适量的稀盐酸充分反应,所得溶液的溶质质量分数的关系正确的是()
A.①>②>③>④B.④>③>②>①
C.①>②=④>③D.④>①>②=③
17.某合金6g与足量的稀硫酸充分反应后,如果生成0.2g氢气,该合金中的元素可能是()
A.Zn和FeB.Cu和AuC.Zn和CuD.Mg和Al
18.已知反应A+2B==C+2D,8gA与足量的B恰好完全反应生成22gC和18gD,D的相对分子质量为18,则A的相对分子质量为()。
A.8B.18C.22D.16
19.将一定质量的高锰酸钾放在试管内加热一段时间后,测得反应后生成氧气的质量小于原高锰酸钾质量的10%,则反应后的固体物质与原高锰酸钾的质量比可能是
A.71︰75B.71︰79C.80︰79D.81︰79
20.取一定量氧化钙和氢氧化钙组成的混合物加入到800g水中使其完全溶解,再向该溶液中通入适量的二氧化碳气体,至固体质量恰好不再增加,过滤,得滤液800.18g,干燥后得2g滤渣,则原混合物中氢氧化钙的质量是
A.0.56gB.1.12gC.0.74gD.1.48g
七、计算题(题型注释)
21.某烧杯中加入12.5g含杂质的石灰石,与100g稀盐酸恰好完全反应(杂质不与盐酸反应也不溶于水),称得烧杯中物质的总质量减少了4.4g.求:
(1)石灰石含碳酸钙的质量分数.
(2)反应后溶液中溶质的质量分数.
22.乙醇是一种清洁的绿色能源,可再生,俗称酒精,其化学式为C2H5OH,其在空气中完全燃烧的化学方程式为:
C2H5OH+3O2
2CO2+3H2O,现有100g质量分数为92%的乙醇溶液在空气中完全燃烧产生二氧化碳的质量为多少克?
23.计算:
兴塘初中化学兴趣小组的同学在实验室用加热氯酸钾和二氧化锰固体混合物制取氧气时,反应前氯酸钾和二氧化锰混合物的质量为7克,加热到不再产生气体为止,剩余固体的质量为5.08克.则:
(1)反应能制得氧气质量为克?
(2)原混合物中氯酸钾的质量分数为多少?
24.某化学兴趣小组欲测定某石灰石样品中碳酸钙的质量分数。
取20g石灰石样品(假设杂质既不溶于水,也不与其他物质反应),向其中加入100g一定溶质质量分数的稀盐酸,恰好完全反应,称得固液混合物的质量为113.4g。
请回答下列问题:
(1)写出反应的化学方程式;
(2)列出求解该样品中参加反应的碳酸钙质量(x)的比例式;
(3)该样品中碳酸钙的质量分数为;
(4)向反应后的固液混合物中加入113.6g水,充分搅拌后过滤,得到只含一种溶质的不饱和溶液,则所得不饱和溶液中溶质的质量分数为;
(5)欲配制150g上述实验所用的稀盐酸,需要36.5%的浓盐酸质量为。
参考答案
1.B
【解析】
试题分析:
根据质量守恒定律化学反应前后原子的种类和数目不变,反应前Na:
2,H:
2,,O:
3+x,N:
2;
反应后Na:
5,N:
故X为2.故选B。
考点:
质量守恒定律
2.B
根据质量守恒定律:
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,若6gA与8gB恰好完全反应,生成9gD,则同时生成C的质量为5g,,现反应生成15gC,根据前面的质量关系,则参加反应的B的质量为24g,故选B
3.D
氨气在常压下液化,只是物质的状态发生了改变,物质本身不变,为物理变化,A正确;
根据化学变化的实质是分子的破裂和原子的重新组合,化学反应遵循质量守恒定律,化学变化前后原子的种类和个数不变,可以确定X的化学式为N2,B正确;
液氨可做汽车的清洁燃料,燃烧过程发生了化学变化,所以可燃性属于化学性质,C正确;
液氨中只有一种物质,属于纯净物,D错误。
故选D。
物质的变化与性质、质量守恒定律
4.
Z在反应中前后质量不变,可能是催化剂,所以A正确;
根据质量守恒定律,待测=22+34+2-40-2-16=0,生成的X质量为40-22=18,参加反应的Y质量是34-0=34,两者质量比=18:
34=9:
17,所以B正确;
该反应是Y=X+W,属于分解反应,所以C错误;
因为待测为零,所以Y全部参加反应,所以D正确,故选C。
质量守恒定律在化学反应中运用。
5.A
化学变化前后元素的种类不变,原子的种类、个数不变;
高氯酸铵(NH4ClO4)中含有氮元素、氯元素、氧元素、氢元素四种元素,分解时不可能产生含有硫元素、碳元素的物质,故不可能产生二氧化硫、二氧化碳和一氧化碳,观察选项,故选A
元素在化学变化过程中的特点
6.D
首先根据反应前后质量的变化来判断反应物、生成物,b反应前10g,反应后2g,说明是反应物,反应了8g,c反应前10g,反应后21g,说明是生成物,生成了11g,而d的质量在反应前后不变,所以可能是该反应的催化剂,这样可以判断a也应该是反应物,故反应可表示为:
a+b→c,是化合反应,所以A正确,B、根据质量守恒定律,化学反应前后的元素种类不变,所以反应物a、b两种物质中元素种类一定与生成物c中元素种类相同,正确,C、物质b作为反应物,可能是单质,正确,D、根据质量守恒定律,可知参加反应a的质量为3g,所以反应后a物质的质量应为8g,错误,故选D
质量守恒定律,化合反应
7.C
A、在反应中“+”读作“和”,该反应可读作:
甲烷和氧气在点燃条件下,反应生成二氧化碳和水,故选项读法错误;
B、该反应不能读作,1个甲烷和2个氧气在点燃条件下,生成1个二氧化碳和2个水;
从微观上,1个CH4分子和2个O2分子在点燃条件下,生成1个CO2分子和2个H2O分子,故选项读法错误;
C、从微观上,1个CH4分子和2个O2分子在点燃条件下,生成1个CO2分子和2个H2O分子,故选项读法正确;
D、该反应可读作:
每16份质量的甲烷和64份质量的氧气在点燃条件下恰好反应生成44份质量的二氧化碳和36份质量的水,则1gCH4和4gO2在点燃条件下能充分反应,故选项读法错误
化学方程式的意义
8.A
根据反应前后的质量变化来判断反应物、生成物,物质N反应前是1g,反应后是26g,增加了25g,是生成物,物质P反应前是32g,反应后是12g,减少了20g,是反应物,所以反应中N、P的质量比为25:
20=5:
4,C正确,而Q的质量不变,根据催化剂的概念,所以物质Q可能是该反应的催化剂,D正确,根据质量守恒,可以判断物质M应该是反应物,并且应该反应了5g,反应前是18g,所以反应后物质M的质量为13g,B正确,综上分析,所以反应可表示为P+M→N,该变化的基本反应类型是化合反应,所以A错误,,故选A
质量守恒定律的应用,化合反应,催化剂的概念
9.B
A、化学方程式中“+”应读作“和”,不能读作“加”,“=”应读作“生成,”不能读作“等于”,故选项说法错误;
B、从2CO+O2
2CO2可知,该反应的反应物是一氧化碳和氧气,反应条件是点燃,生成物是二氧化碳,可读作:
一氧化碳和氧气在点燃条件下反应生成二氧化碳,故选项说法正确;
C、化学方程式中“+”应读作“和”,不能读作“加”,“=”应读作“生成,”不能读作“等于”,故选项说法错误;
D、从2CO+O2
2CO2可知,参加反应的一氧化碳、氧气及生成的二氧化碳的质量比为(28×
2):
32:
(44×
2)=7:
4:
11,故选项说法错误
10.C
根据反应的化学方程式3X+2O2
2CO+CO2+3H2O,反应物中氧原子个数分别为4,反应后的生成物中碳、氧、氢原子个数分别为3、7、6,根据反应前后原子种类、数目不变,则3X中含有3个碳原子、3个氧原子和6个氢原子,则每个X分子由1个碳原子、1个氧原子、2个氢原子构成构成,则物质X的化学式为HCHO.故选C.
11.C
由反应的化学方程式2NaClO3+4HCl═2ClO2↑+Cl2↑+2X+2NaCl,可知:
反应前反应后
Na原子22
Cl原子66
O原子64
H原子40
根据化学变化前后原子的种类、数目不变,生成物X的2个分子中含有2个O原子和4个H原子,则每个X分子由2个H原子和1个O原子构成,则物质X的化学式为H2O;
故选C.
质量守恒定律的应用
12.D
A:
产生蓝色火焰的是一氧化碳的燃烧;
B:
没有配平;
C:
此反应是用于吸收二氧化碳的,检验用澄清石灰水
常见化学方程式的书写即反应类型的判断。
13.B
根据方程式判断正误的方法考虑:
化学式是否正确;
是否配平;
反应条件是否正确,↑和↓的标注是否正确。
A.没配平,改为2H2O2
2H2O+O2↑,故B错误;
B.依据化学方程式书写原则及注意事项等判断该方程式书写正确,故B正确;
C.违背了客观事实,生成物的化学式书写错误,应为3Fe+2O2
Fe3O4;
D.此反应缺少反应条件,生成的气体没标出,改为CaCO3
CaO+CO2↑,故D错误;
故选B
书写化学方程式、文字表达式、电离方程式
14.C
A、铁发生置换反应的时候,形成的是亚铁盐,所以铁屑溶于稀硫酸,发生的反应:
Fe+H2SO4=FeSO4+H2↑,错误,B、铁在氧气中燃烧的条件是点燃,错误,C、碳在不充足的氧气中燃烧生成一氧化碳,正确,D、方程式没有配平,错误,故选C
化学方程式的书写
15.C
铁在氧气中燃烧生成四氧化三铁,正确的化学方程式应为:
3Fe+2O2
Fe3O4.实验室制备CO2采用大理石或石灰石与稀盐酸反应,生成氯化钙、水和二氧化碳,正确的化学方程式为:
CaCO3+2HCl═CaCl2+H2O+CO2↑.氧化铁和盐酸反应生成氯化铁和水,该化学方程式书写完全正确.二氧化碳与CaCl2溶液不反应,故该化学方程式书写错误
化学反应
16.C
分析四个反应原理可以发现生成物都是氯化钙溶液,题中所给物质与等质量、等质量分数的稀盐酸反应,根据氯元素的质量守恒可知反应后生成的氯化锌的质量相等;
要比较所得溶液中ZnCl2的质量分数大小,根据溶质质量分数=
可知,只需判断反应后的溶液的质量的大小即可;
由于盐酸是等质量的,故只需计算实际增加的量即可;
①Zn+2HCl═ZnCl2+H2↑实际增加质量;
②ZnO+2HCl═ZnCl2+H2O实际增加质量;
65265-2=638181
③Zn(OH)2+2HCl═ZnCl2+2H2O实际增加质量;
④ZnCO3+2HCl═ZnCl2+H2O+CO2↑实际增加质量;
999912544125-44=81
由此可知,③的溶液质量最大,故质量分数最小;
②④的溶液质量相等,故质量分数也相等;
①的溶液质量最小,故质量分数最大,即溶液中溶质的质量分数的大小顺序为:
①>②=④>③;
故选C
根据化学反应方程式的计算;
有关溶质质量分数的简单计算
17.A
由题意可知:
Cu和Au与硫酸都不反应;
Zn与硫酸反应生成0.2g氢气时,至少需要6.5gZn,Mg与硫酸反应反应生成0.2g氢气时,仅仅需要2.4gMg,Al与硫酸反应反应生成0.2g氢气时,仅仅需要1.8gAl,Fe与硫酸反应反应生成0.2g氢气时,需要5.6gFe,6gZn和Fe的混合物与硫酸反应才可能生成0.2g氢气。
选A。
根据化学方程式计算。
点评:
本题难度较大,其本质是根据化学方程式计算。
解题技巧是先假设6g是纯金属,看看完全反应后生成多少氢气,再根据各组分金属与硫酸反应时生成氢气的质量关系来推断。
18.D
根据反应中A与D的质量比=8g:
18g,结合化学方程式中A与D的固定质量比,利用D的相对分子质量为18,可求出A的相对分子质量。
设A的相对分子质量为x
A+2B=C+2D
x18×
8g18g
X:
(18×
2)=8g:
18g
解得x=16。
故选D
根据化学反应方程式的计算
理解和熟练掌握化学方程式中各物质间存在的固定的质量比,是正确解答本题的关键。
19.A
解:
设原有高锰酸钾的质量为x,生成氧气的质量是高锰酸钾质量的10%,即0.1x,剩余固体质量为y。
2KMnO4
【K2MnO4+MnO2】+O2↑
31628432
MN0.1x
反应掉的高锰酸钾质量为M=(316×
0.1x)/32
反应后剩余固体质量为N=(284×
反应后的固体物质与原高锰酸钾的质量比[(284×
0.1x)/32]:
[(316×
0.1x)/32]=71:
79,但题中说明生成的氧气质量小于高锰酸钾的10%,高锰酸钾分解的更少,即生成固体质量小,两者的比值小于71:
79,选A。
质量守恒定律及其应用。
这是一道估算类题目,根据质量守恒定律,先预设反应生成的氧气质量是原高锰酸钾质量的10%,这是解题的关键。
20.C
向该溶液中通入适量的二氧化碳气体,过滤,得到的滤液氢氧化钙溶液,干燥后得2g滤渣,即800.18g氢氧化钙溶液溶质的质量为2g,那么水的质量为800.18g-2g=798.18g,那么参加反应的水的质量为1.82g,利用化学方程式可求出与水反应生成的氢氧化钙的质量,再用2g减去生成的氢氧化钙的质量即为原混合物中氢氧化钙的质量。
故选C。
利用化学方程式的计算
【答案】
(1)80%
(2)10.5%
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,所以称得烧杯中物质的总质量减少了4.4g.即二氧化碳的质量,再根据化学方程式中二氧化碳与碳酸钙的质量关系,便了求出碳酸钙的质量,进而可求出石灰石含碳酸钙的质量分数,反应后溶液中溶质是氯化钙,也可通过化学方程式算出其质量,在根据溶质的质量分数的表达式算出反应后溶液中溶质的质量分数
设样品中碳酸钙的质量为x,生成的氯化钙质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
10011144
xy4.4g
100:
44=x:
4.4gx=10g
石灰石含碳酸钙的质量分数=10g/12.5g×
100%=80%
111:
44=y:
4.4gy=11.1g
因为反应后溶液的质量=10g+100g-4.4g=105.6g
∴反应后溶液中溶质的质量分数=11.1g/105.6g×
100%=10.5%
根据化学方程式进行计算
22.176g
设生产的二氧化碳的质量为X
C2H5OH+3O2
2CO2+3H2O
4688
100g×
92%x
解得x=176g
答:
完全燃烧产生二氧化碳的质量为176g。
根据化学方程式进行计算。
23.
(1)1.92g
(2)70%
根据质量守恒定律,在化学反应前后,参加反应的各物质质量总和,等于反应后生成的各物质质量总和,所以反应生成氧气的质量为:
7g-5.08g=1.92g
根据在化学反应中,各物质质量成比例,等于各物质的相对分子质量与系数乘积之比,所以可以根据生成氧气的质量,求需要氯酸钾的质量,即可求出原混合物中氯酸钾的质量分数。
根据化学方程式计算的规范解题过程:
设、写、标、列、解、答。
设生成1.92g氧气需要氯酸钾的质量为X,
2KClO3
2KCl+3O2↑
24596
x1.92g
根据:
245/x=96/1.92g
解得:
x=4.9g;
所以原混合物中氯酸钾的质量分数为:
4.9g/7g×
100%=70%;
质量守恒定律、根据化学方程式进行计算
24.
(1)CaCO3+2HCl=CaCl2+H2O+CO2↑
(2)100/44=x/6.6g
(3)75%
(4)7.5%
(5)45g
(1)石灰石和稀盐酸反应的方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑
(2)(3)由题意知道产生的二氧化碳的质量为20+100—113.4=6.6g
设碳酸钙质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
10044
X6.6g
100/44=x/6.6g
解得x=15g
所以碳酸钙的质量分数为15g/20g=75%
(4)向反应后的固液混合物中加入113.6g水,充分搅拌后过滤,得到只含一种溶质的不饱和溶液,加水后固液混合物的总质量为227g,其中不溶性的杂质为5g,即所得溶液质量为222g,溶质为氯化钙,根据化学方程式求得生成的氯化钙为16.65g,质量分数为16.65/222g=7.5%
(5)欲配制150g上述实验所用的稀盐酸,先根据化学方程式求出稀盐酸的质量分数为10.95%,所以150克此稀盐酸中含有的HCl质量为150×
10.95%=16.425g,设所需36.5%的浓盐酸质量为y,则36.5%×
y=16.425g,解得y=45g