高三非金属综合练习 2.docx
《高三非金属综合练习 2.docx》由会员分享,可在线阅读,更多相关《高三非金属综合练习 2.docx(41页珍藏版)》请在冰豆网上搜索。
高三非金属综合练习2
高三非金属综合练习
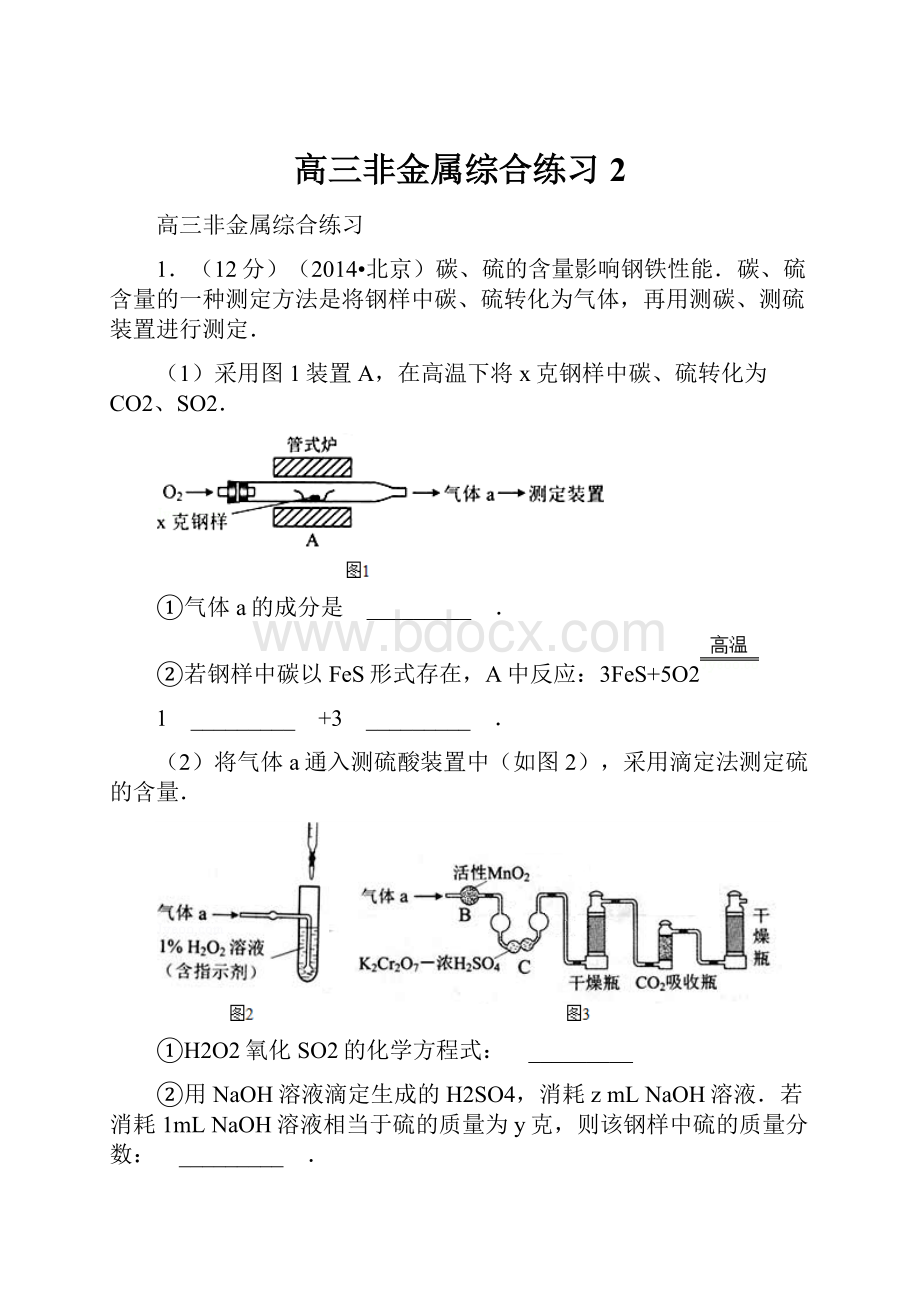
1.(12分)(2014•北京)碳、硫的含量影响钢铁性能.碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定.
(1)采用图1装置A,在高温下将x克钢样中碳、硫转化为CO2、SO2.
①气体a的成分是 _________ .
②若钢样中碳以FeS形式存在,A中反应:
3FeS+5O2
1 _________ +3 _________ .
(2)将气体a通入测硫酸装置中(如图2),采用滴定法测定硫的含量.
①H2O2氧化SO2的化学方程式:
_________
②用NaOH溶液滴定生成的H2SO4,消耗zmLNaOH溶液.若消耗1mLNaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数:
_________ .
(3)将气体a通入测碳装置中(如图3),采用重量法测定碳的含量.
①气体a通过B和C的目的是 _________
②计算钢样中碳的质量分数,应测量的数据是 _________ .
2.(15分)某学生对SO2与漂粉精的反应进行实验探究:
操作
现象
取4g漂粉精固体,加入100mL水
部分固体溶解,溶液略有颜色
过滤,测漂粉精溶液的pH
pH试纸先变蓝(约为12),后褪色
i.液面上方出现白雾;
ii.稍后,出现浑浊,溶液变为黄绿色;
iii.稍后,产生大量白色沉淀,黄绿色褪去
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是。
(3)向水中持续通入SO2,未观察到白雾。
推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a目的是。
②由实验a、b不能判断白雾中含有HC1,理由是。
(4)现象ii中溶液变为黄绿色的可能原因:
随溶液酸性的增强,漂粉精的有效成分和C1-发生反应。
通过进一步实验确认了这种可能性,其实验方案是
。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。
取上层清液,加入BaC12溶液,产生白色沉淀。
则沉淀X中含有的物质是。
②用离子方程式解释现象iii中黄绿色褪去的原因:
。
3.甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
实验操作和现象:
操作
现象
关闭弹簧夹,滴加一定量浓硫酸,加热
A中有白雾生成,铜片表面产生气泡
B中有气泡冒出,产生大量白色沉淀
C中产生白色沉淀,液面上方略显浅棕色并逐渐消失
打开弹簧夹,通入N2,停止加热,一段时间后关闭
从B、C中分别取少量白色沉淀,加稀盐酸
均未发现白色沉淀溶解
⑴A中反应的化学方程式是。
⑵C中白色沉淀是,该沉淀的生成表明SO2具有性。
⑶C中液面上方生成浅棕色气体的化学方程式是。
⑷分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是;
乙在A、B间增加洗气瓶D,D中盛放的试剂是。
甲
大量白色沉淀
乙
少量白色沉淀
②进行实验,B中现象:
检验白色沉淀,发现均不溶于稀盐酸。
结合离子方程式解释实验现象异同的原因:
。
⑸合并⑷中两同学的方案进行实验。
B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是。
4.研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
⑴溶于海水的CO2主要以4种无机碳形式存在。
其中HCO
占95%。
写出CO2溶于水产生HCO
的方程式。
⑵在海洋碳循环中,通过如图所示的途径固碳。
CO2
海洋表面
HCO
光合作用
钙化作用
CaCO3(CH2O)x
①写出钙化作用的离子方程式:
。
②同位素示踪法证实光合作用释放出的O2只来自于H2O。
18O标记物质的光合作用的化学方程式如下,将其补充完整:
光能
叶绿体
+(CH2O)x+x18O+xH2O
⑶海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础。
测量溶解无机碳,可采用如下方法:
①气提、吸收CO2。
用N2从酸化后的海水中吹出CO2并碱液吸收(装置示意图如下)。
将虚线框中的装置补充完整并标出所用试剂。
zmL海水(未酸化)NaOH吸收液
②滴定。
将吸收液吸收的无机碳转化为NaHCO3,在用xmol·L-1HCl溶液滴定,消耗ymLHCl溶液。
海水中溶解的无机碳的浓度=mol·L-1。
⑷利用如图所示装置从海水中提取CO2,有利于减少环境温室气体含量。
海水
(pH≈8)
①结合方程式简述提取CO2的原理:
。
②用该装置产生的物质处理b室排出的海水,合格后排回大海。
处理至合格的方法是
是。
5.为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究
“2Fe3++2I-2Fe2++I2”反应中Fe3+和Fe2+相互转化,实验如下:
i.ii.iii.
⑴待实验Ⅰ溶液颜色不再改变时,再进行实验Ⅱ,目的是使实验Ⅰ的反应达到。
⑵iii是ii的对比实验,目的是排除ii中造成的影响。
盐桥
⑶i和ii的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。
用化学平衡移动原理解释原因:
。
⑷根据氧化还原反应的规律,该同学推测i中Fe2+
向Fe3+转化的原因:
外加Ag+使c(I-)降低,导致
I-的还原性弱于Fe2+,用右图装置(a、b均为石
墨电极)进行实验验证。
①K闭合时,指针向右偏转,b作极。
②当指针归零(反应达到平衡)后,向U型管左
管中滴加0.01mol·L-1AgNO3溶液。
产生的现
象证实了其推测。
该现象是。
⑸按照⑷的原理,该同学用上图装置进行实验,证实了ii中Fe2+向Fe3+转化的原因。
①转化的原因是。
②与⑷实验对比,不同的操作是。
⑹实验Ⅰ中,还原性:
I->Fe2+;而实验Ⅱ中,还原性:
Fe2+>I-。
将⑶和⑷、⑸作对比,得出的结论是。
2、参考答案:
(1)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(2)碱性、漂白性;
(3)①、检验白雾中是否Cl2,排除Cl2干扰;
②、白雾中含有SO2,SO2可以使酸化的AgNO3溶液产生白色沉淀;
(4)向漂白精溶液中逐滴滴入硫酸,观察溶液颜色是否变为黄绿色;
(5)①、CaSO4;
②、Cl2+SO2+2H2O错误!
未找到引用源。
4H++2Cl-+SO42-;
4.(14分)
⑴CO2+H2OH2CO3、H2CO3H++HCO
⑵①2HCO
+Ca2+=CaCO3↓+CO2↑+H2O
②xCO22xH218O
zmL海水(未酸化)
⑶①②
⑷①a室:
2H2O―4e―=4H++O2↑,通过阳离子膜进入b室,发生反应:
H++HCO
=CO2↑+H2O
②c室的反应:
2H2O+2e―=2OH-+H2↑,用c室排出的碱液将从b室排出的酸性海水调至接近装置入口海水的pH
5.(15分)
⑴化学平衡状态⑵溶液稀释对颜色变化
⑶加入Ag+发生反应:
Ag++I-=AgI↓,c(I-)降低;或增大c(Fe2+),平衡均逆向移动
⑷①正②左管产生黄色沉淀,指针向左偏转
⑸①Fe2+随浓度增大,还原性增强,使Fe2+还原性强于I-
②向右管中加入1mol·L-1FeSO4溶液
⑹该反应为可逆氧化还原反应,在平衡时,通过改变物质的浓度,可以改变物质的氧化、还原能力,并影响平衡移动方向
1.将氨水分别滴加到下列4种溶液中,下列说法不正确的是
AlCl3
溶液
abcd
A.试管a中产生白烟
B.试管b中溶液由红色变为蓝色
C.试管c中能发生氧化还原反应
D.试管d中先有沉淀,后沉淀溶解
H2O
O2
O2
2.下列物质的制备线索中,不符合工业生产实际的是
SO2
Cl2
Cl2
A.NH3NONO2HNO3
Ca(OH)2
浓HCl
B.浓缩海水Br2HBrBr2
C.MnO2Cl2漂白粉
催化剂
裂解
D.石油乙烯聚乙烯
3.利用下图装置进行实验(必要时可加热),不能得出相应结论的是
溶液①
固体②
溶液③
实验结论
A
稀硫酸
Na2CO3
Na2SiO3
非金属性:
C>Si
B
浓盐酸
MnO2
Na2S
氧化性:
Cl2>S
C
盐酸
CaCO3
C6H5ONa
酸性:
碳酸>苯酚
D
稀硫酸
Na2CO3
CaCl2
CO2不与氯化钙反应
4.实验室中某些气体的制取、除杂及收集装置如图所示。
仅用此装置和表中提供的物质完成相关实验,最合理的是
选项
a中物质
b中物质
c中物质
d中收集的气体
A
浓氨水
CaO
浓H2SO4
NH3
B
浓硫酸
Na2SO3
浓H2SO4
SO2
C
饱和食盐水
电石
CuSO4溶液
CH≡CH
D
浓盐酸
MnO2
饱和NaCl溶液
Cl2
5、下列各组物质充分反应后过滤,将滤液加热、蒸干至质量不变,最终不能得到纯净物的是
A.向漂白粉浊液中通入过量的CO2
B.向带有氧化膜的铝片中加入盐酸
C.向含有1molCa(HCO3)2的溶液中加入1molNa2O2
D.向含有1molKAl(SO4)2的溶液中加入2molBa(OH)2。
6.右图装置用于气体的干燥、收集和尾气吸收,其中X、Y、Z对应都正确的是
X
Y
Z
A
无水硫酸铜
氯气
饱和食盐水
B
碱石灰
氨气
水
C
氯化钙
二氧化硫
氢氧化钠
D
氯化钙
一氧化氮
氢氧化钠
7..将装满气体X的试管倒置于装有液体Y的水槽中,下列说法合理的是
气体X
液体Y
试管内现象
A
NH3
滴有酚酞的水溶液
充满红色溶液
B
NO2
水
充满无色溶液
C
SO2
滴有品红的水溶液
无明显现象
D
C2H4
酸性KMnO4溶液
无明显现象
8.下表中各组物质之间不能通过一步反应实现右图转化的是
甲
乙
丙
A
CH2=CH2
CH3CH2Cl
CH3CH2OH
B
SiO2
H2SiO3
Na2SiO3
C
Cl2
HCl
CuCl2
D
AlCl3
Al(OH)3
Al2O3
甲
9.实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。
仅用此装置和表中提供的物质完成相关实验,最合理的选项是
—d
选项
a中的物质
b中的物质
c中收集的气体
d中的物质
A
浓氨水
NaOH
NH3
H2O
B
浓硫酸
Na2SO3
SO2
NaOH溶液
C
稀硝酸
Cu
NO2
H2O
D
饱和食盐水
CaC2
C2H2
KMnO4酸性溶液
10.下列事实不能说明元素的金属性或非金属性相对强弱的是
序号
事实
推论
A
与冷水反应,Na比Mg剧烈
金属性:
Na>Mg
B
Ca(OH)2的碱性强于Mg(OH)2
金属性:
Ca>Mg
C
SO2与NaHCO3溶液反应生成CO2
非金属性:
S>C
D
t℃时,Br2+H2
2HBrK=5.6×107
I2+H2
2HClK=43
非金属性:
Br>I
11.(13分)
Cl2是一种重要的化工原料。
(1)电解饱和NaCl溶液获得Cl2的化学方程式是_______。
(2)为便于储存,要将氯气液化[Cl2(g)
Cl2(l)],应采取的措施是_______(写出一条即可)。
(3)液氯储存区贴有的说明卡如下(部分):
危险性
储运要求
远离金属粉末、氨、烃类、醇更物质;设置氯气检测仪
泄漏处理
NaOH、NaHSO3溶液吸收
包装
钢瓶
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用_______。
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是。
③氯气含量检测仪工作原理示意图如下:
Cl2在Pt电极放电的电极反应式是_______。
(4)质量标准要求液氯含水量(以1g氯气含水的质量计)<0.4mg,含水量超标会严重腐蚀钢瓶。
液氯含水量的测定装置如下图所示:
(已知:
P2O5+3H2O=2H3PO4;Cl2与P2O5不反应。
)
①用离子方程式说明c装置的作用_______。
②检测液氯的含水量,根据上图,需要测定的数据是_______。
12.(14分)甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。
操作
现象
通入Cl2至过量
I.A中溶液变红
II.稍后,溶液由红色变为黄色
(1)B中反应的离子方程式是______。
(2)A中溶液变红的原因是______。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在_______。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象II的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:
SCN—的电子式为
。
①甲同学认为SCN—中碳元素没有被氧化,理由是______。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是______。
③通过实验证明了SCN—中氮元素转化为,他的实验方案是______。
④若SCN—与Cl2反应生成1molCO2,则转移电子的物质的量是______mol。
13(14分)硫化物在自然界中的部分循环关系如下。
在土壤和沉积物中的硫酸盐
(1)H2S在空气中可以燃烧。
已知:
2H2S(g)+O2(g)
2S(s)+2H2O(g)ΔH=-442.38kJ/mol
S(s)+O2(g)
SO2(g)ΔH=-297.04kJ/mol
H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是。
(2)SO2是大气污染物,海水具有良好的吸收SO2的能力,其过程如下。
①SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32—,其电离方程式是。
②SO32—可以被海水中的溶解氧氧化为SO42—。
海水的pH会(填“升高”、“不变”或“降低”)。
③为调整海水的pH,可加入新鲜的海水,使其中的HCO3—参与反应,其反应的离子方程式是。
④在上述反应的同时需要大量鼓入空气,其原因是。
(3)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS),用化学用语表示由ZnS转变为CuS的过程:
。
(4)SO2和O2在H2SO4溶液中可以构成原电池,其负极反应式是。
14(11分)
SO2是一种重要的化工原料,也是一种环境污染物。
(1)SO2可用于工业制Br2过程中吸收潮湿空气中的Br2,反应的离子方程式是 。
(2)直接排放含SO2的烟气会形成酸雨,危害环境。
用化学方程式表示SO2形成硫酸型酸
雨的反应:
。
(3)工业上用Na2SO3溶液吸收烟气中的SO2。
将烟气通入1.0mol•L-1的Na2SO3溶液,溶液pH不断减小。
当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
①此时溶液中c(SO32-)的浓度是0.2mol•L-1,则溶液中c(HSO3-)是_________mol•L-1,
由此说明NaHSO3溶液显性,用化学平衡原理解释:
。
②向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是。
15.(15分)某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2。
查阅资料:
SO2Cl2常温下为无色液体,极易水解,遇潮湿空气会产生白雾。
Ⅰ.化合物SO2Cl2中S元素的化合价是。
Ⅱ.用二氧化锰和浓盐酸制氯气的化学方程式是。
Ⅲ.在收集氯气前,应依次通过盛有饱和食盐水和的洗气瓶。
Ⅳ.用如图所示装置收集满Cl2,再通入SO2,集气瓶中立即产生无色液体,
充分反应后,将液体和剩余气体分离,进行如下研究。
(1)研究反应的产物。
向所得液体中加水,出现白雾,振荡、静置得到无色溶液。
经检验该溶液中的阴离子(除OH-外)只有SO42-、Cl-,证明无色液体是SO2Cl2。
①写出SO2Cl2与H2O反应的化学方程式。
②检验该溶液中Cl-的方法是。
(2)继续研究反应进行的程度。
用NaOH溶液吸收分离出的气体,用稀盐酸酸化后,再滴加BaCl2溶液,产生白色沉淀。
①该白色沉淀的成分是。
1写出SO2与Cl2反应的化学方程式,并阐述理由______。
16.(14分)
研究小组用下图装置制取Cl2,证明产生的气体中含有HCl。
浓盐酸
A
MnO2
(1)仪器A的名称为;A中反应的离子方程式为。
(2)甲同学将A中产生的气体通入下列溶液:
实验序号
试剂
现象
a
紫色石蕊溶液
b
AgNO3溶液
出现白色沉淀
①实验a中的现象为。
②不能证明产生的气体中含有HCl的实验是(填字母序号)。
(3)已知将HCl气体通入饱和食盐水中有白色固体析出。
乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因:
。
(4)已知:
2S2O32-+I2===S4O62-+2I-。
丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl。
I.测定X中溶解的Cl2。
取25.00mL溶液X,加入过量KI溶液,然后用0.04mol•L-1Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3溶液VmL。
II.测定X中Cl元素总量。
另取25.00mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl-,再用0.10mol•L-1AgNO3溶液滴定所得溶液中的Cl-。
2X中的HClO不会影响I的测定结果,原因是。
3由I、II中实验数据可证明A中产生的气体中含有HCl,则II中消耗0.10mol•L-1AgNO3溶液的体积应大于mL(用含V的代数式表示)。
17.(12分)SO2是常见的大气污染物,燃煤是产生SO2的主要原因。
工业上有多种方法可以减少SO2的排放。
(1)往煤中添加一些石灰石,可使燃煤过程中产生的SO2转化成硫酸钙。
该反应的化学方程式是。
(2)可用多种溶液做燃煤烟气中SO2的吸收液。
①分别用等物质的量浓度的Na2SO3溶液和NaOH溶液做吸收液,当生成等物质的
量NaHSO3时,两种吸收液体积比V(Na2SO3):
V(NaOH)=。
②NaOH溶液吸收了足量的SO2后会失效,可将这种失效的溶液与一定量的石
灰水溶液充分反应后过滤,使NaOH溶液再生,再生过程的离子方程式是。
(3)甲同学认为BaCl2溶液可以做SO2的吸收液。
为此甲同学设计如下实验(夹持装
置和加热装置略,气密性已检验):
已知:
Na2SO3(固体)+H2SO4(浓)
Na2SO4+SO2↑+H2O
反应开始后,A中Na2SO3固体表面有气泡产生同时有白雾生成;B中有白色沉淀。
甲同学认为B中白色沉淀是SO2与BaCl2溶液反应生成的BaSO3,所以BaCl2
溶液可做SO2吸收液。
乙同学认为B中的白色沉淀是BaSO4,产生BaSO4的原因是:
①A中产生的白雾是浓硫酸的酸雾,进入B中与BaCl2溶液反应生成BaSO4沉淀。
②。
为证明SO2与BaCl2溶液不能得到BaSO3沉淀,乙同学对甲同学的实验装置做了如下改动并实验(夹持装置和加热装置略,气密性已检验):
反应开始后,A中Na2SO3固体表面有气泡产生同时有白雾生成;B、C试管中除了有气泡外,未见其它现象;D中红色褪去。
③试管B中试剂是溶液;滴加浓硫酸之前的操作是。
4通过甲乙两位同学的实验,得出的结论是。
18.(14分)某些资料认为:
NO、NO2不能与Na2O2反应。
某小组学生提出质疑,他们从理论上分析过氧化钠和二氧化氮都有氧化性,根据化合价升降原则提出假设:
假设Ⅰ.过氧化钠氧化二氧化氮
假设Ⅱ.二氧化氮氧化过氧化钠
(1)小组甲同学设计实验如下:
①试管A中反应的化学方程式是。
②待试管B中收集满气体,向试管B中加入适量Na2O2粉末,塞紧塞子,轻轻振荡
试管内粉末,观察到红棕色气体迅速消失;再将余烬木条迅速伸进试管内,看见木
条复燃。
甲同学认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的,为达到实
验目的,在A、B之间增加一个装置,该装置的作用是。
③乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;
余烬木条未复燃。
得出结论:
假设Ⅰ正确。
NO2和Na2O2反应的方程式是。
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化。
查阅资料:
①2NO+Na2O2=2NaNO2
②6NaNO2+3H2SO4=3Na2SO4+2HNO3+4NO↑+2H2O;
③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。
①B中观察到的主要现象是,F装置的作用是。
②在反应前,打开弹簧夹,通入一段时间N2,目的是。
③充分反应后,检验D装置中发生反应的实验是。
19.(12分)某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示。
AB
(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
步骤①
配制1mol·L-1FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A。
FeCl3溶液显酸性的原因是。
写出装置A中产生SO2的化学方程式:
。
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。
将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。
生成Fe(HSO3)2+离子的反应为可逆反应。
解释S