中考化学专题复习一 主题4 生活中常见的化合物Word格式.docx
《中考化学专题复习一 主题4 生活中常见的化合物Word格式.docx》由会员分享,可在线阅读,更多相关《中考化学专题复习一 主题4 生活中常见的化合物Word格式.docx(17页珍藏版)》请在冰豆网上搜索。
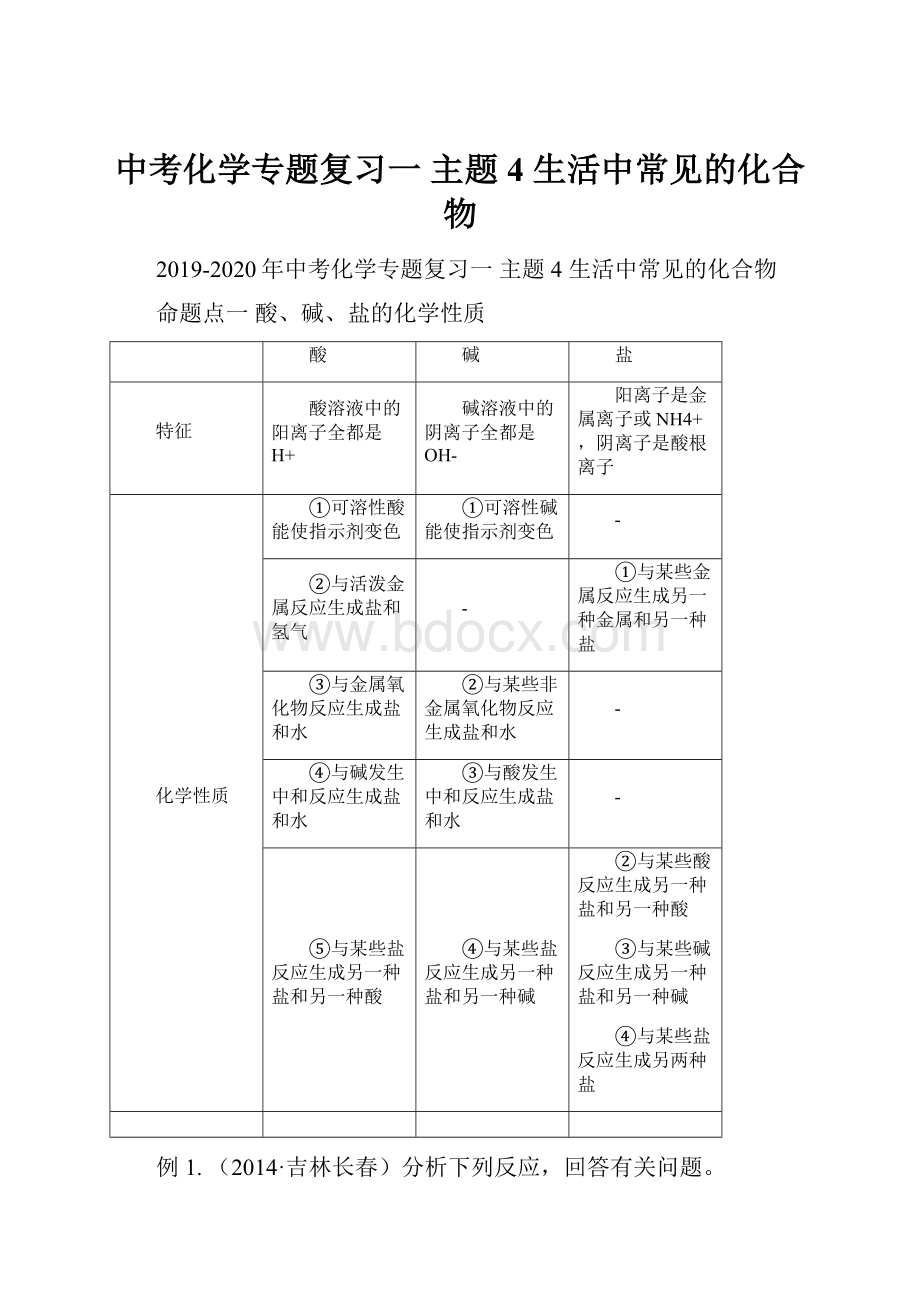
只有当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
2.注意事项:
(1)酸、碱、盐之间发生的反应都为复分解反应。
(2)酸、碱、盐之间发生复分解反应应注意:
反应物的类别
发生条件
酸+碱→盐+水
酸和碱一般都能发生反应;
有水生成
酸+盐→新酸+新盐
盐除了BaSO4、AgCl等外,酸必须可溶;
生成物中要有沉淀或有气体或有水
碱+盐→新碱+新盐
二者都可溶;
生成物中要有沉淀或气体
盐+盐→两种新盐
生成物中要有沉淀
例2.(2014·
四川攀枝花)下列各种溶质的溶液混合后无明显现象的组是()
A.HCl、Na2CO3、K2SO4
B.KNO3、H2SO4、NaCl
C.KCl、AgNO3、HNO3
D.Ba(OH)2、FeCl3、(NH4)2SO4
【解析】A项HCl和Na2CO3反应产生气泡。
B项KNO3、H2SO4、NaCl三种物质都互不反应,无明显现象。
C项KCl和AgNO3反应生成氯化银的白色沉淀,氯化银又不溶于稀硝酸,反应后有白色沉淀生成D项Ba(OH)2和FeCl3反应生成氢氧化铁的红褐色沉淀;
Ba(OH)2和(NH4)2SO4生成硫酸钡的白色沉淀,
【答案】B
命题点三单质、氧化物、酸、碱、盐之间的转化关系
图中“—”表示相连的物质可发生反应,“→”表示物质间存在转化关系。
例3.(2014•黑龙江哈尔滨)下图中的六个圆A、B、C、D、E、F分别表示六种物质,蓝色溶液A与C反应能生成两种沉淀,B为氧化物,C、D、E、F分别是碳酸钠溶液、稀硫酸、氢氧化钡溶液和氢氧化钠溶液中的一种,E中溶质可用于生产洗涤剂。
用“→”表示一种物质能转化为另一种物质,用两圆相切或“——”表示两种物质可以发生化学反应,六种物质之间的部分反应及转化关系如图所示。
请利用初中化学知识回答下列问题:
(1)在图中标出六种物质(或溶质)的化学式。
(2)C与F反应的化学方程式为_____________。
(3)E与F反应的实验现象为_______________。
【解析】蓝色溶液A是硫酸铜溶液,能与硫酸铜溶液反应生成两种沉淀的物质C是Ba(OH)2。
氢氧化钡发生反应生成的氧化物B,应是碱反应后生成的水。
碳酸钠溶液、稀硫酸、氢氧化钠溶液中,溶质可用于生产洗涤剂的E物质是碳酸钠。
能与氢氧化钡发生反应的F物质是稀硫酸,D物质是氢氧化钠,可由氢氧化钡与碳酸钠反应实现转化。
C是Ba(OH)2、F是稀硫酸酸碱发生中和反应生成硫酸钡沉淀和水。
E物质是碳酸钠与稀硫酸(F物质)发生复分解反应生成二氧化碳气体,可观察到有大量气泡产生。
(1)
(2)Ba(OH)2+H2SO4==BaSO4↓+2H2O(3)(溶液中)产生(大量)气泡_
命题点四有关酸、碱、盐的探究实验
例4.(2014•广东佛山)在做盐跟盐反应的分组实验时,第一组学生进行BaCl2与Na2CO3溶液的反应,第二组学生进行BaCl2与Na2SO4溶液的反应。
实验结束后,两组同学将全部的浊液集中倒进一个废液缸中。
浊液中白色沉淀物质是____和____。
化学兴趣小组对浊液进行过滤,探究滤液的成分。
【提出问题】滤液里除了NaCl外,还有什么物质?
【提出猜想】猜想①:
______;
猜想②:
Na2SO4;
猜想③:
Na2CO3;
猜想④:
Na2CO3、Na2SO4
【实验探究】
若现象a只有白色沉淀,则猜想成立;
若现象a只有气泡产生,则猜想____可能成立;
若现象b产生白色沉淀,然后加稀硝酸沉淀部分溶解,并产生气泡,则猜想__成立,若沉淀全部不溶解,则猜想__成立。
【解析】BaCl2与Na2CO3发生复分解反应生成碳酸钡白色沉淀和氯化钠;
BaCl2与Na2SO4发生复分解反应生成硫酸钡白色沉淀和氯化钠。
废液缸浊液中白色沉淀物质是BaSO4和BaCO3。
【提出猜想】滤液中除氯化钠外,还有上述两个反应中过量的物质,根据题中各猜想可知,猜想①应为过量的BaCl2。
【实验探究】若在滤液中加入稀硫酸产生白色沉淀,表明滤液中含有BaCl2与硫酸反应生成硫酸钡沉淀,猜想①成立。
若加入稀硫酸只产生气泡产生,表明滤液中含有Na2CO3与硫酸反应生成二氧化碳,猜想③④成立。
若在滤液中加入BaCl2溶液产生白色沉淀,再加稀硝酸沉淀部分溶解,并产生气泡,表明溶液中含有Na2CO3、Na2SO4,与氯化钡反应生成碳酸钡和硫酸钡沉淀,其中碳酸钡沉淀溶于硝酸生成二氧化碳气体,猜想④成立。
若沉淀全部不溶解,表明滤液中只有Na2SO4,猜想②成立。
【答案】BaSO4BaCO3BaCl2①③④④②
真题试练
一、选择题
1.(2014·
山东临沂)下列物质敞口放置一段时间后,质量增加但溶质成分没有改变的是(C)
A.氢氧化钠溶液B.石灰水
C.浓硫酸D.浓盐酸
2.(2014·
四川成都)下列反应不属于复分解反应的是(A)
A.
B.
C.
D.
3.(2013·
云南玉溪)复合肥可以为农作物提供多种营养元素,下列化学化肥属于复合肥的是(B)
A.Ca(H2PO4)2B.KNO3
C.K2SO4D.CO(NH2)2
4.(2014·
湖南襄阳)①酸奶、②肥皂水、③食盐水是生活中常见的三种物质。
酸奶能使紫色石蕊试液变红,肥皂水显碱性,食盐水的pH=7。
它们的pH由小到大排列,正确的是(B)
A.①②③B.①③②
C.②①③D.③①②
5.(2014·
甘肃兰州)为了维持人体正常的生命活动,人体不同器官的体液具有不同的酸碱性。
根据下表可知,在正常情况下(B)
体液
唾液
胆汁
胰液
pH
6.6-7.1
7.1-7.3
7.5-8.0
A.人体的唾液一定呈酸性
B.人体的胆汁一定呈碱性
C.人体的胰液能使紫色石蕊溶液变红色
D.酚酞溶液可精确测得以上体液的pH
【点拨】人的胆汁和胰液的pH都大于7,呈弱碱性。
而唾液则从弱酸性到弱碱性。
酚酞试液只能测定溶液是否显碱性,不能测定溶液的pH。
6.(2014·
云南曲靖模拟)下列各组离子在pH=1的溶液中能大量共存的是( D )
A.Na+、Cl-、OH-B.K+、Ca2+、CO32-
C.Ag+、Na+、Cl-D.NO3-、Mg2+、Cu2+
【点拨】A选项中OH-在pH=1的溶液中不能大量共存;
B选项中CO32-在pH=1的溶液中不能大量共存;
C选项中Ag+、Cl-不能大量共存。
只有D选项符合要求。
7.(2013·
云南曲靖)下列各组变化中,每一转化在一定条件下不能完全一步实现的是(B)
A.MgCl2→Mg(OH)2
B.Fe→Fe2O3→Fe(OH)3
C.CO2
H2CO3
【点拨】B选项中Fe2O3不能一步转化为Fe(OH)3。
8.(2013·
云南普洱)如图所示,过量的某无色溶液能分别与四种物质发生反应,则下列说法正确的是(C)
A.溶液X一定是稀盐酸
B.溶液X能使无色酚酞试剂变红
C.X与铁反应后,生成浅绿色溶液和氢气
D.黄色溶液中溶质是FeCl2
9.(2014·
云南大理下关模拟)某同学为研究氢氧化钠溶液与稀盐酸是否恰好中和时,取少量反应后的溶液于试管中,分别用不同试剂进行实验。
下列实验方法及结论不正确的是(C)
实验序号
所用试剂
现象及结论
A
铁粉
有气泡产生,则稀盐酸过量
B
pH试纸
测得pH﹥7,则氢氧化钠溶液过量
C
酚酞溶液
溶液为无色,恰好中和
10.(2014·
云南全省模拟联考)下表各组物质中,物质之间按箭头方向通过一步反应就能实现如图所示转化的是(A)(注:
反应条件和其他物质已省略)
【点拨】B选项中丁物质铁,不能转化为另外三种物质;
C选项中丁物质NaOH,不能能转化为丙物质KNO3;
D选项中丁物质水,不能转化为甲物质、乙物质。
二、填空与简答
11.(2014·
黑龙江龙东)现有碳酸氢钠、葡萄糖、氢氧化铝、硫酸等物质,选择合适的物质用化学式填空:
(1)汽车用铅蓄电池中含有的是H2SO4。
(2)能为人体供能的物质是C6H12O6。
(3)焙制糕点的发酵粉成分之一的是NaHCO3。
(4)可用于治疗胃酸过多的碱是Al(OH)3。
12.(2014·
陕西)某班同学为验证酸的化学通性,做了五组实验。
分析并回答问题。
(1)A组试管中都产生H2。
若要制得较纯的H2,选稀硫酸而不选盐酸的原因是__盐酸有挥发性或盐酸会挥发出氯化氢气体或制得的氢气中混有氯化氢气体_。
(2)B组试管中实验现象相同,该现象是__红色(或红棕色)固体逐渐减少,溶液变成黄色_。
(3)写出C组任一试管中发生反应的化学方程式__NaOH+HCl=NaCl+H2O或2NaOH+H2SO4=Na2SO4+2H2O。
(4)上述五组实验中没有体现酸的通性的是___D(填字母序号)。
13.(2013·
云南曲靖)某学习小组的同学做了酸、碱、盐的性质实验后,经初步处理后,废液中可能含有硫酸铜、硫酸钠、碳酸钠、氯化钠中的一种或多种。
他们对废液进行了以下检测:
(1)取废液观察,呈无色、均一、透明状,则该废液中一定不含硫酸铜。
(2)向废液中滴加氯化钡溶液,产生了白色沉淀,再加入足量稀硝酸,白色沉淀部分溶解,则该溶液中一定含有硫酸钠、碳酸钠。
(3)对可能存在的物质重取废液进行以下操作,证明了该物质一定存在:
流程图中A为硝酸钡;
①中产生白色沉淀的化学方程式为:
Ba(NO3)2+Na2SO4=BaSO4↓+2NaNO3
Ba(NO3)2+Na2CO3=BaCO3↓+2NaNO3。
三、实验与探究
14.(2014•湖北鄂州)化学兴趣小组的同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖.对于该溶液是否变质,小组内小明同学认为有两种可能:
猜想1:
该溶液没有变质
猜想2:
该溶液全部变质
(1)小组同学讨论后认为还有一种可能,请你补充出猜想3:
该溶液部分变质 .
(2)为了验证猜想3,小红同学设计了如下实验方案,请你帮他完成实验报告的填写
实验步骤
实验现象
结论
1.取样, 向其中滴加过量的CaCl2(或BaCl2)溶液 ,过滤
产生白色沉淀
猜想3成立
2.向上述滤液中滴加几滴无色酚酞溶液
酚酞溶液变红
(3)探究启示:
氢氧化钠必须 密封 保存.
15.(2013•云南大理八地)化学兴趣小组同学发现实验台上按如图所示顺序摆放着6瓶不同的无色溶液(如图所示:
A、B、C、D、E、F代表对应的溶液)。
其中E溶液的试剂瓶标签破损.为此,他们做了如下探究:
【提出问题】E溶液的成分是什么?
【初步判断】根据受损标签及实验室药品分类摆放原则,E溶液不可能是①(填序号)。
①酸;
②碱;
③盐
【提出猜想】猜想Ⅰ:
NaOH溶液;
猜想Ⅱ:
Na2CO3溶液;
猜想Ⅲ:
Na2SO4溶液;
猜想Ⅳ:
NaCl溶液(任写一种)。
【设计并实验】兴趣小组的同学为验证“猜想Ⅱ”是否正确,设计并完成如下表所示实验。
实验方案
实验一
实验二
实验三
实验操作
试纸变色,对照比色卡,pH>7
有无色无味气体产生
有白色沉淀产生
实验结论
猜想Ⅱ正确
【分析与推理】
①完成“实验一”后,李成同学即认为“猜想Ⅰ”正确,张平同学认为“猜想Ⅰ”不一定正确,他的理由是碳酸钠和氢氧化钠溶液均显碱性。
②何刚同学认为只需要完成“实验二”即可得出“猜想Ⅱ”正确的结论,你认为该说法不合理(填“合理”或“不合理”),理由是因NaOH溶液变质也会产生Na2CO3。
③请写出“实验三”中发生反应的化学方程式
Na2CO3+BaCl2=2NaCl+BaCO3↓。
【反思与评价】经过讨论,同学们认为“实验一”存在明显操作错误,该错误是把pH试纸浸入待测液;
观察发现D、E试剂瓶的瓶塞是橡胶塞,使用橡胶塞的原因是碱性物质易与玻璃中的SiO2发生反应的产物使瓶口与塞子粘合在一起。
【点拨】【初步判断】药品是按照酸碱盐顺序摆放的,该试剂瓶左侧是碱类物质右侧是盐类物质,该物质应该是碱或者盐类物质,该物质不可能为酸;
【提出猜想】该试剂中含有钠元素,若为碱,则为氢氧化钠;
若为盐,则为碳酸钠或是硫酸钠或氯化钠等;
【设计并实验】碳酸钠和氯化钡反应产生碳酸钡白色沉淀和氯化钠,现象为:
有白色沉淀产生;
【分析与推理】①氢氧化钠和碳酸钠溶液都显碱性,pH>7,无法判断;
②含有碳酸钠时会和盐酸反应生成二氧化碳,其方程式为:
Na2CO3+2HCl=2NaCl+CO2↑
+H2O;
因氢氧化钠易变质与空气中的二氧化碳反应会生成碳酸钠,判断该溶液是碳酸钠不妥当;
③碳酸钠和氯化钡反应产生碳酸钡沉淀和氯化钠;
【反思与评价】使用pH试纸测定溶液酸碱度时应该用玻璃棒蘸取待测液滴在试纸上,不应该浸入待测液中;
因碱性物质易与玻璃中的SiO2发生反应的产物使瓶口与塞子粘合在一起。
实验室盛放NaOH等碱性溶液的试剂瓶不能用玻璃塞。
16.(2014•广东广州)粗盐中除NaCl外还含有MgSO4以及泥沙等杂质。
初步提纯粗盐的实验流程如下:
(1)“滤渣”是粗盐中含有的泥沙。
(2)实验过程中四次用到玻璃棒,分别是:
第一次:
溶解时搅拌;
第二次:
过滤时引流;
第三次:
蒸发时搅拌;
第四次:
将精盐从蒸发皿转移出来。
四、分析与计算
17.(2014·
山东临沂)小明在实验室发现一瓶未知浓度的氢氧化钠溶液,为方便以后使用,他对其浓度进行了测定。
取20.0g此氢氧化钠溶液于烧杯中,逐滴滴加溶质质量分数为7.3%的稀盐酸,并随时对反应后的溶液用pH计(一种测定溶液pH的仪器)测定溶液的pH,所得数据如下表:
加入稀盐酸的质量/g
9.6
9.8
9.9
10.0
10.1
溶液的pH
12.4
12.1
11.8
7.0
2.2
试回答:
⑴当滴加稀盐酸的质量为9.8g时,溶液中的溶质是_氢氧化钠、氯化钠___。
⑵计算所测氢氧化钠溶液中溶质的质量分数。
解:
设20.0g此氢氧化钠溶液中溶质的质量为x。
PH=7.0时恰好反应。
NaOH+HCl=NaCl+H2O
4036.5
x7.3%×
10g
x=0.8g
所测氢氧化钠溶液中溶质的质量分数=0.8g÷
20.0g×
100%=4%
答:
所测氢氧化钠溶液中溶质的质量分数为4%。
【点拨】分析上表数据可知:
当滴加稀盐酸的质量为9.8g时,溶液的Ph=11.8,显碱性,溶液中一定存在氢氧化钠和反应生成的氯化钠。
酸碱正好完全反应时,消耗稀盐酸10.0g,其溶质质量分数为7.3%,根据化学方程式可求得氢氧化钠溶液中溶质的质量,又知所测氢氧化钠溶液的质量为20.0g,进而求出所测氢氧化钠溶液中溶质的质量分数。
2019-2020年中考化学专题复习一化学物质的多样性练习题
1.下列选项符合图示从属关系的是()
D
X
金属
溶液
纯净物
化石燃料
Y
单质
乳浊液
化合物
石油
2.下列对物质的分类正确的是()
A.松香、玻璃、沥青属于非晶体B.尿素、氨水、磷矿粉属于氮肥
C.白酒、雪碧、蒸馏水属于混合物D.橡胶、氯化钠溶液、石墨属于导体
3.下列分类正确的是()
A.蒸馏水和矿泉水:
硬水B.生铁和塑料:
合成材料
C.金
刚石和石墨:
碳单质D.氧化钾和碳酸钾:
盐类
4.对物质进行归类整理是化学学习的一种重要方法,下列归类关系不相符的是()
A.空气、海水——纯净物B.白磷、红磷——可燃物
C.不锈钢、铜——金属材料D.合成橡胶、塑料——有机合成材料
5.下列物质:
①空气、②硫酸、③氧气、④硫酸钠、⑤水、⑥氢氧化钠、⑦天然气、⑧生铁、⑨碳酸钙,对其分类完全正确的一组是()
A.混合物:
①⑥⑦⑧B.酸:
②④C.氧化物:
③⑤D.盐:
④⑨
6.分类是学习和研究化学的常用方法。
下列分类中正确的是()
A.有机物:
甲烷、乙醇、乙酸B.复合肥料:
尿素、硝酸钾、磷酸氢二铵
C.混合物:
煤、石油、冰水共存物D.合成材料:
合金、合成橡胶、合成纤维
7.下列物质的名称和俗名对应正确的是()
A.碳酸钙一纯碱B.氯化钠一食盐
C.碳酸钠一小苏打D.氧化钙一熟石灰
8.下列有关物质组成的说法正确的是()
A.煤气是由一氧化碳、甲烷、氢气等物质组成的混合物
B.葡萄糖不属于有机物
C.造成酸雨的主要物质是一氧化碳和二氧化碳
D.氢气和天然气都含有碳元素,都可以作燃料
二、填空题
1.学校化学实验室新购买的药品有:
白磷、铝片、乙醇、硝酸、氢氧化钠等。
(1)从物质分类的角度看:
属于金属单质的是;
属于有机物的是;
(2)从物质存放方法的角度看:
①白磷应保存在盛有的广口瓶中;
②硝酸保存在棕色细口瓶中,原因是见光易分解。
硝酸见光分解的化学方程式:
4HNO3
4X↑+O2↑+2H2O,其中X的化学式为;
③氢氧化钠要密封保存,因为敞口放置容易变质。
用化学方程式表示变质的原因。
2.如图是几种化合物通过一步反应转化为含锌化合物M的转化关系图.
(1)物质M属于 (填“酸”、“碱”或“盐”).
(2)写出转化②发生反应的化学方程式:
.
(3)写出符合转化①反应的规律:
.
3.写出符合下列要求的物质(或主要成分)的化学式:
相对分子质量最小的氧化物;
(2)铅蓄电池中含有的一种酸;
(3)会造成温室效应的气体;
(4)可以治疗胃酸过多的一种盐;
(5)一种钾肥。