高中化学工艺流程题Word文档下载推荐.docx
《高中化学工艺流程题Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《高中化学工艺流程题Word文档下载推荐.docx(21页珍藏版)》请在冰豆网上搜索。
②Fe3+、Cr3+完全沉淀(c≤1.0×
10-5mol·
L-1)时pH分别为3.6和5。
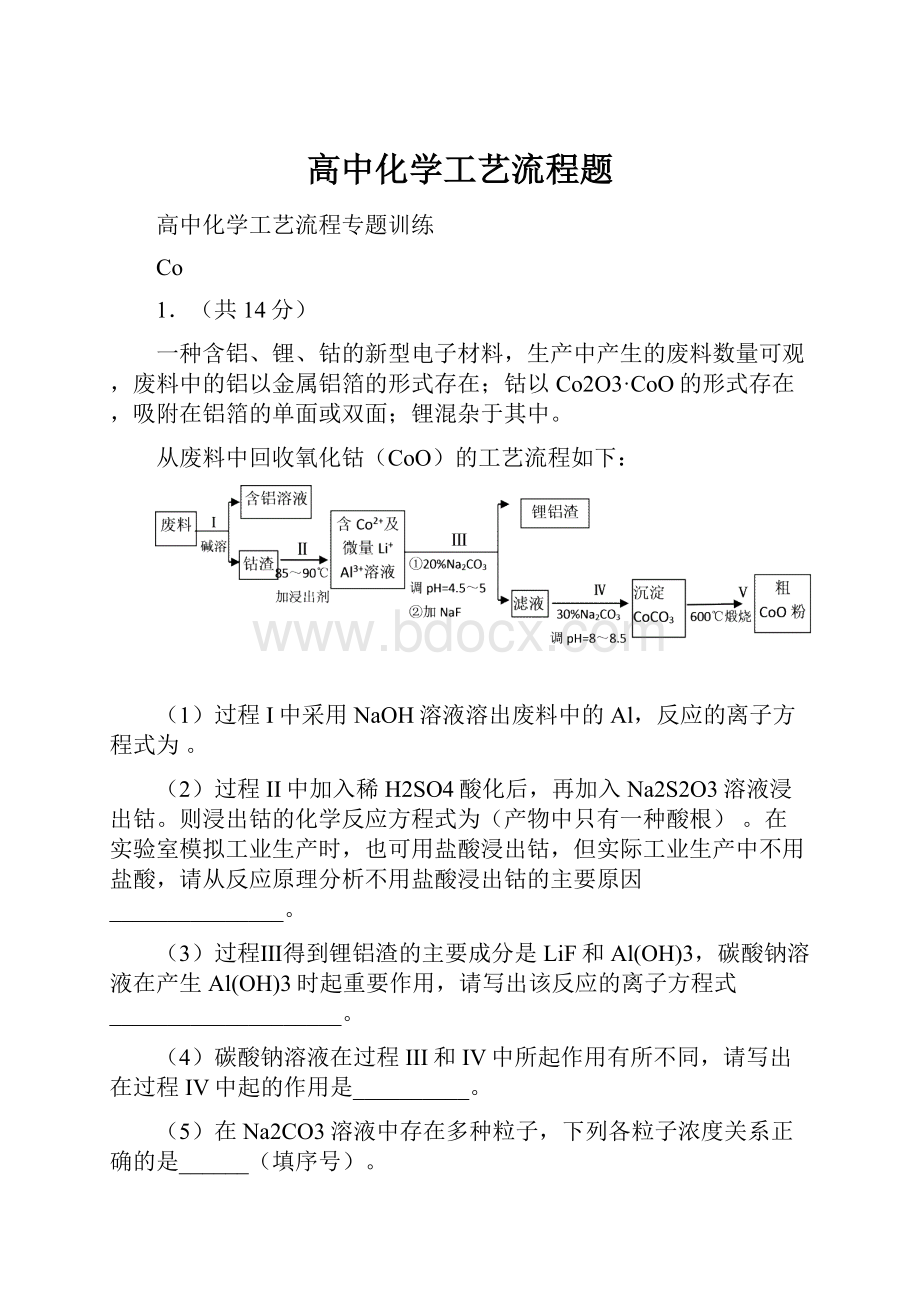
(1)“微热”除能加快反应速率外,同时还可以,滤渣A为(填化学式)。
(2)根据溶解度(S)∽温度(T)曲线,操作B的最佳方法为(填字母序号)
A.蒸发浓缩,趁热过滤
B.蒸发浓缩,降温结晶,过滤
(3)酸化后Cr2O72-可被SO32-还原成Cr3+,离子方程式为:
;
酸C为,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=。
(4)根据2CrO42-+2H+
Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的极,其电极反应式为 。
(17分)
(1)促进Fe3+水解生成Fe(OH)3而除去;
(2分)Fe(OH)3;
(2分)
(2)A(2分)
(3)3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;
(3分,化学式和配平错误0分)
H2SO4;
(2分)1.0×
10-32mol4·
L-4(2分,不带单位扣1分)
(4)正极,(2分)4OH--4e-=O2↑+2H2O(2分)(无“↑”扣分1分)
Cu
3.(13分)工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:
Cu2O+2H+=Cu+Cu2++H2O
沉淀物
Cu(OH)2
Al(OH)3
Fe(OH)3
Fe(OH)2
开始沉淀pH
5.4
4.0
1.1
5.8
沉淀完全pH
6.7
5.2
3.2
8.8
(1)固体混合物A中的成分是。
(2)反应Ⅰ完成后,铁元素的存在形式为。
(填离子符号)
请写出生成该离子的离子方程式。
(3)x、y对应的数值范围分别是、。
(4)电解法获取Cu时,阴极反应式为,阳极反应式为。
(5)下列关于NaClO调pH的说法正确的是。
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+H+
HClO,
ClO-消耗H+,从而达到调节pH的目的
c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+H2O
HClO+OH-,
OH-消耗H+,从而达到调节pH的目的
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,
该反应的离子方程式为。
(13分)
(1)SiO2、Cu(各1分)
(2)Fe2+(2分)
2Fe3++Cu=Cu2++2Fe2+(2分)
(3)3.2≤pH<4.05.2≤pH<5.4(各1分)
(4)Cu2++2e-=Cu2Cl--2e-=Cl2↑(各1分)
(5)b(2分)
(6)5ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4HClO(1分)
(或2Fe2++7ClO-+2H++5H2O=2Fe(OH)3+Cl-+6HClO)
Fe
4.(15分)绿矾(FeSO4·
7H2O)是治疗缺铁性贫血药品的重要成分。
下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
查询资料,得有关物质的数据如下表:
25℃时
pH值
饱和H2S溶液
3.9
SnS沉淀完全
1.6
FeS开始沉淀
3.0
FeS沉淀完全
5.5
(1)检验制得的绿矾晶体中是否含有Fe3+,最好选用的试剂为。
A.KSCN溶液B.NaOH溶液C.KMnO4溶液D.苯酚溶液
(2)操作II中,通入硫化氢至饱和的目的是;
在溶液中用硫酸酸化至pH=2的目的是。
(3)操作IV的顺序依次为、冷却结晶、。
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②。
(5)测定绿矾产品中Fe2+含量的方法是:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时盛放KMnO4溶液的仪器为(填仪器名称)。
②判断此滴定实验达到终点的方法是。
③计算上述样品中FeSO4·
7H2O的质量分数为。
(15分)
1)AD(2分)
(2)除去溶液中的Sn2+离子,并防止Fe2+被氧化(2分);
防止Fe2+离子生成沉淀(2分)
(3)蒸发浓缩(1分);
过滤洗涤(1分)
(4)降低洗涤过程中FeSO4·
7H2O的损耗(2分)
(5)①酸式滴定管(1分)
②滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色。
③0.975(2分)
Mg
5.(12分)轻质碳酸镁是广泛应用于橡胶、塑料、食品和医药工业的化工产品,以卤块(主要成分为MgCl2,含Fe2+、Fe3+、Mn2+等杂质离子)为原料制备轻质碳酸镁的工艺流程如下:
(1)“氧化”一步中发生反应的离子方程式为_______。
(2)“调节pH”一步应调节溶液的pH=9.8,其目的是_______。
(3)“热解”一步温度控制在75℃左右,其原因是_______。
(4)从“过滤2”步骤中得到的滤液中能回收的盐类物质主要有________(填化学式)。
表1 生成氢氧化物沉淀的pH
物质
开始沉淀
沉淀完全
2.7
3.7
7.6
9.6
Mn(OH)2
8.3
9.8
Mg(OH)2
9.9
11.1
注:
Fe(OH)2沉淀呈絮状,不易从溶液中除去。
(5)轻质碳酸镁的成分为碱式碳酸镁[MgCO3·
Mg(OH)2·
3H2O],则“热解”一步发生反应的离子方程式为_______。
(12分)
(1)ClO-+2H++2Fe2+===2Fe3++Cl-+H2O(2分)
(2)使Fe3+、Mn2+等杂质离子生成氢氧化物沉淀除去,且尽量避免Mg2+转化为沉淀。
(3)温度太低,反应速率慢,温度太高NH4HCO3会分解。
(4)NaCl、NH4Cl(4分)
(5)2Mg2++4HCO
+2H2O
MgCO3·
3H2O↓+3CO2↑(2分)
Mn
6.(14分)辉铜矿主要成分Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2,以及少量SiO2、Fe2O3等杂质。
研究人员开发综合利用这两种资源,用同槽酸浸湿法冶炼工艺,制备硫酸锰和碱式碳酸铜。
主要工艺流程如下:
①MnO2有较强的氧化性,能将Cu+氧化成Cu2+
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
Fe3+:
1.5~3.2Mn2+:
8.3~9.8Cu2+:
4.4~6.4
(1)实验室配制250mL4.8mol/L的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要_______________________________。
(2)酸浸时,为了提高浸取率可采取的措施有___________________(任写一点)。
(3)酸浸时,得到浸出液中主要含有CuSO4、MnSO4等。
写出该反应的化学方程式
__________________________________________________________________。
(4)调节浸出液pH=4的作用是__________________________________________。
(5)本工艺中可循环使用的物质是(写化学式)____________________________。
(6)获得的MnSO4·
H2O晶体后常用酒精洗涤,主要目的是_____________________。
(7)用标准的BaCl2溶液测定样品中MnSO4·
H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有__________________(任写一种)。
(14分)
(1)250mL容量瓶(1分)、胶头滴管(1分)
(2)粉碎矿石或适当升高温度或搅拌(答案合理均给分)
(3)Cu2S+2MnO2+4H2SO4=2CuSO4+2MnSO4+S↓+4H2O
(4)使Fe3+完全生成Fe(OH)3沉淀(5)NH3
(6)减少MnSO4·
H2O晶体的损失
(7)混有硫酸盐杂质或部分晶体失去结晶水
Pd
7.(11分)有机合成中常用的钯/活性炭催化剂若长期使用,会被铁、有机化合物等杂质污染而失去活性,成为废催化剂。
一种由废催化剂制取PdCl2的工艺流程如下:
(1)“焙烧1”通入空气的目的是________________。
(2)甲酸在反应中被氧化为二氧化碳,写出甲酸与PdO反应的化学方程式:
____。
(3)加入浓氨水的过程中,需要控制溶液的pH为8~9,实验室中检测溶液pH的简单方法是________________。
(4)写出“焙烧2”发生反应的化学方程式:
(5)Pd中加入王水的反应可以表示为Pd+HCl+HNO3―→A+B↑+H2O(未配平)。
其中B为无色有毒气体,该气体在空气中不能稳定存在;
A中含有三种元素,其中Pd元素的质量分数为42.4%,H元素的质量分数为0.8%。
则A的化学式为____。
(11分)
(1)使有机化合物等可燃物通过燃烧而除掉(2分)
(2)HCOOH+PdO===Pd+CO2↑+H2O(2分)
(3)用洁净的玻璃棒蘸取待测液滴在pH试纸上(2分)
(4)Pd(NH3)2Cl2
2NH3↑+PdCl2(2分)
(5)H2PdCl4(3分)
Sn
8.(13分)硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。
某研究小
组设计SnSO4制备路线如下:
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡
回答下列问题:
(1)锡原子的核电荷数为50,与碳元素属于同一主族,锡元素在周期表中的位置是。
(2)操作Ⅰ是。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因。
(4)加入Sn粉的作用有两个:
①调节溶液pH②。
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是。
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是。
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:
Sn+2HCl===SnCl2+H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2+K2Cr2O7+14HCl===6FeCl3+2KCl+2CrCl3+7H2O
取1.226g锡粉,经上述各步反应后,共用去0.100mol/LK2Cr2O7溶液32.0ml。
锡粉中锡的
质量分数是。
(1)五周期ⅣA族(1分)
(2)加热浓缩、冷却结晶、过滤、洗涤(2分)
(3)SnCl2+H2O
Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解(2分)
(4)防止Sn2+被氧化(2分)
(5)Sn2++CO32-===SnO↓+CO2↑(2分)
(6)Sn2++H2O2+2H+===Sn4++2H2O(2分)
(7)93.1%
Ti
9.(14分)二氧化钛广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备钛单质的原料。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:
可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下:
(1)Fe2O3与H2SO4反应的离子方程式是_________________________________。
(2)甲溶液中除含TiO2+之外还含有的金属阳离子有__________________。
(3)加Fe的作用是_________________________________。
方法2:
TiCl4水解生成TiO2·
xH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2,此方法制备得到的是纳米二氧化钛。
(4)①TiCl4水解生成TiO2·
xH2O的化学方程式为_______________________________;
②检验TiO2·
xH2O中Cl-是否被除净的方法是______________________________。
Ⅱ.二氧化钛可用于制取钛单质
(5)TiO2制取单质Ti,涉及到的步骤如下:
反应②的方程式是,该反应需要在Ar气氛中进行,请解释原因:
_____________。
(14分,每空2分)
(1)Fe2O3+6H+=2Fe3++3H2O
(2)Fe3+、Fe2+
(3)将Fe3+转化为Fe2+
(4)①TiCl4+(x+2)H2O(过量)
TiO2·
xH2O↓+4HCl(写==不扣分)
800℃
②取少量水洗液,滴加硝酸酸化的AgNO3溶液,不产生白色沉淀,说明Cl-已除净。
(5)TiCl4+2Mg====2MgCl2+Ti
防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用
V
10.(17分)钒及化合物用途广泛。
工业上常用含少量Al2O3的钒铁矿(FeOV2O5)碱熔法提取V2O5。
简要流程如下:
①焙烧时可发生反应:
V2O5+Al2O3+2Na2CO3
2NaVO3+2NaAlO2+2CO2
②常温下物质的溶解度:
NaVO3~21.2g/100g水;
HVO3~0.008g/100g水
(1)“浸出渣B”的主要成分是。
(写化学式)
(2)生产中,不直接用H2SO4浸泡“烧渣A”获取HVO3的原因是。
(3)“操作①”包括、洗涤。
如果不洗涤,则产品中可能含有的金属阳离子是、
。
下列装置(部分夹持仪器省去)可用在实验室进行“操作②”的是。
(填序号)
ABCD
(4)NaVO3用于原油的脱硫技术,由V2O5溶于NaOH溶液中制取,反应的离子方程式
为。
(5)V2O5还可用于将硅铁炼成钒铁。
生产中加入CaO可节能减排。
有关反应如下:
2V2O5(l)+5Si(s)+5CaO(s)=4V(s)+5CaSiO3(s);
△H1=-2096.7kJ/mol
已知:
CaSiO3(s)=CaO(s)+SiO2(s);
△H2=+92.5kJ/mol
则:
2V2O5(l)+5Si(s)=4V(s)+5SiO2(s);
△H3=。
(1)Fe2O3或Fe3O4,或者Fe2O3和Fe3O4(2分)
(2)H2SO4与NaVO3反应生成难溶的HVO3,HVO3包裹在一些烧渣的表面,阻碍了反应的进行,从而降低了HVO3产率,且使产生的HVO3不纯。
另外,铁的氧化物会和硫酸反应生成铁离子,增加干扰离子,消耗硫酸,浪费资源。
(4分)
(3)过滤(2分)Na+、Al3+(2分)D(2分)
(4)V2O5+2OH
2VO3-+H2O(3分)(可以没有加热符号)
(5)-1634.2kJ/mol(2分)
Y
11.(14分)稀土元素是周期表中IIIB族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3。
其中钇(Y)元素是激光和超导的重要材料。
我国蕴藏
着丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:
①有关金属离子形成氢氧化物沉淀时的pH如下表:
[来源:
GkStK.Com]
开始沉淀时的pH
完全沉淀时的pH
Fe3+
Y3+
6.0
8.2
②在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)钇矿石(Y2FeBe2Si2O10)的组成用氧化物的形式可表示为。
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀。
则
①最好选用盐酸、(填字母)两种试剂,再通过必要的操作即可实现。
a.NaOH溶液b.氨水c.CO2气d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:
(3)为使Fe3+沉淀完全,须用氨水调节pH=a,则a应控制在的范围内;
继续加氨水调节pH=b发生反应的离子方程式为,检验Fe3+是否沉淀完全的操作方法是。
(14分)
(1)Y2O3·
FeO·
2BeO·
2SiO2(2分)
(2)①b(2分)②:
BeO22-+4H+=Be2++2H2O(3分)
(3)3.7<
a<
6.0(2分)Y3++3NH3·
H2O=Y(OH)3↓+3NH4+(3分)
取少量滤液,滴加几滴KSCN溶液,观察溶液是否变为血红色,若不变血红色,则说明Fe3+完全沉淀,反之则未完全沉淀(2分)
Zn
12.(14分)工业上用闪锌矿(主要成分为ZnS,还含有Fe2O3等杂质)为原料生产ZnSO4·
7H2O的工艺流程如下:
(1)滤渣A经CS2提取后可获得一种淡黄色副产品,其化学式为。
(2)浸取过程中Fe2(SO4)3的作用是。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为。
该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是。
(4)置换法除重金属离子所用物质C为。
(5)硫酸锌的溶解度与温度之间的关系如下表:
温度/℃
20
40
60
80
100
溶解度/g[来
41.8
54.1
70.4
74.8
67.2
60.5
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为、、过滤、干燥。
(1)S
(2)做氧化剂
(3)4Fe2++O2+6H2O=4FeOOH+8H+增大空气与溶液的接触面积,加快反应速率。
(4)Zn(锌)(5)60℃条件下蒸发浓缩、降温结晶(每空2分)
Zr
13.(16分)
锆产业是极有发展潜力及前景的新兴产业,锆(Zr)元素是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷。
我国有丰富的锆英石(ZrSiO4),含Al2O3、SiO2、Fe2O3等杂质,生产锆流程之一如下:
试回答下列问题:
(1)写出上述流程中高温气化的反应方程式(碳转化成CO):
;
(2)写出ZrOCl2•8H2O在900℃生成ZrO2的反应方程式;
(3)关于二氧化锆纳米陶瓷和锆合金的说法不正确的是(单选);
A.二氧化锆纳米陶瓷是新型无机非金属材料
B.1纳米=10-10米
C.锆合金的硬度比纯锆要高
D.日本福岛核电站的爆炸可能是由锆合金在高温下与水蒸气反应产生的氢气爆炸引起
(4)一种新型燃料电池,一极通入空气,另一极通入丁烷;
电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。
在熔融电解质中,O2-向(填正负)极移动。
电池正极电极反应为:
,负极电极反应为:
(16分)
900℃℃
(1)4C+4Cl2+ZrSiO4====ZrCl4+SiCl4+4CO(3分)
(2)ZrOCl2•8H2O====ZrO2+2HCl↑+7H2O↑(3分)
(3)B(2分)
(4)负(2分),O2+4e-=2O2-(3分),C4H10-26e-+13O2-=4CO2+5H2O(3分)
CSi
14.(16分)
硫酸工业中废渣的成分为SiO2、Fe2O3、Al2O3、MgO。
某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。
阳离子以氢氧化物形式完全沉淀时溶液的pH: