化学第3章《自然界中的元素》复习教案鲁科版必修1Word格式.docx
《化学第3章《自然界中的元素》复习教案鲁科版必修1Word格式.docx》由会员分享,可在线阅读,更多相关《化学第3章《自然界中的元素》复习教案鲁科版必修1Word格式.docx(9页珍藏版)》请在冰豆网上搜索。
二、氮的循环
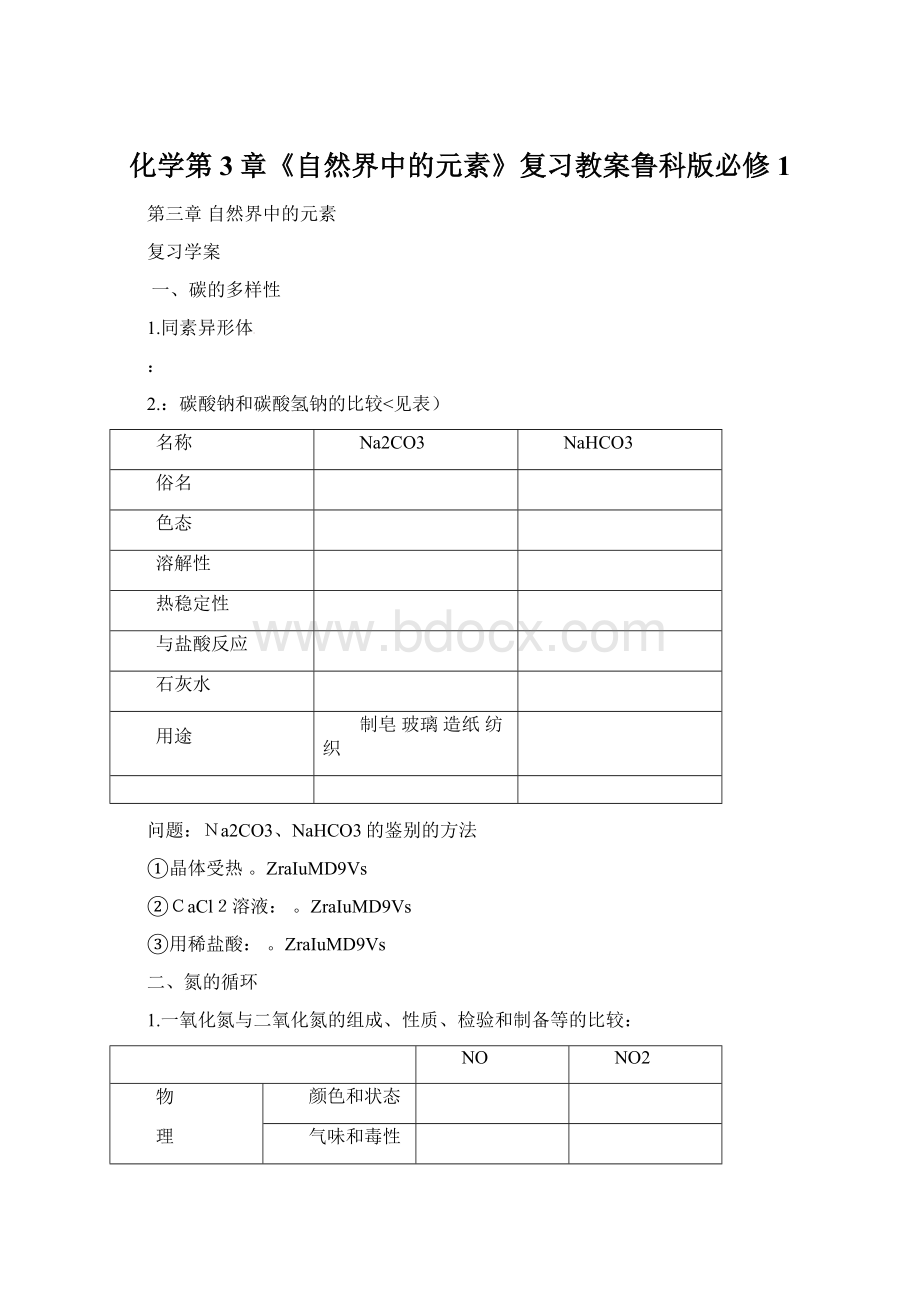
1.一氧化氮与二氧化氮的组成、性质、检验和制备等的比较:
NO
NO2
物
理
性
质
颜色和状态
气味和毒性
密度比较
在水中的溶解性
化
学
与氧气反应
与水反应
自身反应
检验方法
相互转化
实验室制备方法
对人体和环境的危害及污染
2.氨、氨水、铵盐的有关问题
<
1)氨气或液氨溶于水得氨水,氨水的密度都比水,并且氨水越浓密度越,计算氨水浓度时,溶质是。
2)氨水是混合物,溶液中存在的微粒有:
三种分子:
三种离子:
3)氨水是电解质溶液,但电解质是NH3﹒H2O,不是NH3。
4)氨水受热可放出氨气。
保存时应密封放于阴凉处。
喷泉实验
1)喷泉实验的原理:
是利用气体极易被一种液体吸收而形成压强差,使气体容器(烧瓶)内压强降低,外界大气压把液体压入气体容器内,在玻璃导管尖嘴处开成美丽的“喷泉”。
2)能否做喷泉实验应从气体和吸收剂<
液体)两方面考虑。
凡是易溶于水的气体,如HCl、HBr、NH3等,极易溶于水的气体都可作喷泉实验。
对那些在水中溶解度不大的气体,只要选取合适的吸收剂,同样也可作喷泉实验。
如烧瓶中充满CO2、SO2、Cl2等酸性气体时,用NaOH溶液作吸收剂,也形成喷泉。
因此ZraIuMD9Vs
3)喷泉实验成功的关键:
①;
②;
③
喷泉实验后溶液单位物质的量浓度计算:
3.NH4+化性:
与碱反应<
是离子反应的写出离子方程式)
硫酸铵与NaOH溶液加热________________________________
碳酸铵与NaOH溶液混合
氯化铵固体与消石灰混合加热
NH4Cl受热分解方程式,遇冷时又生成
受热分解生成NH3、CO2、H2O的铵盐为
注:
铵盐都不稳定,受热易分解,但并不是所有的铵盐受热都能放出NH3。
铵盐与碱共热都能产生NH3,这是铵盐的共同性质。
氮肥施用时注意:
1.
2.。
4.硝酸的强氧化性:
浓、稀硝酸的化学性质:
①浓、稀硝酸均具有强氧化性;
②金属与硝酸反应均不产生氢气;
③金属与浓硝酸反应,还原产物一般为;
与稀硝酸反应,还原产物一般为;
而金属被氧化为相应的硝酸盐;
浓硝酸与某些非金属反应时,非金属一般被氧化为最高价氧化物,若最高价氧化物易溶于水,则生成相应的含氧酸。
在浓硝酸中放入铜片:
1)反应开始时的离子方程式为
实验现象
2)若铜有剩余
,则反应将要结束时的离子方程式为
3)待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,原因是
C与浓HNO3反应化学方程式为
不稳定性:
浓HNO3常
呈色,且应贮于瓶中,置于处。
必须这样保存的试剂还有ZraIuMD9Vs
三、硫的转化
1.硫为固体,不溶于易溶于微溶于,写出S与Fe、Cu反应的化学方程式ZraIuMD9Vs
下列化合物中,不能由两种单质直接化合生成的是
A.FeCl2B.CuCl2C.Na2SD.Na2O2E.SO3F.CuS
2.二氧化硫与二氧化碳性质比较
1)物理性质
相同点:
不同点:
二氧化碳气味,二氧化硫气味;
二氧化碳毒,二氧化硫毒;
二氧化碳溶于水<
1体积水大约溶解体积气体),二氧化硫溶于水<
1体积水大约溶解体积气体);
二氧化硫液化。
2)化学性质
都是氧化物。
1都能和水反应,生成的酸不稳定,只能存在于溶液中。
方程式
②都能与碱反应,用量比不同,可以生成两种盐。
SO2、CO2气体通入澄清石灰水中,都是先,当SO2、CO2过量时又。
SO2与少量和过量NaOH溶液反应的离子方程式
不同点:
①二氧化硫常表现还原性,二氧化碳表现氧化性
举例
二氧化硫能被高锰酸钾、氯水、溴水、碘水等氧化剂氧化,二氧化碳不能。
SO2与溴水、碘水反应的离子方程式
②二氧化硫具有漂白性,能漂白某些有色物质,二氧化碳能。
③造成环境破坏的原因不同:
形成酸雨,引起温室效应。
⑤SO2的漂白性:
可使品红或其它有色物质褪色,其褪色原理主要是和有机色质形成不稳定的无色化合物,受热后无色化合物又分解,恢复原来的红色。
注意:
常见漂白性物质根据漂白
原理的不同,大致可分为三类:
1)氧化型:
漂白剂本身是一种强氧化剂,能将许多有色物质成无色物质。
这种漂白是彻底的,不可逆的。
此类物质有:
HClO、Ca<
ClO)2等次氯酸盐、Na2O2、H2O2、O3等。
2)加合型:
漂白剂与某些有色物质成无色物质,但这种无色物质在受热、光照等因素的影响下,会发生分解恢复原色。
所以这种漂白可逆、不彻底。
此类物质主要是SO2。
SO2不漂白酸碱指示剂。
3)吸附型:
有些物质的固体疏松多孔,具有较大的表面积,可以吸附一些有色物质或有色离子并使之褪色,属物理变化。
活性炭、胶体等
。
说明:
①浓HNO3有较强的氧化性,也能将一些有色物质氧化褪色。
如在浓HNO3中滴几滴石蕊试液,先后立即。
但因HNO3有较强的腐蚀性,不宜用作漂白剂,因此不能说浓HNO3有漂白性。
同样,不能笼统地将有褪色能力的物质说成具有漂白性。
②漂白是指使有机色质褪色,使无机色质褪色<
如溴水、KMnO4、CuSO4·
5H2O)不称为漂白作用。
1)将二氧化硫分别通入下列溶液中,把产生的现象与其体现的性质填入下表空格中:
溶液
石蕊试液
加有酚酞的氢氧化钠溶液
KMnO4酸性溶液
溴水
品红溶液
现象
SO2的性质
2)木炭与热浓硫酸反应的三种产物分别应用什么试剂一一鉴出?
3)<
如上图)碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中,下列有关说法正确的是(
>
A.洗气瓶中产生的沉淀是碳酸钡
B.在Z导管出来的气体中无二氧化碳
C.洗气瓶中产生的沉淀是硫酸钡
D.在Z导管口有红棕色气体出现
3.
硝酸和硫酸的性质:
浓H2SO4具有3个特性
浓H2SO4和硝酸的化学性质的相似性有
浓、稀H2SO4的粒子组成及氧化性比较
稀硫酸
浓硫酸
主要粒子
与金属反应
与碳反应
Ⅰ.氧化性酸和酸的氧化性之别:
a.氧化性酸是指酸根部分易得电子的酸,是相对于非氧化性酸而言的。
例如:
硝酸、浓硫酸、次氯酸等
b.酸的氧化性是指酸中的H+具有得电子的性质
Ⅱ.浓硫酸
a.浓硫酸与金属反应一般不产生氢气
b.浓硫
酸被还原生成二氧化硫
c.金属被氧化生成金属硫酸盐<
变价金属Cu、Fe生成高价盐)
区别浓、稀H2SO4的方法有哪些?
四、海水中的化学元素
1.常量元素微量元素
海洋元素国防金属
2镁的性质:
镁的化学性质:
镁是较活泼的金属,有较强的还原性。
在空气中燃烧的化学方程式为
现象
3.氯、溴、碘的性质及其变化规律
相似性:
(1>
与绝大多数金属金属反应反应
(2>
一定条件下均可与氢气反应:
(3>
Cl2、Br2、I2均可与水反应:
ZraIuMD9Vs
(4>
与水反应:
2.递变性
(1>
与氢气反应:
反应条件由易到难;
反应程度由剧烈变为缓慢;
卤化氢的稳定性逐渐减弱。
(2>
与水反应:
氟特殊,氯、溴、碘相似。
反应的剧烈程度逐渐减弱
(3>
卤素单质间的置换反应
Cl2、Br2、I2氧化性:
Cl-、Br-、I-还原性:
有关的离子方程式
五、有关物质的制备:
1.NH3实验室制法:
原理
装置:
发生装置同制氧气;
收集:
向排空气法,管口出塞
一团棉花的作用。
检验:
a:
;
b:
干燥:
不能用、作干燥剂,因为CaCl2与NH3反应生成CaCl2·
8NH3,P2O5能与H2O、NH3反应生成磷酸盐,浓H2SO4与NH3反应生成(NH4>
2SO4。
通常用碱石灰作干燥剂。
实验室制NH3的其他方法:
尾气:
工业制NH3法:
2.SO2实验室制法:
发生装置同制氢气;
向排空气法。
用作干燥剂
实验室制SO2的其他方法:
工业制SO2法:
3.实验室制NO2的方法:
4.实验室制NO的方法:
六、有关环境问题:
1.溶洞的形成的化学反应为
2.硫酸型酸雨的形成的化学反应为
硝酸型
3.光化学烟雾成因
4.雷雨发庄稼的化学反应为:
七、物质或离子的检验
1.NH3的检验:
1).
<
2).
2.SO2的检验
3.NH4+的检验:
检验方法:
离子方程式___________________________________
4.SO42-的检验:
1)检验SO42用Ba2+和H+。
试剂具有选择性。
2)检验SO42-的正确操作为:
5.X-的检验:
硝酸银溶液和稀硝酸
6.HCO3-、CO32-的检验:
申明:
所有资料为本人收集整理,仅限个人学习使用,勿做商业用途。