1化学第一章课时练Word格式文档下载.docx
《1化学第一章课时练Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《1化学第一章课时练Word格式文档下载.docx(17页珍藏版)》请在冰豆网上搜索。
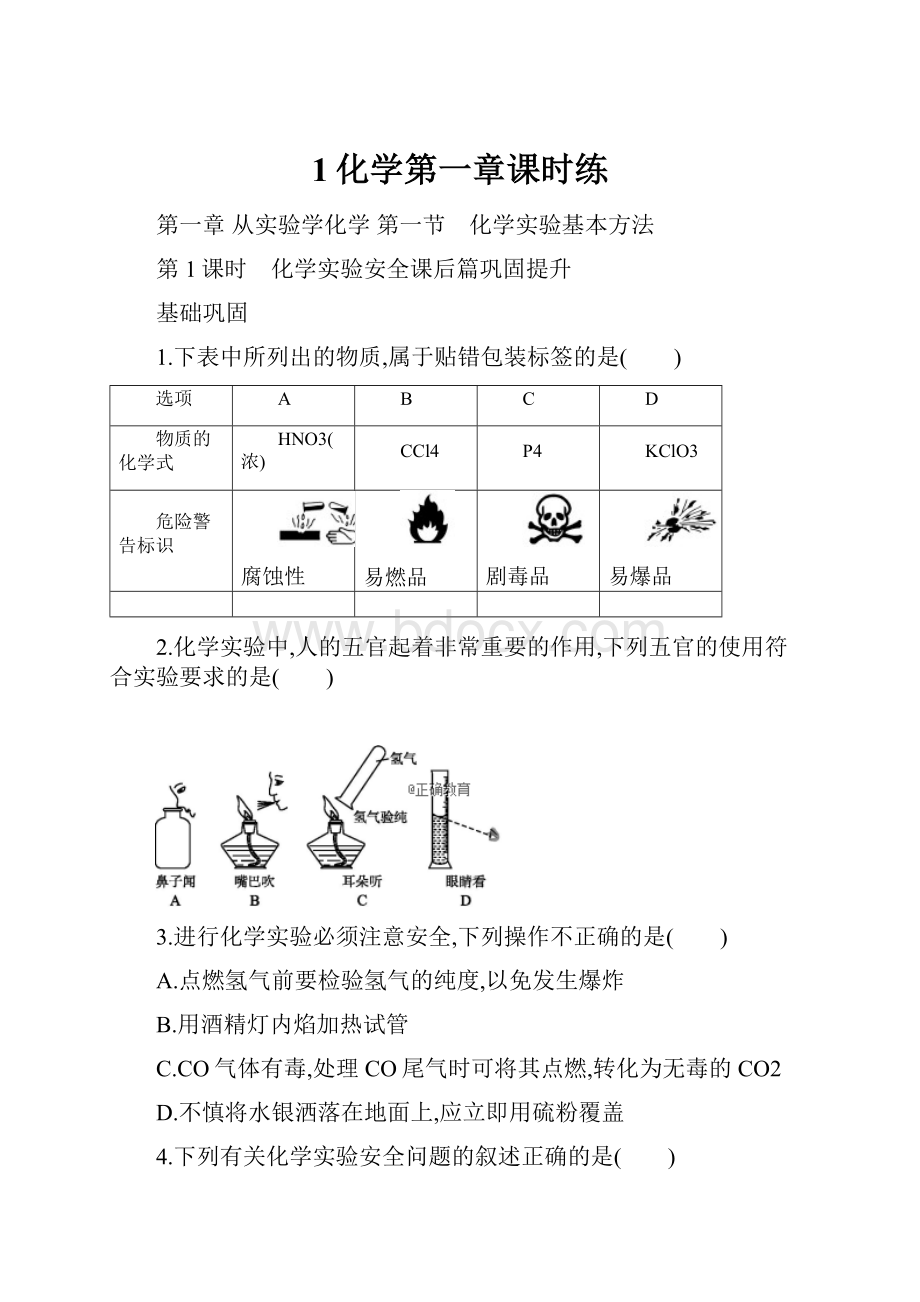
B.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上稀硼酸溶液
C.用图2的方法检验H2的可燃性
D.用图3的方法配制硫酸溶液
7.化学实验中安全意识是重要的科学素养之一。
请完成下列关于化学实验安全的有关问题:
(1)用酒精灯或电炉对下列实验仪器加热时,可以不垫石棉网的是 。
A.烧杯B.蒸发皿
C.圆底烧瓶D.蒸馏烧瓶
(2)下列做法正确的是 (填序号)。
①蒸发时,用手直接移取蒸发皿
②用排水法收集O2结束时,先撤酒精灯,再撤导气管
③给试管中的液体加热时,试管口不要朝着任何人
④向燃着的酒精灯中添加酒精
⑤熄灭酒精灯时用灯帽盖灭
(3)实验室用锌与稀硫酸反应制取H2,如何检验H2的纯度?
点燃前,为什么要检验H2的纯度?
能力提升
1.掌握化学实验中常用仪器的特征和用途,有利于开展化学学习和研究。
请从下列常见仪器中,选择恰当的字母序号填空:
(1)可以直接在酒精灯火焰上加热的玻璃仪器是 。
(2)镁条燃烧时,用来夹持镁条的仪器是 。
(3)用酒精灯加热时需要垫上石棉网的仪器是 。
(4)取用粉末状固体药品用到的仪器是 。
(5)吸取和滴加少量液体试剂的仪器是 。
(6)排空气法收集气体用到的玻璃仪器是 。
2.如图所示是中学化学实验中常见的装置,它有多种用途。
(1)若瓶中装有X溶液,将CO和CO2的混合气体由a管口通入,用以除去CO2,则X为 。
A.H2SO4B.NaOH
C.NaClD.HCl
(2)若用排空气法收集H2,则H2应从 (填标号,下同)管口导入;
若用排空气
法收集CO2,则CO2应从 管口导入。
(3)医院里给病人输氧时,往往在氧气钢瓶与病人呼吸面具之间安装盛有水的该装置,观察气泡冒出的情况,以便调节供氧速率,此时氧气应从 管口导入。
3.今有A、B、C、D、E、F六种装置,如图所示。
(胶塞、导管可自由选用)
(1)写出①~④的仪器名称:
① ,②
③ ,④ 。
(2)实验室用KMnO4制取并收集氧气时应选择 和 相连接,制取并收集氢气时应选择 和 相连接。
(3)做木炭还原氧化铜并检验生成气体的实验,应选择 和 相连
接,检验气体时观察到的实验现象是 。
(4)制取氢气并做还原氧化铜的实验结束时应先停止加热,待试管冷却后,再停止
通氢气,其原因是 。
4.通常状况下,CO是一种无色、无味、有毒的气体,难溶于水,与酸、碱、盐溶液均不反应。
酒精喷灯可用作高温热源。
正确连接如图所示的装置进行实验,可以验证某混合气体的成分是CO2和CO(每套装置限用一次)。
请回答下列问题:
(1)连接装置导管口的顺序:
混合气体→ →尾气处理(填导管接口代号)。
(2)证明原混合气体中CO2存在的实验现象是 ;
证明CO存在的有关反应的化学方程
式是 。
(3)有同学提出仪器B应再使用一次,你认为有道理吗?
(填“有”或“没有”),并简述理由 。
(4)本实验尾气处理的方法
是
。
第2课时 过滤和蒸发课后篇巩固提升
1.在生活、工农业生产中都会用到物质分离的方法,下列分离方法与过滤原理相同的是( )
A.含有泥沙的浑水,静置一会儿水沙分离,可取得上层的清水
B.农村“扬谷”分离饱满的谷粒和干瘪的谷壳
C.建筑工地上用铁筛把大小不同的沙粒分开
D.淘米除去米中混有的小沙粒
2.在粗盐的提纯实验中,下列说法正确的是( )
A.该实验得到的NaCl中无其他任何杂质
B.检验所得NaCl中是否混有BaCl2,可用AgNO3溶液
C.该实验分为溶解、过滤和蒸发三个步骤
D.除去杂质时,不必考虑所加试剂的顺序
3.下列物质分离和提纯的方法属于化学分离提纯法的是( )
A.分离沙子和食盐水溶液B.分离溶于水中的氯化钠
C.从氯化钠和硝酸钾的混合物中提纯硝酸钾
D.将O2和CO2的混合气体通入NaOH溶液中除去CO2
4.下列实验操作中一定要用到玻璃棒的是( )
①过滤 ②蒸发 ③溶解 ④取液体试剂 ⑤取固体试剂
A.①②③B.④⑤C.①④D.①③⑤
5.可以用水、烧杯、玻璃棒、过滤器等在常温或加热下分离的物质是( )
A.CaO、CaCO3B.BaSO4、NaClC.Fe、AgClD.NH4NO3、K2SO4
6.用下列实验装置进行相应实验,能达到实验目的的是( )
A.用图①和图④完成NaCl中Na2SO4杂质的除去
B.用图①和图②完成粗盐中不溶物的除去
C.用图③制备纯净的氢气
D.用图④除去CO2中含有的HCl杂质
7.关于粗盐提纯的下列说法中正确的是( )
A.溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解
B.滤去不溶性杂质后,将滤液移至坩埚内加热浓缩
C.当蒸发到蒸发皿中出现较多固体时,停止加热,利用余热将液体蒸干
D.将制得晶体转移到新制的过滤器中用大量水进行洗涤
8.实验室制取氧气的反应为2KClO3
2KCl+3O2↑,反应后从剩余物中回收纯净的二氧化锰的操作顺序正确的是(已知MnO2为黑色、难溶于水的固体)( )
A.溶解、过滤、蒸发、洗涤B.溶解、过滤、洗涤、干燥
C.溶解、蒸发、洗涤、过滤D.溶解、洗涤、过滤、加热
9.提纯含有少量硝酸钡杂质的硝酸钾溶液,设计实验方案为溶液
KNO3溶液
则X为( )
A.Na2CO3B.K2CO3C.Na2SO4D.K2SO4
10.为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是( )
序号
物质
杂质
除杂试剂或操作方法
①
NaCl溶液
Na2CO3
加入盐酸,蒸发
②
FeSO4溶液
CuSO4
加入过量铁粉并过滤
③
H2
CO2
依次通过盛有NaOH溶液和浓硫酸的洗气瓶
④
NaNO3
加稀硫酸溶解、过滤、蒸发、结晶
A.①②③B.②③④C.①③④D.①②④
11.除去下列物质中混有的少量杂质(杂质不要求回收),把适当的试剂、操作方法的序号写在相应的括号内。
a.加适量盐酸、过滤 b.加适量水、过滤、蒸发
c.加适量水、过滤、干燥 d.加热(高温或灼烧) e.加适量盐酸、蒸发 f.冷却热的饱和溶液、过滤
(1)碳酸钙中混有少量的碳酸钠( )
(2)氯化钾粉末中混有碳酸钾( )
(3)氧化钙中混有少量的碳酸钙( )
(4)二氧化锰中混有少量的炭粉( )
(5)硝酸钾中混有少量的食盐( )
12.根据图中所示的溶解度曲线,回答下列问题。
(1)氯化钠和Na2CO3晶体均属于 (填“易溶”“可溶”“微溶”或“难溶”)物质。
(2)我国某些盐湖里出产天然碱(主要成分为Na2CO3晶体,并含少量氯化钠杂质),在实验室里从天然碱中分离出较纯的Na2CO3晶体,应采用 的方法(杂质仅考虑氯化钠)。
(3)具体的实验操作步骤:
①加热溶解,② ,③ ,④洗涤晾干。
(4)完成①~③必备的实验仪器有铁架台(附铁圈、石棉网等)、烧杯、玻璃棒和 、 等。
1.某溶液中含有较大量的Cl-、C
、OH-三种阴离子,如果只取一次该溶液就能够分别将三种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加足量的Mg(NO3)2溶液 ②过滤 ③滴加适量的AgNO3溶液 ④滴加足量的Ba(NO3)2溶液
A.①②④②③B.④②①②③
C.①②③②④D.④②③②①
2.氯碱厂的原料工业食盐因含CaCl2、MgCl2等杂质,使用前必须精制,回答下列有关问题:
(1)精制过程中发生反应的化学方程式为
。
(2)如果粗盐中S
含量较高,必须添加含钡试剂除去S
该含钡试剂可以是
(填字母代号)。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(3)为有效除去CaCl2、MgCl2以及S
加入试剂的合理顺序为 (填字母代号)。
A.先加过量NaOH溶液,后加过量Na2CO3溶液,再加过量含钡试剂,过滤后加入稍过量的稀盐酸
B.先加过量NaOH溶液,后加过量BaCl2溶液,再加过量Na2CO3溶液,过滤后加入稍过量的稀盐酸
C.先加过量NaOH溶液,后加过量BaCl2溶液,再加过量Na2CO3溶液,过滤后加入稍过量的稀硝酸
3.工业上用电解法生产烧碱的主要原料是饱和食盐水,它是将粗盐溶解在水中,通过分离和提纯制成的。
由于粗盐中含有泥沙、CaCl2、MgCl2、Fe2(SO4)3等杂质,不符合电解的要求,因此必须进行精制。
首先将粗盐水过滤除去泥沙,再用化学试剂进一步净化处理。
(1)如何运用最简方法检验过滤后的溶液中有无S
?
(2)净化过程中下列化学药品中可以选用的是 (填写代号)。
A.Ba(NO3)2溶液 B.BaCl2溶液 C.NaOH溶液
D.K2CO3溶液 E.Na2CO3溶液 F.稀盐酸 G.稀硫酸
(3)你设计加入化学试剂的先后顺序是 。
在加入某种化学试剂之前,还必须增加一种物理除杂方法,这种化学试剂的名称是 ,这种物理除杂方法的名称是 。
要在实验室中实施这种除杂方法,所用到的玻璃仪器有 。
(4)经过科学论证,上述净化食盐水的方案合理,又通过更加精确的实验方法对净化后的食盐水进行成分分析,发现其中CaCl2、MgCl2的含量还是超标,必须进一步降低其含量。
对此,下列说法中正确的是 。
A.对盐水进行过滤
B.再从上述
(2)中选取化学试剂除杂
C.查找资料或访问专家,采用更加先进科学的方法除杂
4.现有NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、S
和N
的相互分离,实验过程如下:
(1)写出上述实验过程中所用试剂的名称:
试剂1为 ,试剂2为 ,试剂4为 。
(2)加入过量试剂3的目的是 。
(3)在加入试剂4后,获得晶体D的实验操作④的名称是 。
5.某同学设计如下实验方案以分离KCl和BaCl2两种固体的混合物。
试回答下列问题:
(1)B的化学式为 。
(2)该方案的明显失误是因某一步设计不当而使分离的产物KCl不纯,该步骤是
(填序号),改进措施是往滤液中滴加适量 以除去多余的杂质离子再结晶。
(3)写出②④两步中对应的化学方程式:
② ;
④ 。
第3课时 蒸馏和萃取课后篇巩固提升
1.现有一瓶甲和乙的混合物,已知甲和乙的某些性质如下表:
分子式
熔点/℃
沸点/℃
在水中的
溶解性
甲
C3H6O2
-98
57.5
0.93
可溶
乙
C4H8O2
-84
77
0.90
据此,将甲和乙互相分离的最佳方法是( )
A.萃取法B.升华法C.蒸馏法D.分液法
2.在实验室中将浑浊的自来水制成蒸馏水,最好的方法是( )
A.过滤B.萃取
C.蒸发D.先过滤后蒸馏
3.下列关于萃取操作的说法正确的是( )
A.从溴水中萃取溴,可用酒精作萃取剂
B.萃取操作完成后,静置分层,上下层液体依次从下口放出
C.用一种有机溶剂,提取水溶液中的某物质,静置分层,“水层”应在上层
D.萃取时所选溶剂应与原溶剂互不相溶,且与溶质不反应
4.下列方法不正确的是( )
A.用过滤的方法除去食盐水中的泥沙
B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘
D.用淘洗的方法从沙里淘金
5.在自来水蒸馏实验中,下列操作不正确的是( )
A.在蒸馏烧瓶中盛约体积的自来水,并放入几粒沸石
B.可以不用温度计
C.冷水从冷凝管上口入,下口出
D.取少量收集到的液体滴入硝酸银和稀硝酸,无明显现象
6.下列分离和提纯的实验中,所选用的方法或仪器不正确的是( )
实验目的
制取蒸馏水
分离水和植物油
分离食盐水与泥沙
从浓食盐水中得到氯化钠晶体
分离方法
蒸馏
分液
萃取
蒸发
选用仪器
7.在使用分液漏斗进行分液时,正确的操作是( )
A.上层液体经漏斗下口放出
B.分离液体时,将漏斗拿在手上进行分离
C.分离液体时,使分液漏斗上的小孔与大气相通,打开活塞
D.分液漏斗中盛装的是液体,振荡后不必扭开活塞把气体放出
8.选择萃取剂将碘水中的碘萃取出来,这种萃取剂应具备的性质是( )
A.不溶于水,且必须易与碘发生化学反应B.不溶于水,且比水更容易使碘溶解
C.不溶于水,且必须比水的密度大D.不溶于水,且必须比水的密度小
9.观察下列实验装置图,试回答下列问题:
(1)写出图中四种实验操作的名称:
、 、 、 。
(2)写出装置④中所用玻璃仪器的名称:
、 。
(3)下列实验需要在哪套装置中进行?
从海水中提取蒸馏水:
(填序号,下同);
分离氯化钠和水:
;
分离碳酸钙和水:
分离植物油和水:
。
10.海洋植物如海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。
实验室里从海洋植物中提取碘的流程如下:
海藻
海藻灰
悬浊液
含I-的溶液
X
Y
晶态碘
某化学兴趣小组将上述流程②③设计成如图所示:
已知②中发生反应的化学方程式为Cl2+2KI
2KCl+I2。
回答下列问题:
(1)写出提取过程①③中实验操作名称:
① ,③
。
(2)四氯化碳是 色、密度比水的密度 的液体。
F中下层液体的颜色为 色,上层液体中溶质的主要成分为 。
1.下列萃取分液操作(用CCl4从碘水中萃取碘)中错误的是( )
A.饱和碘水和CCl4加入分液漏斗后,塞紧上口的塞子,用一手压住分液漏斗上口部,一手握住活塞部分,把分液漏斗倒转过来振荡
B.静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体)
C.打开分液漏斗的活塞,使全部下层液体沿盛接液体的烧杯内壁慢慢流出
D.下层液体流出后,继续打开活塞,另用容器盛接并保存上层液体
2.下列离子检验的方法正确的是( )
A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有Cl-
B.某溶液中加BaCl2溶液生成白色沉淀,说明原溶液中有S
C.某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有Cu2+
D.某溶液中加稀硫酸生成白色沉淀,说明原溶液中有C
3.完成下列实验所选择的装置或仪器都正确的是( )
实验
分离植物油和氯化钠溶液
除去氯化钠晶体中混有的氯化铵晶体
分离
CCl4中的Br2
除去CO2气体中的HCl气体
装置
或仪器
4.阅读、分析下列两则材料:
材料一:
如图是纯碱和氯化钠的溶解度曲线
材料二:
下表列出乙二醇和丙三醇的有关性质
乙二醇(C2H6O2)
-11.5
198
1.11
易溶于水和乙醇
丙三醇(C3H8O3)
17.9
290
1.26
能与水、酒精以任意比互溶
回答下列问题(填序号):
A.蒸馏法B.萃取法C.“溶解、结晶、过滤”的方法D.分液法
(1)将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用 。
(2)将乙二醇和丙三醇相互分离的最佳方法是 。
5.已知乙醇的沸点为78.3℃,与水以任意比互溶,且在78.15℃时与水可形成95.57%(体积分数,下同)的恒沸混合物(即水和酒精可同时挥发)。
酒精中的水可加入生石灰除去,反应如下:
CaO+H2O
Ca(OH)2,CaO和Ca(OH)2均不溶于酒精。
某化学活动小组要用35%的酒精制取无水酒精,设计了如下四种方案。
方案一:
对35%的酒精直接蒸馏得无水酒精。
方案二:
先对35%的酒精蒸馏得95.57%的酒精,再加入生石灰,然后进行蒸馏得无水酒精。
方案三:
用CCl4对35%的酒精进行萃取,然后对酒精的CCl4溶液进行蒸馏得无水酒精。
方案四:
向35%的酒精中直接加入生石灰,然后进行蒸馏得无水酒精。
请对四种方案进行评价,回答下列问题:
(1)最好的方案是 ,错误的方案是 ,错误的原因是
(2)其余方案的不足是 。
(3)用最好的方案进行实验时,所用到的玻璃仪器有
(4)蒸馏操作中要注意的事项是
(回答三项即可)。