九年级科学上学期期中检测题 新版浙教版Word文档格式.docx
《九年级科学上学期期中检测题 新版浙教版Word文档格式.docx》由会员分享,可在线阅读,更多相关《九年级科学上学期期中检测题 新版浙教版Word文档格式.docx(18页珍藏版)》请在冰豆网上搜索。
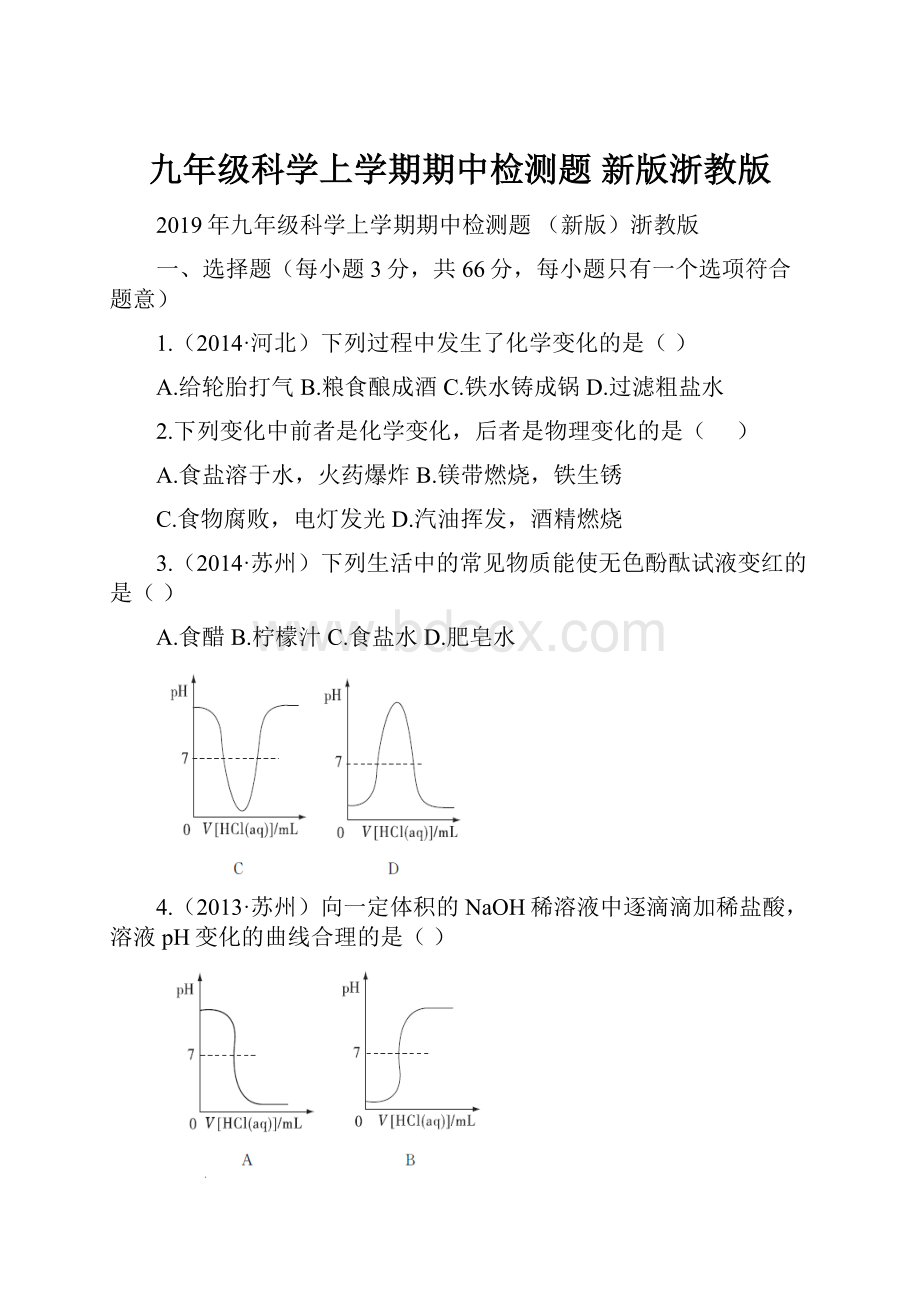
序号
广口瓶中的物质
胶头滴管中的物质
A
CO2
NaOH溶液
B
O2
浓硫酸
C
CO
石灰水
D
NaOH固体
水
13.(2014·
兰州)除去下列各物质中混有的少量杂质,所用试剂正确的是()
物质
杂质
所用试剂
氢气
氯化氢
氢氧化钠溶液
二氧化硫
碱石灰
氧化钙
碳酸钙
适量的稀盐酸
氢氧化钠
碳酸钠
适量的氯化钡溶液
14.(2014·
兰州)有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;
如果把Y和Z分别放入硝酸银溶液中,过一会,在Y表面有银析出,而Z表面没有变化。
根据以上事实,判断这三种金属的活动性由强到弱的顺序为()
A.Y>Z>XB.Y>X>ZC.X>Y>ZD.Z>Y>X
15.(2014·
北京)下列化学方程式书写正确的是()
A.2P+5O2
P2O5B.2KMnO4
K2MnO4+MnO2+O2↑
C.2CO+O2=2CO2D.H2SO4+NaOH=NaSO4+H2O
16.(2014·
陕西)陕南盛产茶叶,茶叶中含茶氨酸(化学式为C7H14O3N2)、锌、硒等多种成分。
茶树适宜在pH为5~6的土壤中生长。
下列说法不正确的是()
A.茶氨酸由碳、氢、氧、氮四种元素组成
B.茶氨酸属于有机物,锌、硒指单质
C.一个茶氨酸分子中含有3个氧原子
D.茶树不宜在碱性土壤中生长
17.常见金属R与硝酸银溶液反应的化学方程式为R+3AgNO3═3Ag+R(NO3)3,有关该反应的说法正确的是( )
A.反应后溶液质量一定增加 B.该金属可能是铁
C.R的活泼性比Ag弱 D.R表面有固体析出
18.(2014·
兰州)单层石墨称为石墨烯,这种“只有一个碳原子厚的碳薄片”被公认为是目前世界上最薄、最坚硬、传导电子速度最快的新型材料。
下列关于石墨烯的叙述中正确的是()
A.石墨烯的化学式为CB.石墨烯的硬度小于金刚石
C.石墨烯属于化合物D.石墨烯中碳元素的化合价为+4
19.(2014·
苏州)下列有关材料的说法错误的是()
A.不锈钢是金属材料B.保鲜膜属于塑料
C.棉花、蚕丝属于合成纤维D.玻璃钢是复合材料
20.(20
13·
重庆)化学变化多姿多彩,美丽如花。
右图中甲、乙、丙、X分别是Fe2O3、C、CO、盐酸中的某一种,甲、乙、丙均能与X发生化学反应,则X是()
A.CB.Fe2O3
C.COD.盐酸
21.对物质的性质进行比较归纳,有利于更好地学习科学。
下列对物质性质的归纳中,正确的是()
A.H2、O2、CH4都具有可燃性
B.浓硫酸、浓盐酸、酒精都具有挥发性
C.H2、C、CO都能和CuO发生置换反应
D.Fe、Al、Cu都能和AgNO3溶液发生置换反应
22.“信息”“材料”和“能源”被称为新科技革命的三大支柱。
下列叙述错误的是()
A.因特网上丰富的信息资源,有些是不健康的
B.合金、塑料、橡胶是三种重要的高分子材料
C.制造“神舟九号”宇宙飞船,使用了多种新型材料
D.光纤具有抗干扰、信号衰减小的特点,适用于远距离、大容量信息传输
二、填空题(本大题共36分)
23.(8分)利用“物理性质”“化学性质”“物理变化”或“化学变化”等名词填空:
(1)水冷却到0℃时结冰了,为。
(2)煤燃成了灰烬,为_。
(3)镁条能在空气中燃烧,为_。
(4)镁条呈现固态、银白色,为_。
24.(6分)小明同学取下列生活中的物质,测得其pH如下表所示:
肥皂水
雨水
糖水
柠檬汁
洗洁精
pH
10.2
5.2
7.0
2.5
12.2
由此判断:
(1)酸性最强的物质是_。
(2)能使无色酚酞试液变红色的物质是(填一种物质即可)。
(3)正常雨水的pH约为5.6。
小明生活的环境所降的雨水(填“属于”或“不属于”)酸雨。
25.(8分)请设计除去杂质的实验方案,填写在下表中(括号中为杂质)。
混合物
除去杂质的化学方程式
主要操作步骤
铜粉(锌粉)
FeSO4溶液(CuSO4)
26.(8分)有一包白色粉末,可能是Mg(OH)2、Ca
CO3、FeCl3、BaCl2、Na2SO4、KOH中的一种或几种,为检验其组成,进
行如下实验:
(1)取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液,则白色沉淀可能是,原混合物中一定不含有。
(2)向实验
(1)滤出的白色沉淀中加入足量的稀盐酸,沉淀全部溶解,并产生无色气体,则原混合物中一定含有。
(3)将实验
(2)中产生的无色气体通入实验
(1)中得到的滤液,产生白色沉淀,根据此现象推断,原混合物中一定还含有。
27.(6分)(2014·
兰州)化学就在我们身边。
(1)婴儿配方奶中含有蛋白质、糖类、钙、铁、硒等营养成分。
这里的钙、铁、硒是指________(填“元素”“单质”或“化合物”)。
(2)用下列材料的对应字母填空。
A.金属材料B.天然有机高分子材料C.合成材料
①棉花、羊毛属于。
②可用于制造人造骨、航天飞机等的钛合金属于。
三、实验简答题(本大题共46分)
28.(14分)(2014·
兰州)为了鉴别碳酸钾溶液和氢氧化钾溶液,同学们进行了探究实验:
分别取两种溶液于两支试管中,各滴入一定量的氯化钙溶液。
观察到一支试管中出现白色浑浊。
实验结束后,同学们将废液倒入同一个干净的烧杯中,发现废液变浑浊。
同学们对废液进行了过滤,并对滤液的成分进行了探究。
【提出问题】滤液中除水外还含有哪些物质?
【猜想】A.可能含有氢氧化钾、氯化钾和碳酸钾
B.可能含有氢氧化钾、氯化钾
C.可能含有氢氧化钾、氯化钾、碳酸钾和氯化钙
你认为还可能是①(写一种猜想)。
【讨论】你认为②猜想不合理(填字母),请说明理由③。
【实验设计】设计一个简单的实验,证明你的猜想正确。
实验步骤
实验现象
实验结论
取样于试管中,④
⑤
猜想正确
【反思交流】写出碳酸钾与氯化钙反应的化学方程式
⑥。
在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑⑦。
29.(12分)张大爷去年购买的化肥外包装上的字迹看不清,只记得是K2CO3、NH4Cl、KCl中的一种。
小明利用学过的化学知识,设计如下实验方案帮张大爷鉴别化肥。
【实验步骤】取少量上述化肥于一容器中,加入少量Ca(OH)2粉末,混合研磨。
【实验现象】未嗅到刺激性的氨味。
【实验结论】小明由上述实验推断该化肥不是。
(1)请根据上述实验结论,设计一个简单的实验方案来进一步证明该化肥可能是什么。
结论或有关化学反应方程式
(2)通过小明的实验,请你写出使用铵态氮肥的一点注意事项:
____________________。
30.(10分)如右图所示是高炉炼铁时高炉内的化学变化过程。
认真阅读有关信息,回答下列问题:
(1)将铁从铁矿石中还原出来的物质是_____(填化学式)。
(2)取少量高炉中炼出的生铁放入烧杯中,加入足量稀盐酸,可观察到的现象是____________________________,发生反应的化学方程式为__________________________,当反应停止后,还可观察到烧杯底部有黑色不溶物,该物质是_____________(填化学式),请设计一个简单实验证明你的判断,简要写出主要操作和现象____。
31.(10分)为检测某化工厂排放的废液中是否含有SO42﹣,同学们设计了如下方案,并进行了实验。
方案
步骤
现象
结论
Ⅰ
①取样品,滴加BaCl2溶液
②对步骤①反应后的混合物进行过滤,在滤渣中滴加稀盐酸
①有白色沉淀产生
②无明显现象
废液中含有SO42﹣
Ⅱ
①取样品,滴加过量_____________
②在步骤①的溶液中滴加BaCl2溶液
①无明显现象
②有白色沉淀产生
Ⅲ
①取样品,滴加Ba(NO3)2溶液
②对步骤①产生的混合物进行过滤,在滤渣中滴加稀硝酸
(1)方案Ⅱ的实验结论如果正确,步骤①中滴加的物质是 。
(2)方案Ⅰ和Ⅲ中,结论不成立的方案是 ,理由是 。
(3)方案Ⅲ的滤渣中,滴加稀硝酸是为了排除 的干扰。
四、分析计算题(本大题共32分)
32.(12分)为了测定某未知浓度的氢氧化钡溶液的溶质质量分数,取某稀硫酸溶液20g,逐滴加入此氢氧化钡溶液30g,同时用pH计测定并记录反应过程中混合溶液pH变化情况(如下图所示)。
过滤后得滤液47.67g,请你通过计算,求出氢氧化钡溶液的溶质质量分数。
33.(20分)人体胃液中含有少量HCl,正常情况下胃液的pH为0.8~1.5,相应HCl的溶质质量分数为0.2%~0.4%,胃酸过多与过少都不利于人体健康。
某人出现反胃、吐酸水的症状,经检查其胃液中HCl的质量分数为1.495%(胃液密度约为1g/cm3)。
(1)若人的胃液总量约为100mL,请完成下列问题:
①正常情况下胃液中HCl的质量范围是_____;
②该患者胃液中HCl的质量是__;
③该患者至少要除去的
HCl的质量是。
(2)医生给患者开了一瓶胃舒平(每片含氢氧化铝0.39g),并要求病人每次服用2片。
请根据化学方程式计算在食用该药片后被除去的HCl的质量是多少?
[发生反应的化学方程式为Al(OH)3+3HCl=AlCl3+3H2O]
(3)该医生还提醒该胃药不宜过量服用,可能原因是____。
(答一点即可)
期中检测题参考答案
1.B解析:
A项使空气进入轮胎中,没有新物质生成,属于物理变化;
B项粮食中的淀粉在酒化酶的作用下发酵变成酒精,生成了新物质,属于化学变化;
C项只是铁的状态发生了变化,没有新物质生成,属于物理变化;
D项只是将粗盐水中的不溶性杂质分离出来,没有新物质生成,属于物理变化。
2.C解析:
物理变化和化学变化的本质区别在于是否有新物质生成。
A中食盐溶于水,只是物质的溶解,没有新物质生成,属于物理变化;
火药爆炸是物质的燃烧,属于化学变化。
B中镁带燃烧,铁生锈,二者均属于化学变化。
C中食物腐败生成了新的物质,属于化学变化;
电灯发光属于能量的转化,没有新物质生成,是物理变化。
D中汽油挥发,是分子间间隔大小的改变,属于物理变化;
酒精燃烧属于化学变化。
3.D解析:
酚酞试液遇酸性或中性溶液不变色,遇碱性溶液变红色。
食醋、柠檬汁呈酸性,食盐水呈中性,这些物质都不能使无色酚酞试液变色(即仍为无色);
肥皂水呈碱性,能使无色酚酞试液变红。
4.A解析:
氢氧化钠溶液呈碱性,其pH大于7,故图像起点的纵坐标应该在7的上方,B、D错误;
向氢氧化钠溶液中加入稀盐酸后,氢氧化钠与稀盐酸发生中和反应,溶液的碱性减弱,pH降低,当氢氧化钠与稀盐酸恰好完全反应时,溶液的pH等于7,如果继续加入稀盐酸,稀盐酸过量后,溶液的pH逐渐减小,趋向于所加盐酸的pH,故C中图像的变化趋势错误,A正确。
5.A解析:
pH大于7的溶液呈碱性,pH等于7的溶液呈中性,pH小于7的溶液呈酸性。
液体肥皂的pH大于7,因此呈碱性。
6.B解析:
由最后一步加氧气又生成甲,可确定甲中肯定含有氧元素,由此排除A和D;
若甲为CuO,则乙为CuCl2溶液,和AgNO3溶液反应后,生成AgCl沉淀和Cu(NO3)2溶液,Fe跟Cu(NO3)2溶液反应,置换出Cu,Cu跟氧气反应生成CuO,B符合题意;
若甲为Fe2O3,则乙为FeCl3溶液,和AgNO3溶液反应后,生成AgCl沉淀和Fe(NO3)3溶液,Fe跟
Fe(NO3)3溶液反应生成Fe(NO3)2,Fe(NO3)2跟氧气反应得不到Fe2O3,C不符合题意。
7.A解析:
物质的化学性质是指在化学变化中表现出来的性
质,物质的物理性质是指不需要通过化学变化就能表现出来的性质。
干冰用作冷冻剂是由于干冰在升华时要吸收大量的热,不需要发生化学变化就能表现出来,属于物理性质;
硫酸用于处理碱性废液利用了硫酸的酸性,属于化学性质;
氧气用于气焊利用了氧气支持燃烧的性质,属于化学性质;
生石灰用作干燥剂利用了氧化钙能与水反应生成氢氧化钙的性质,属于化学性质。
8.A解析:
酸是指电离时产生的阳离子全部是氢离子的化合物。
由于所有的酸都能电离出氢离子,故具有一些相似的性质,称为酸的通性。
9.D解析:
测定溶液的pH时,应用玻璃棒蘸取溶液滴到放在玻璃片或白瓷板上的pH试纸上,并把试纸所显示的颜色与标准比色卡比较,可得出溶液的pH,A错误;
浓硫酸露置于空气中,会
吸收空气中的水分,溶质的质量分数会减小,B说法错误;
露置于空气中的固体氢氧化钠容易吸收空气中的水蒸气而逐渐溶解,进而和空气中的二氧化碳发生反应,生成碳酸钠,成分发生改变,C说法错误。
10.B解析:
小苏打是碳酸氢钠的俗称;
氢氧化钙俗称熟石灰;
生石灰是氧化钙的俗称;
纯碱是碳酸钠的俗称。
11.B解析:
浓硫酸具有吸水性,露置在空气中易吸水而使溶液质量增加;
浓盐酸具有挥发性,挥发出溶质氯化氢而导致溶质质量减小,且溶液质量也随之减小;
氢氧化钠溶液露置在空气中能与二氧化碳反应而使溶液质量增加;
食盐溶液露置在空气中一般很稳定,如果考虑水分的蒸发则溶液质量会变小,溶质的质量分数会变大。
12.A解析:
结合物理知识,套在玻璃管下端的小气球鼓起来,说明瓶中的压强减小,可能是两种物质相互作用吸热,也可能是气体被液体吸收造成的。
A中CO2被NaOH溶液吸收,瓶中压强减小;
B、C两种物质不反应,也不互溶;
D中NaOH固体溶于水放热,气球变瘪。
13.A解析:
选择除杂试剂的原则是不能增加新的杂质,不能与被提
纯物质反应,容易分离。
氢氧化钠溶液可与氯化氢反应(吸收),不能与氢气反应,A正确;
碱石灰是一种碱性干燥剂,它在吸收水分的同时还会吸收二氧化硫,B错误;
氧化钙、碳酸钙都能与稀盐酸反应,C错误;
氯化钡溶液与碳酸钠溶液反应生成碳酸钡沉
淀和氯化钠溶液,会增加新杂质氯化钠,D错误。
14.C解析:
X能与稀硫酸反应产生氢气,Y不反应,说明金属活动性X>
Y;
Y能置换出硝酸银溶液中的银,Z不能,说明金属活动性Y>
Z。
综合以上判断可知,三种金属的活动性由强到弱的顺序为X>
Y>
Z,即选C。
15.B解析:
A项没有配平,即没有遵循质量守恒定律,故A错误;
C项漏写反应条件,故C错误;
D项中硫酸钠的化学式错误,故D错误。
16.B解析:
根据茶氨酸的化学式可知,茶氨酸由碳、氢、氧、氮四种元素组成,故A正确。
茶氨酸是一种含有碳元素的化合物,属于有机物,但锌、硒是指元素而不是单质,故B错误。
一个茶氨酸分子是由7个碳原子、14个氢原子、3个氧原子、2个氮原子构成的,故C正确。
茶树适宜生长的土壤的pH为5~6,呈酸性,因此茶树不宜
在碱性土壤中生长,故D正确。
17.D解析:
R与硝酸银溶液反应的化学方程式为R+3AgNO3═3Ag+R(NO3)3,由于不知道R的相对原子质量,无法判断反应前后溶液质量的变化,故A错误;
由R与硝酸银溶液反应生成了R(NO3)3,R在化合物中的化合价为+3,铁与硝酸银溶液反应生成硝酸亚铁,故该金属不可能是铁,故B错误;
由金属R能与硝酸银反应置换出银,说明R的活泼性比银强,故C错误;
金属R能与硝酸银反应置换出银,则R表面有固体银析出,故D正确。
18.A解析:
石墨烯是由碳原子直接构成的,A正确;
石墨烯是最坚硬的新型材料,其硬度比金刚石还大,B错误;
石墨烯是由碳元素组成的纯净物,属于单质,C错误;
单质中,元素的化合价为0,D错误。
19.C解析:
棉花、蚕丝属于天然纤维,不属于合成纤维,C错误。
20.B解析:
若X是C,C不能与CO、盐酸反应,故选项A不符合题意;
若X是Fe2O3,Fe2O3可与其余三种物质发生反应,故选项B符合题意;
若X为CO,CO不能与C、盐酸反应,故选项C不符合题意;
若X是盐酸,盐酸不能与C、CO反应,故选项D不符合题意。
21.D解析:
O2具有助燃性,没有可燃性;
浓硫酸没有挥发性;
CO和CuO发生的不是置换反应。
22.B解析:
合金属于金属材料。
23.
(1)物理变化
(2)化学变化(3)化学性质(4)物理性质
解析:
物理变化和化学变化都是一个过程,它们的本质区别:
是否有新的物质生成,而化学性质和物理性质是物质的性质、特点,化学性质是在化学变化中表现出来的性质,如可燃性、毒性等,物理性质是不需要经过化学变化就能表现出来的性质,如颜色、状态、气味、溶解性、熔点、沸点等。
24.
(1)柠檬汁
(2)肥皂水(或洗洁精)(3)属于
25.
Zn+H2SO4=ZnSO4+H2↑
加酸溶解,过滤,用少量的蒸馏水洗涤
Fe+CuSO4=FeSO4+Cu
加入足量铁粉搅拌,过滤
稀硫酸能和锌反应生成硫酸锌和氢气,稀硫酸不能和铜反应,可以用这种方法除去铜粉中的锌粉。
铁和硫酸铜反应生成硫酸亚铁和铜,铁不能和硫酸亚铁反应,可以用这种方法除去硫酸亚铁中的硫酸铜。
26.
(1)Mg(OH)2、CaCO3、BaSO4FeCl3
(2)CaCO3(3)BaCl2、KOH
(1)Mg(OH)2、CaCO3都是不溶于水的白色沉淀,BaCl2和Na2SO4反应生成的BaSO4也是不溶于水的白色沉淀;
得到了白色沉淀和无色滤液,说明混合物中没有FeCl3,因为FeCl3溶液呈黄色。
(2)白色沉淀中加入稀盐酸能产生无色气体的只有碳酸钙。
(3)实验
(2)中产生的无色气体是二氧化碳,将二氧化碳通入实验
(1)得到的滤液中能产生白色沉淀,白色沉淀只能是BaCO3沉淀,所以原混合物中还一定有BaCl2、KOH。
27.
(1)元素
(2)①B②A
解析:
(1)物质是由元素组成的,一般商品中的物质成分指的都是元素。
(2)①棉花的主要成分是纤维素,羊毛的主要成分是蛋白质,它们都是天然有机高分子材料。
②钛合金属于金属材料。
28.①氢氧化钾、氯化钾和氯化钙②C③碳酸钾和氯化钙能发生反应,生成沉淀④滴入碳酸钾溶液(或碳酸钠溶液等答案合理均可)⑤产生白色沉淀⑥K2CO3+CaCl2=CaCO3↓+2KCl⑦反应物是否剩余
【猜想】考虑全部可能的组合,除A、B、C外,还可以是氢氧化钾、氯化钾和氯化钙。
【讨论】C不合理,因为碳酸钾和氯化钙可发生反应,即不能共存。
【实验设计】在鉴别实验过程中,氢氧化钾没有被消耗,故滤液中一定存在氢氧化钾;
因碳酸钾与氯化钙发生反应生成碳酸钙沉淀和氯化钾,故滤液中一定存在氯化钾;
向滤液中加入可溶性碳酸盐(如碳酸钾、碳酸钠等)溶液,若产生白色沉淀,则可证明滤液中存在氯化钙,综上可证明猜想正确。
【反思交流】碳酸钾与氯化钙反应的化学方程式为K2CO3+CaCl2=CaCO3↓+2KCl。
在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑某种反应物是否过量,即反应后是否有剩余。
29.【实验结论】NH4Cl
(1)
结论或有关化学反应方程式
取样,溶解,滴加少量稀HCl(或CaCl2、BaCl2等溶液)
产生气泡(或产生白色沉淀);
或答无现象
该化肥是K2CO3;
或答该化肥是KCl
2HCl+K2CO3
2KCl+H2O+CO2↑(或K2CO3+CaCl2
CaCO3↓+2KCl或K2CO3+BaCl2
BaCO3↓+2KCl);
或不写
(2)铵态氮肥不要与碱性物质混合施用
根据铵态氮肥的简易鉴别方法:
往氮肥中加入碱,有氨味的是铵态氮肥。
由此可知,取化肥少量,加入少量Ca(OH)2粉末研磨,未嗅到刺激性的氨味,推断该化肥不是NH4Cl。
(1)根据碳酸根的鉴别方法进行设计实验,取化肥少量溶解,往溶液中滴加稀盐酸(或氯化钙、氯化钡等溶液),如果产生气泡(或产生白色沉淀),则说明该化肥是K2CO3,否则是KCl。
(2)铵态氮肥能与碱反应生成氨气而降低肥效,因此不能与碱性物质混用。
30.
(1)CO
(2)有气泡产生,溶液逐渐变为浅绿色2HCl+Fe=FeCl2+H2↑C
将黑色固体放在坩埚内加热至其燃烧,并在火焰上方罩一个内壁沾有澄清石灰水的烧杯,烧杯内壁出现白色斑点
(1)在高炉中是利用CO的还原性对铁矿石进行还原。
(2)高炉所炼的铁是生铁,因此一定有单质铁与杂质碳,相关的反应与此有关;
要证明碳的存在一般是让其燃烧,看是否生成二氧化碳。
31.
(1)稀盐酸
(2)方案Ⅰ不能排除Ag+的干扰(3)CO32﹣
检验硫酸根离子是利用其与钡离子反应产生不溶于酸的白色沉淀,先加入盐酸,一是提供酸环境,排除碳酸根的干扰,二是排除银离子的干扰。
32.解:
根据质量守恒定律,生成硫酸钡的质量为:
20g+30g-47.67g=2.33g。
设参加反应的氢氧化钡的质量为x。
Ba(OH)2+H2SO4=BaSO4↓+2H2O
171233
x2.33g
解得x=1.7