高考化学命题热点提分攻略专题08电化学难点突破学案练习.docx
《高考化学命题热点提分攻略专题08电化学难点突破学案练习.docx》由会员分享,可在线阅读,更多相关《高考化学命题热点提分攻略专题08电化学难点突破学案练习.docx(13页珍藏版)》请在冰豆网上搜索。
高考化学命题热点提分攻略专题08电化学难点突破学案练习
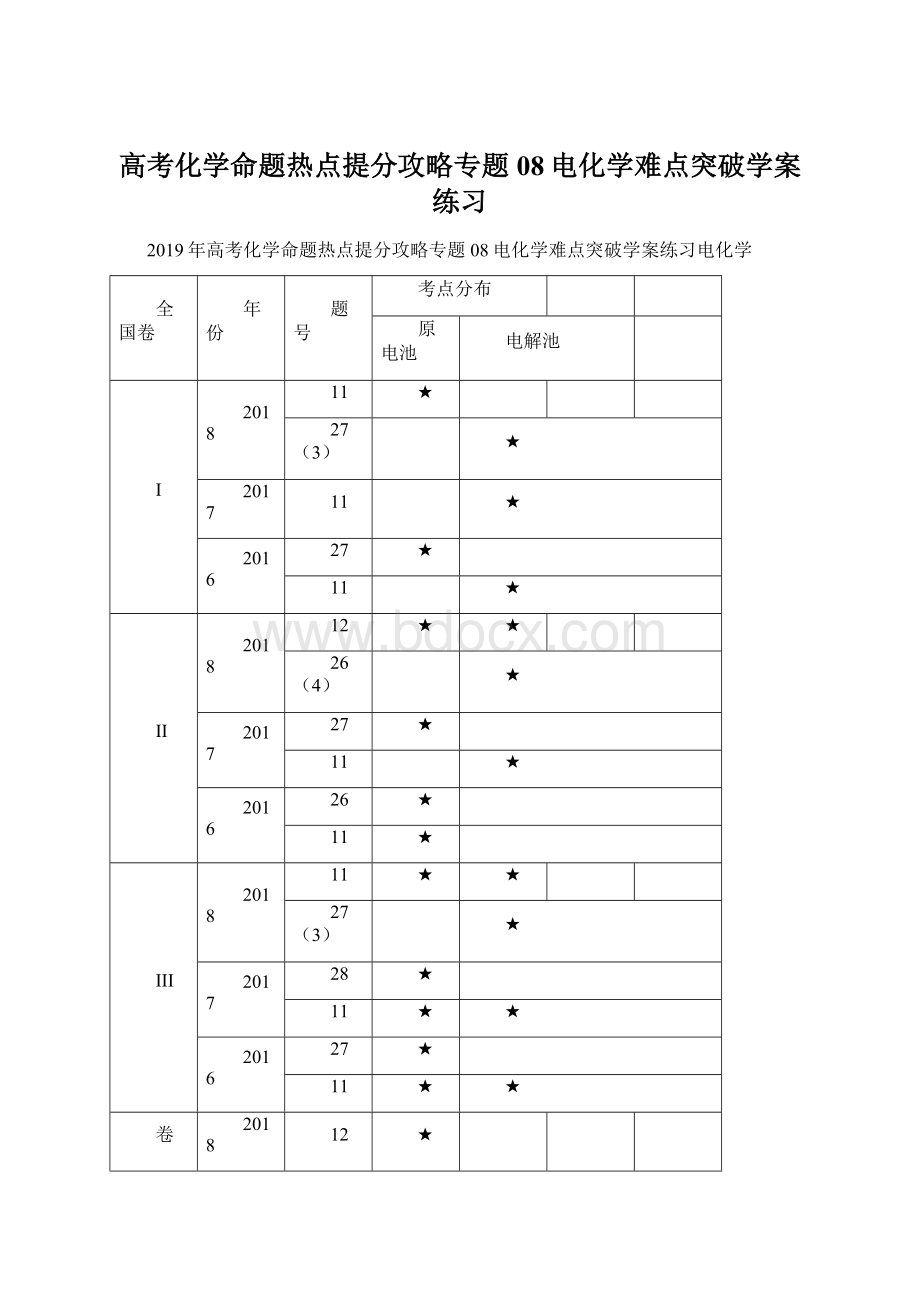
2019年高考化学命题热点提分攻略专题08电化学难点突破学案练习电化学
全国卷
年份
题号
考点分布
原电池
电解池
I
2018
11
★
27(3)
★
2017
11
★
2016
27
★
11
★
II
2018
12
★
★
26(4)
★
2017
27
★
11
★
2016
26
★
11
★
III
2018
11
★
★
27(3)
★
2017
28
★
11
★
★
2016
27
★
11
★
★
卷
2018
12
★
天津卷
2018
10(3)
★
江苏卷
2018
10
★
从上表我们不难看出,电化学的考查仍是高考中的热点问题。
19年的高考中,一是对于电极反应式书写的考查,二是可能以电化学在工农业等生产中的应用为情境,考查电化学原理及应用,并可能会涉及相关计算。
考点一 电化学原理
1.原电池工作原理示意图
2.电解池工作原理(阳极为惰性电极)示意图
3.解答电化学问题注意“三看”
一看有无外接电源,有电源装置为电解池,无电源装置为原电池;二看电极,判断阴阳极和正负极;三看电解质溶液。
【典例1】【2018全国1】最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。
示意图如图所示,其中电极分别为ZnO石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
①EDTA-Fe2+-e-=EDTA-Fe3+
②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+
该装置工作时,下列叙述错误的是
A.阴极的电极反应:
CO2+2H++2e-=CO+H2O
B.协同转化总反应:
CO2+H2S=CO+H2O+S
C.石墨烯上的电势比ZnO石墨烯上的低
D.若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需为酸性
【答案】C
B、根据石墨烯电极上发生的电极反应可知①+②即得到H2S-2e-=2H++S,因此总反应式为CO2+H2S=CO+H2O+S,B正确;
C、石墨烯电极为阳极,与电源的正极相连,因此石墨烯上的电势比ZnO石墨烯电极上的高,C错误;
D、由于铁离子、亚铁离子均易水解,所以如果采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需要酸性,D正确。
答案选C。
点睛:
准确判断出阴阳极是解答的关键,注意从元素化合价变化的角度去分析氧化反应和还原反应,进而得出阴阳极。
电势高低的判断是解答的难点,注意从物理学的角度借助于阳极与电源的正极相连去分析。
【典例2】【2018天津】CO2是一种廉价的碳资源,其综合利用具有重要意义。
回答下列问题:
(3)O2辅助的Al~CO2电池工作原理如图所示。
该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:
________。
电池的正极反应式:
6O2+6e−6O2−
6CO2+6O2−3C2O42−
反应过程中O2的作用是________。
该电池的总反应式:
________。
【答案】Al–3e–=Al3+(或2Al–6e–=2Al3+)催化剂2Al+6CO2=Al2(C2O4)3
【解析】(3)明显电池的负极为Al,所以反应一定是Al失电子,该电解质为氯化铝离子液体,所以Al失电子应转化为Al3+,方程式为:
Al–3e–=Al3+(或2Al–6e–=2Al3+)。
根据电池的正极反应,氧气再第一步被消耗,又在第二步生成,所以氧气为正极反应的催化剂。
将方程式加和得到,总反应为:
2Al+6CO2=Al2(C2O4)3。
【典例3】【2018江苏】下列说法正确的是
A.氢氧燃料电池放电时化学能全部转化为电能
B.反应4Fe(s)+3O2(g)2Fe2O3(s)常温下可自发进行,该反应为吸热反应
C.3molH2与1molN2混合反应生成NH3,转移电子的数目小于6×6.02×1023
D.在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
【答案】C
详解:
A项,氢氧燃料电池放电时化学能不能全部转化为电能,理论上能量转化率高达85%~90%,A项错误;B项,反应4Fe(s)+3O2(g)=2Fe2O3(s)的ΔS0,该反应常温下可自发进行,该反应为放热反应,B项错误;C项,N2与H2的反应为可逆反应,3molH2与1molN2混合反应生成NH3,转移电子数小于6mol,转移电子数小于66.021023,C项正确;D项,酶是一类具有催化作用的蛋白质,酶的催化作用具有的特点是:
条件温和、不需加热,具有高度的专一性、高效催化作用,温度越高酶会发生变性,催化活性降低,淀粉水解速率减慢,D项错误;答案选C。
点睛:
本题考查燃料电池中能量的转化、化学反应自发性的判断、可逆的氧化还原反应中转移电子数的计算、蛋白质的变性和酶的催化特点。
弄清化学反应中能量的转化、化学反应自发性的判据、可逆反应的特点、蛋白质的性质和酶催化的特点是解题的关键。
【答题技法】
1.解答电化学原理的
一般思路:
2.电极判断的“五”方法:
判断依据
电极材料
电极反应
电子流向
离子移向
电极现象
原
电
池
负极
活泼金属
氧化反应
流出
阴离子移向
电极质量减小
正极
不活泼金属或非金属
还原反应
流入
阳离子移向
电极增重或质量不变
电
解
池
阳极
与电源正极相连
氧化反应
流出
阴离子移向
电极溶解或pH增大
阴极
与电源负极相连
还原反应
流入
阳离子移向
电极增重或pH减小
考点二电极反应式的书写
1.“三步”突破原电池电极反应式的书写:
2.电解池电极反应式的书写模式:
【典例4】【2018全国1】焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。
回答下列问题:
(3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。
阳极的电极反应式为_____________。
电解后,__________室的NaHSO3浓度增加。
将该室溶液进行结晶脱水,可得到Na2S2O5。
【答案】2H2O-4e-=4H++O2↑a
【典例5】【2018全国2】我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子
Fe3+
Fe2+
Zn2+
Cd2+
开始沉淀的pH
1.5
6.3
6.2
7.4
沉淀完全的pH
2.8
8.3
8.2
9.4
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为______________;沉积锌后的电解液可返回_______工序继续使用。
【答案】Zn2++2e-Zn溶浸
【解析】(4)电解硫酸锌溶液制备单质锌时,阴极发生得到电子的还原反应,因此阴极是锌离子放电,则阴极的电极反应式为Zn2++2e-=Zn;阳极是氢氧根放电,破坏水的电离平衡,产生氢离子,所以电解后还有硫酸产生,因此沉积锌后的电解液可返回溶浸工序继续使用。
【典例6】【2018全国3】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。
回答下列问题:
(3)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式______。
②电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有______________(写出一点)。
【答案】2H2O+2e-2OH-+H2↑K+a到b产生Cl2易污染环境等
考点三 电化学综合应用
一、电化学计算的基本方法和技巧:
原电池和电解池的计算包括两极产物的定量计算、溶液pH的计算、相对原子质量和阿伏加德罗常数的计算、产物的量与电量关系的计算等。
通常有下列三种方法:
1.根据电子守恒计算
用于串联电路中阴阳两极产物、正负两极产物、相同电量等类型的计算,其依据是电路中转移的电子数相等。
2.根据总反应式计算
先写出电极反应式,再写出总反应式,最后根据总反应式列出比例式计算。
3.根据关系式计算
根据得失电子守恒定律关系建立起已知量与未知量之间的桥梁,构建计算所需的关系式。
如以通过4mole-为桥梁可构建如下关系式:
(式中M为金属,n为其离子的化合价数值)
该关系式具有总揽电化学计算的作用和价值,熟记电极反应式,灵活运用关系式便能快速解答常见的电化学计算问题。
二、金属腐蚀与防护的“两种比较”、“两种方法”
1.两种比较
(1)析氢腐蚀和吸氧腐蚀的比较
类型
析氢腐蚀
吸氧腐蚀
条件
水膜呈酸性
水膜呈弱酸性或中性
正极反应
2H++2e-===H2↑
O2+2H2O+4e-===4OH-
负极反应
Fe-2e-===Fe2+
其他反应
Fe2++2OH-===Fe(OH)2↓
4Fe(OH)2+O2+2H2O===
4Fe(OH)3
Fe(OH)3失去部分水转化为铁锈
(2)腐蚀快慢的比较
①一般来说可用下列原则判断:
电解池原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀;
②对同一金属来说,腐蚀的快慢:
强电解质溶液中>弱电解质溶液中>非电解质溶液中;
③活泼性不同的两种金属,活泼性差别越大,腐蚀越快;
④对同一种电解质溶液来说,电解质溶液浓度越大,金属腐蚀的速率越快。
2.两种保护方法
(1)加防护层
如在金属表面加上油漆、搪瓷、沥青、塑料、橡胶等耐腐蚀的非金属材料;采用电镀或表面钝化等方法在金属表面镀上一层不易被腐蚀的金属或生成一层致密的薄膜。
(2)电化学防护
①牺牲阳极的阴极保护法——原电池原理:
正极为被保护的金属,负极为比被保护的金属活泼的金属;
②外加电流的阴极保护法——电解原理:
阴极为被保护的金属,阳极为惰性电极。
三、电解池的“不寻常”应用
“六点”突破电解池
1.分清阴、阳极,与电源正极相连的为阳极,与电源负极相连的为阴极,两极的反应为“阳氧阴还”。
2.剖析离子移向,阳离子移向阴极,阴离子移向阳极。
3.注意放电顺序。
4.书写电极反应式,注意得失电子守恒。
5.正确判断产物。
(1)阳极产物的判断首先看电极,如果是活性电极作阳极,则电极材料失电子,电极溶解(注意:
铁作阳极溶解生成Fe2+,而不是Fe3+);如果是惰性电极,则需看溶液中阴离子的失电子能力,阴离子放电顺序为S2->I->Br->Cl->OH-(水)。
(2)阴极产物的判断直接根据阳离子的放电顺序进行判断:
Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Fe2+>Zn2+>H+(水)
6.恢复原态措施。
电解后有关电解质溶液恢复原态的问题应该用质量守恒法分析。
一般是加入阳极产物和阴极产物的化合物,但也有特殊情况,如用惰性电极电解CuSO4溶液,Cu2+完全放电之前,可加入CuO或CuCO3复原,而Cu2+完全放电之后,应加入Cu(OH)2或Cu2(OH)2CO3复原。
【典例7】【2018全国2】我国科