高中化学 12《化学计量在化学实验中的应用》第2课时教案 新人教版必修1Word格式文档下载.docx
《高中化学 12《化学计量在化学实验中的应用》第2课时教案 新人教版必修1Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《高中化学 12《化学计量在化学实验中的应用》第2课时教案 新人教版必修1Word格式文档下载.docx(13页珍藏版)》请在冰豆网上搜索。
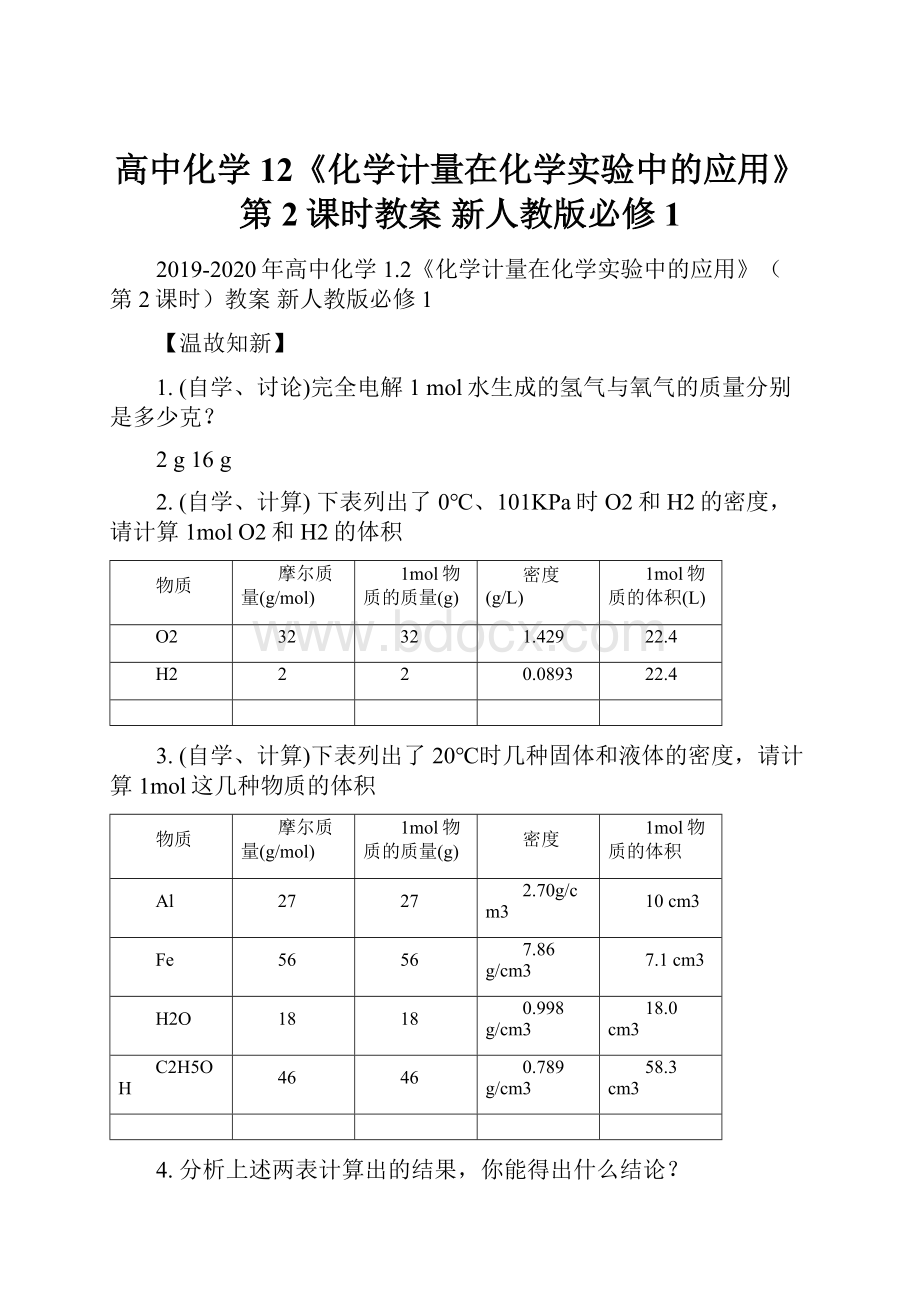
27
2.70g/cm3
10cm3
Fe
56
7.86g/cm3
7.1cm3
H2O
18
0.998g/cm3
18.0cm3
C2H5OH
46
0.789g/cm3
58.3cm3
4.分析上述两表计算出的结果,你能得出什么结论?
相同条件下1mol气体所占的体积基本相同,而1mol固体或液体所占的体积差别较大
【课堂生成】
强调:
相同条件(温度、压强)
【课堂研讨】
应该把阿伏加德罗定律安排在这个问题之后,下一个问题之前;
比例关系学生很好理解,在这里给学生点明温度指的是热力学温度,单位为K,说明热力学温度与摄氏底的关系。
【练一练】判断下列说法是否正确:
1mol气体的体积就是气体的摩尔体积(×
)
任何气体的摩尔体积都大致相等(×
22.4LH2所含有的分子数目约为NA个(×
常温常压下,22.4LO2含有的分子数目约为NA个(×
标况下,22.4LH2O中含有的分子数目约为NA个(×
只有在标况下,1mol气体的体积才约为22.4L(×
常温常压下,18g水中含有的分子数目为NA个(√)
1.(自学、思考)什么是阿伏加德罗定律?
请用阿伏加德罗定律解释为什么标准状况下的气体摩尔体积是相等的?
同温同压下,相同体积的任何气体均含有相同的分子数
=
推论1:
相同条件下,气体的体积之比等于物质的量之比等于分子的数目之比
把第一问提至第2小题前,单独作为一个问题,把第二问合并到第2小题(导学案中已经修改过)
【练一练】完成下列练习:
⑴标况下,2molO2的体积是4.48L;
标况下,224mLN2的物质的量是0.01mol;
标况下,11.2LO2的质量是16g;
标况下,48gO2的体积是33.6L;
标况下,2.24LO2中含有的氧气分子数目是0.1NA;
含有的氧原子数目是0.2NA;
一定量的CO2中含有的分子数目为0.3NA个,它在标况下的体积约为6.72L;
⑵标况下,体积均为11.2L的O2、CO2、H2三种气体所含有的分子数目分别为多少?
3.01×
1023
⑶标况下CO2和O2的密度分别为多少?
1.964g/L1.429g/L
c.对于混合气体还可用下式:
r=M甲×
甲的体积分数+M乙×
乙的体积分数+……
注意以下两点:
I.应用“①②③”可进行气体质量、摩尔质量、标准状况密度、相对密度、气体体积、物质的量之间的换算。
Ⅱ.应用“④”可进行气体平均摩尔质量、体积分数的计算和气体成分分析。
⑵
同温同压下,Vm1=Vm2,所以有:
推论2:
相同条件下,气体的密度之比等于其摩尔质量之比
⑷
相同条件下,下列气体的密度最小的是()
A.H2B.CH4C.N2D.CO2
相同条件下A气体对H2的相对密度22,则气体A的摩尔质量为44g·
mol-1;
【巩固练习】
1.标准状况下①6.72LCH4②3.01×
1023个HCl分子③13.6gH2S④0.2molNH3,下列对这四种气体的关系从大到小表达正确的是
a.体积②>③>①>④b.密度②>③>④>①
c.质量②>③>①>④d.氢原子个数①>③>④>②
A.abcB.bcdC.cbaD.abcd
2.两个体积相同的容器,一个盛有一氧化氮,另一个盛有氮气和氧气,在同温同压下两容器内的气体一定具有相同的
A.原子总数B.质子总数C.分子总数D.质量
3.如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是(式中NA为阿伏加德罗常数)
A.LB.LC.LD.L
4.150℃时碳酸铵完全分解生成气态混合物,该混合气体对H2的相对密度是
A.96B.48C.12D.32
5.同温同压下,A容器的H2和B容器的NH3中,若使它们所含的原子总数相等,则这两个容器的体积之比是
A.2∶1B.1∶2C.2∶3D.1∶3
6.标准状况下,若2.8LO2含有n个O2分子,则阿伏加德罗常数为
A.
B.
C.16nD.8n
7.已知10.2gA与12.8gB完全反应,生成9.6gC和7.2gD及另一气体E,已知E的密度是H2密度的15.5倍,则气体E在标准状况下的体积是
A.2.24LB.4.48LC.5.6LD.11.2L
8.在一定温度下,物质W分解,其反应方程式4WX3(g)+2Y(g),测得生成物组成的混合气体与H2的相对密度为18,则W的式量为
A.27 B.18 C.36 D.126
12.在常温常压下,1LCO和H2的混合气体完全燃烧,共消耗相同条件下0.5LO2,在混合气体中CO与H2的体积比为
A.1∶1 B.1∶2 C.2∶1 D.任意比
9.同温同压下,某瓶充满O2质量为116g,充满CO2为122g,充满气体X为114g,则X的相对分子质量为
A.28 B.60 C.32 D.44
10.在标准状况下,15gCO和CO2的混合气体是10.08L,则这种混合气中CO和CO2的物质的量的比为;
2:
1
11.某气态氧单质,在标况时每100mL的该气体质量为0.2143g,该氧单质的摩尔质量为;
化学式为;
48g·
mol-1O3
12.在标准状况下,mg气体A与ng气体B的分子数相等,则A与B的相对分子质量之比为m:
n;
同质量气体A与B的分子数之比为n:
m;
同温同压下,A气体与B气体的密度之比为m:
相同状况下,同体积A气体与B气体的质量之比为m:
13.某气态氧化物化学式为RO2,在标准状况下,1.28g该氧化物的体积是448mL,则氧化物的摩尔质量为;
R的相对原子质量为;
64g·
mol-132
14.在标准状况下,6.72LCH4和CO的混合气体的质量为6g,该混合气体中有mol的CH4,g的CO。
0.22.8
【课后反思】
2019-2020年高中化学1.2《化学计量在化学实验中的应用》(第3课时)教案新人教版必修1
2.(自学、计算)取10g上述溶液,求其中NaOH的物质的量?
0.05mol
用托盘天平称量时,必须保留一位小数,所以应是20.0g,而不是20g
2.(自学、思考)什么是物质的量浓度?
它的符号与单位分别是什么?
请写出其数学表达式。
【练一练】
⑴1mol/L硫酸溶液的含义是
A.1L水中含有1molH2SO4 B.1L溶液中含有1molH+
C.将98gH2SO4溶于1L水中所配成的溶液D.指1L硫酸溶液中含有98gH2SO4
⑵判断下列说法是否正确,并分析原因
①1molNaOH溶解在1L水中得到1mol/LNaOH溶液×
②标准状况下22.4mLHCl气体溶于100mL水得到0.01mol/L盐酸×
③20mL18.4mol/LH2SO4溶于100mL水中得到溶液体积为120mL×
④从1mol/LNaCl溶液100mL中取出10mL,其所得的物质的量浓度为1mol/L√
⑶填空:
①用40gNaOH配成2L溶液,其物质的量浓度0.5mol·
L-1。
②58.5gNaCl配成500mL溶液,其物质的量浓度2mol·
③2molNaOH配成200mL溶液,其物质的量浓度为10mol·
④物质的量浓度为2mol·
L-1的硫酸溶液250mL,含硫酸的物质的量为0.5mol
3.(思考、讨论)根据相关概念,请你推导出物质的量浓度(c)与溶质质量分数(ω)之间的关系。
c=
⑴将106gNa2CO3溶于水中,配成1L溶液,所得溶液的物质的量浓度是多少?
1mol/L
⑵将4.83molH2SO4溶于水配成1L密度为1.28g/cm3的硫酸溶液,求其物质的量浓度?
硫酸的质量分数?
c=4.83mol/Lω=37%
1.下列溶液中的c(Cl-)与50mL1mol/L氯化钠溶液中c(Cl-)相等的是
A.150mL1mol/LNaCl溶液B.75mL2mol/LCaCl2溶液
C.150mL3mol/LKCl溶液D.75mL1mol/LFeCl3溶液
2.0.5LAlCl3溶液中Cl-为9.03×
1022个,则AlCl3溶液的物质的量浓度为
A.0.1mol·
L-1 B.1mol·
L-1C.3mol·
L-1D.1.5mol·
L-1
3.将30mL0.5mol/LNaCl溶液加水稀释到500mL,稀释后溶液中NaCl的物质量浓度为
A.0.03mol/LB.0.3mol/LC.0.05mol/LD.0.04mol/L
7.用10mL的0.1mol·
L-1BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的摩尔浓度之比是
A.3∶2∶2B.1∶2∶3C.1∶3∶3D.3∶1∶1
4.下列关于0.1mol/LBa(NO3)2溶液正确的说法是
A.该溶液可由1L水中溶解0.1molBa(NO3)2制得
B.1L溶液中含有Ba2+和NO3-离子总数为3×
6.02×
1022
C.0.5L溶液中Ba2+离子的物质的量浓度为0.2mol/L
D.0.5L溶液中NO3-离子的物质的量浓度为0.2mol/L
5.向25mL2mol·
L-1稀硫酸中加入25mL1mol·
L-1的BaCl2溶液,充分反应后,溶液中H+物质的量浓度为(溶液混后体积变化忽略不计)
A.2mol·
L-1B.1mol·
L-1C.0.5mol·
L-1D.0.25mol·
6.将标准状况下的aLHCl(g)溶于1L水中,得到的盐酸密度为bg·
cm-3,则该盐酸的物质的量浓度是
A.mol·
L-1 B.mol·
L-1 C.mol·
L-1 D.mol·
7.在100g浓度为18mol·
L-1、密度为ρ(g·
cm-3)的浓硫酸中加入一定量的水稀释成9mol/L的硫酸,则加入的水的体积为
A.小于100mL B.等于100mL C.大于100mL D.等于100/ρmL
10.体积为V(mL)、密度为ρ(g·
mL-1)的溶液中,含有摩尔质量为M(g·
mol-1)的溶质m(g),其物质的量浓度为c(mol·
L-1),溶质的质量分数为a%。
下列有关关系式不正确的是
A.m=V×
ρ×
a%B.c=
C.c=
D.a%=
×
100%
10.⑴在标准状况下,将一充满HCl气体的集气瓶倒放于盛有足量水的水槽中,充分溶解后,溶液充满集气瓶,若假设HCl全部留在集气瓶中,则集气瓶内所得溶液中HCl的物质的量浓度为
mol/L。
⑵在标准状况下,用将一充满HCl和氧气混合气体的集气瓶倒放于盛有足量水的水槽中,水面上升至集气瓶容积的4/5就停止了,则原集气瓶中混合气体的平均相对分子质量为35.6,若假设HCl全部留在集气瓶中,则集气瓶内所得溶液HCl的物质的量浓度为
8.标准状况下,用一定量的水吸收氨气后制得浓度为12.0mol·
L、密度为0.915g·
cm的氨水,试计算1体积水吸收多少体积的氨气可制得上述氨水。
(本题中氨的式量以17.0计,水的密度以1.00g·
cm-3计)
378