浙江高考选考科目模拟试题九Word文档格式.docx
《浙江高考选考科目模拟试题九Word文档格式.docx》由会员分享,可在线阅读,更多相关《浙江高考选考科目模拟试题九Word文档格式.docx(18页珍藏版)》请在冰豆网上搜索。
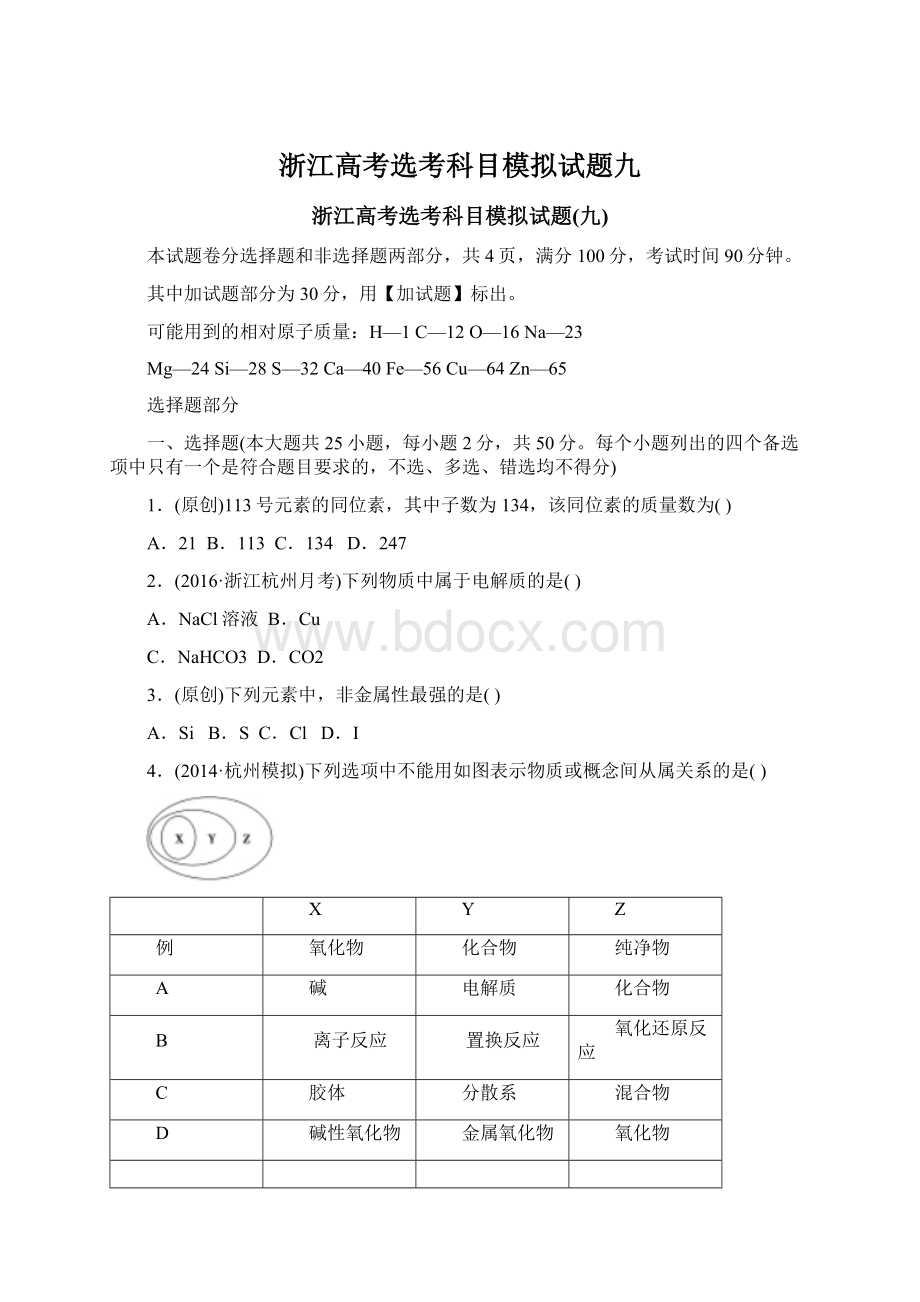
碱性氧化物
金属氧化物
5.(2016·
杭州调研)下列仪器中不能用于加热的是()
6.(原创)下列原子或原子团,不属于官能团的是()
A.OH-B.—OH
7.(2015·
浙江兰溪调研)常温下,将pH=1的硫酸溶液平均分成两等份,一份加入适量水,另一份加入与该硫酸溶液物质的量浓度相同的氢氧化钠溶液,两者pH都升高了1。
则加入水和加入NaOH溶液的体积比约为()
A.11∶1B.10∶1C.6∶1D.5∶1
8.(2016·
丽水调研)生活中的问题常涉及化学知识,下列过程不涉及化学变化的是()
A.用食醋除去暖瓶内的水垢
B.鸡蛋白溶液中加入硫酸铵饱和溶液后析出白色沉淀
C.通过煤的气化、液化获得清洁燃料
D.用75%的乙醇溶液进行皮肤消毒
9.(2015·
宁波模拟)下列有关物质的用途,叙述错误的是()
A.硅是制造太阳能电池的常用材料
B.二氧化硅是制造光导纤维的材料
C.水玻璃可用作木材防火剂
D.硅是制水泥的原料
10.(2015·
绍兴调研)下列反应,其产物的颜色按浅绿色、蓝色、淡黄色、白色顺序排列的是()
①金属钠在纯氧中燃烧
②CuSO4溶液中滴入NaOH溶液
③FeCl3溶液中加入足量的铁粉
④硝酸银溶液滴入稀盐酸中
A.②③①④B.③②①④
C.③①②④D.①②③④
11.(2014·
舟山模拟)下列叙述中,正确的是()
A.棉花、羊毛都属于纤维素
B.甲烷和苯均不能使酸性高锰酸钾溶液褪色
C.油脂和蛋白质都属于高分子化合物
D.煤的干馏为物理变化
12.(2014·
温州调研)不能鉴别二氧化碳与二氧化硫的试剂是()
A.品红溶液B.澄清石灰水
C.溴水D.酸性高锰酸钾溶液
13.(原创)检验某未知溶液中是否含有SO
,下列操作最合理的是()
A.加入硝酸酸化的BaCl2溶液
B.先加硝酸酸化,再加Ba(NO3)2溶液
C.加入盐酸酸化的Ba(NO3)2溶液
D.先用盐酸酸化,若无沉淀,再加BaCl2溶液
14.(2014·
丽水模拟)下列说法正确的是(设NA为阿伏加德罗常数的数值)()
A.1.8gNH
含有的电子数为0.1NA
B.2.3g金属钠反应生成Na2O2时失去的电子数为0.2NA
C.标准状况下,11.2L的CCl4所含的分子数为0.5NA
D.24gO2分子和24gO3分子所含的氧原子数目相等
15.(原创)25℃时,水的电离达到平衡:
H2O
H++OH-ΔH>
0,下列叙述正确的是()
A.向水中通入稀氨气,平衡逆向移动,c(OH-)降低
B.向水中通入氯化氢气体,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
16.(2015·
温州模拟)对于溶液的酸碱性说法正确的是()
A.c(H+)很小的溶液一定呈碱性
B.pH等于7的溶液一定呈中性
C.c(H+)=c(OH-)的溶液一定呈中性
D.不能使酚酞试液变红的溶液一定呈酸性
17.(2014·
杭州模拟)下列事实不属于盐类水解应用的是()
A.氯化铁晶体常用于净水
B.实验室通常使用热的纯碱溶液去除油污
C.实验室配制FeCl3溶液时加入少量稀盐酸
D.实验室制氢气时加入少量CuSO4可加快反应速率
18.(原创)下列反应的离子方程式正确的是()
A.把金属铁放入稀盐酸中:
2Fe+6H+===2Fe3++3H2↑
B.将氢氧化铁放入盐酸中:
Fe(OH)3+3H+===Fe3++3H2O
C.氢氧化钡与硫酸铜溶液反应:
Ba2++SO
===BaSO4↓
D.碳酸镁与盐酸反应:
CO
+2H+===H2O+CO2↑
19.(2015·
宁波模拟)下列关于氯的说法正确的是()
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B.
Cl、3717Cl为Cl不同的核素,有不同的化学性质
C.实验室制备Cl2,可用排饱和食盐水集气法收集
D.1.12LCl2含有1.7NA个质子(NA表示阿伏加德罗常数的数值)
20.(2016·
浙江嘉兴调研)下列各图所示的分子结构模型中,分子式为C2H6O的是()
21.(2014·
绍兴调研)常温下,下列有关各溶液的叙述正确的是()
A.pH>
7的溶液中不可能存在醋酸分子
B.20mL0.1mol·
L-1的醋酸钠溶液与10mL0.1mol·
L-1的盐酸混合后溶液显酸性:
c(CH3COO-)>
c(Cl-)>
c(H+)>
c(CH3COOH)
C.0.1mol·
L-1醋酸的pH=a,0.01mol·
L-1的醋酸的pH=b,则a+1>
b
D.已知酸性HF>
CH3COOH,pH相等的NaF与CH3COOK溶液中:
c(Na+)-c(F-)<
c(K+)-c(CH3COO-)
22.(2015·
诸暨模拟)下列有关原电池的说法中正确的是()
A.在内电路中,电子由正极流向负极
B.在原电池中,相对较活泼的金属作负极,不活泼的金属作正极
C.原电池工作时,正极表面一定有气泡产生
D.原电池工作时,可能会伴随着热能变化
23.(2015·
瑞安模拟)以下各组表示卤素及其化合物的性质变化规律中,错误的是()
A.单质的氧化性:
F2>Cl2>Br2>I2
B.阴离子的还原能力:
F->
Cl->
Br->
I-
C.气态氢化物的稳定性:
HF>HCl>HBr>HI
D.元素的非金属性:
F>Cl>Br>I
24.(2014·
台州模拟)制印刷电路板时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu===2FeCl2+CuCl2。
向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是()
A.烧杯中有铜无铁B.烧杯中有铁无铜
C.烧杯中铁、铜都有D.烧杯中铁、铜都无
25.(2015·
金丽衢十二校联考)某无色溶液中可能含有Na+、Fe3+、SO
、SO
、CO
、Cl-、Br-这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:
①pH试纸检验,溶液的pH>7
②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成
③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分液
④向分液后的水溶液中加入AgNO3和HNO3的混合溶液有白色沉淀产生
则关于原溶液的判断中不正确的是()
A.肯定不存在的离子是Na+、Fe3+、SO
B.肯定存在的离子是Na+、SO
、Br-
C.无法确定原溶液中是否存在Cl-
D.若步骤④改用AgNO3和盐酸的混合溶液,则对溶液中离子的判断无影响
非选择题部分
二、非选择题(本大题共7小题,共50分)
26.(2014·
金华模拟)(4分)A是一种重要的化工原料,其产量可以用来衡量一个国家的石油化工水平,C是一种酸性物质,D是具有果香气味的烃的衍生物。
A、B、C、D在一定条件下存在如图所示转化关系(石蜡油是含17个碳原子以上的液态烷烃,部分反应条件、产物被省略)。
(1)工业上,由石油获得汽油、煤油、石蜡油等成分的方法是______________________________________________________________
_____________________________________________________________。
(2)A→B的反应类型是____________________________________________;
B+C→D的反应类型是____________________________________________。
(3)实验室常用如图所示装置制取D,请在图示方框中补充画出有关仪器,并标明所盛药品的名称。
27.(2015·
浙江温州学考模拟)(6分)X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素,它们能实现如图所示的转化关系(其他物质省略):
(1)若X是一种生活中使用量最大的金属单质,写出Z与Cu反应的离子方程式_________________________________________________________________。
(2)若X是一种非金属单质,常温下为固体;
Y是一种能使品红溶液褪色且加热后又能恢复原来颜色的化合物。
①写出构成X单质的元素在周期表中的位置______________________________。
②写出Z和Cu反应的化学方程式________________________________
______________________________________________________________。
28.(2014·
四川树德中学月考)(6分)化学是一门以实验为基础的学科,熟练使用中学化学实验中的常见仪器,熟悉常见实验用品是正确进行实验的基础。
试回答以下问题:
(1)现有如下仪器,用序号回答有关问题:
①容量瓶②蒸馏烧瓶③托盘天平④量筒⑤烧杯
⑥蒸发皿⑦分液漏斗
对允许加热的仪器,加热时必须垫石棉网的有________;
使用时必须检查是否漏水的有________;
标有“0”刻度的有________。
(2)拟在烧杯中在加热条件下配制50mL某溶液,应选择的烧杯是________(用字母回答)。
a.400mL烧杯b.250mL烧杯
c.100mL烧杯d.50mL烧杯
29.(2015·
衢州调研改编)(4分)取一定物质的量浓度的NaOH溶液10mL,通入一定量的CO2,再继续滴加入0.1mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:
(1)原NaOH溶液的物质的量浓度为_________________________________。
(2)原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体最大体积(标准状况)为_____________________________________。
30.(加试题)(2014·
广东理综节选)(10分)用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①
CaSO4(s)+CO(g)
CaS(s)+CO2(g)
ΔH1=-47.3kJ·
mol-1
②CaSO4(s)+CO(g)
CaO(s)+CO2(g)+SO2(g)
ΔH2=+210.5kJ·
③CO(g)
C(s)+
CO2(g)
ΔH3=-86.2kJ·
(1)反应2CaSO4(s)+7CO(g)
CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=________(用ΔH1、ΔH2和ΔH3表示)。
(2)反应①-③的平衡常数的对数lgK随反应温度T的变化曲线见图,结合各反应的ΔH,归纳lgK-T曲线变化规律:
a)____________________________________________________________;
b)_____________________________________________________________。
(3)向盛有CaSO4的真空恒容密闭容器中充入CO,反应①于900℃达到平衡,c平衡(CO)=8.0×
10-5mol·
L-1,则CO的转化率为________________________。
(4)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入_____________________________________________________________。
31.(加试题)(2016·
舟山模拟)(10分)过碳酸钠(2Na2CO3·
3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。
某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:
已知:
主反应2Na2CO3(aq)+3H2O2(aq)
2Na2CO3·
3H2O2(s)ΔH<0
副反应2H2O2===2H2O+O2↑
滴定反应6KMnO4+5(2Na2CO3·
3H2O2)+19H2SO4===3K2SO4+6MnSO4+10Na2SO4+10CO2↑+15O2↑+34H2O
50℃时2Na2CO3·
3H2O2(g)开始分解
请回答下列问题:
(1)图中支管的作用是_________________________________________。
(2)步骤①的关键是控制温度,其措施有________、________和________。
(3)在滤液X中加入适量NaCl固体或无水乙醇,均可析出过碳酸钠,原因是__________________________________________________________________
_______________________________________________________________。
(4)步骤③中选用无水乙醇洗涤产品的目的是____________________________
________________________________________________________________。
(5)下列物质中,会引起过碳酸钠分解的有________。
A.Fe2O3B.CuO
C.Na2SiO3D.MgSO4
(6)准确称取0.2000g过碳酸钠于250mL锥形瓶中,加50mL蒸馏水溶解,再加50mL2.0mol·
L-1H2SO4溶液,用2.000×
10-2mol·
L-1KMnO4标准溶液滴定至终点时消耗30.00mL,则产品中H2O2的质量分数为________。
32.(加试题)(2016·
义乌模拟)(10分)阿明洛芬属于苯丙酸类抗炎药,镇痛效果优于布洛芬。
下图是阿明洛芬的一条合成路线:
(1)D中官能团的名称是________________________________________。
(2)写出E的结构简式:
__________________________________________。
(3)G能发生的反应类型是________(填字母序号)。
A.取代反应B.酯化反应
C.加聚反应D.还原反应
E.加成反应
(4)写出F在NaOH溶液中反应的化学方程式:
___________________________
(5)写出所有满足下列条件的B的同分异构体:
______________________
①只含一个苯环的芳香族化合物;
②核磁共振氢谱中峰的个数与B的其他同分异构体相比最少。
1.D[质量数=质子数+中子数=113+134=247,D正确。
]
2.C[电解质是指在水溶液中或熔融状态下能够导电的化合物。
酸、碱、盐及金属氧化物都属于电解质,NaCl溶液和Cu分别属于混合物和单质,所以二者既不是电解质也不是非电解质,CO2属于非金属氧化物,是非电解质,故A、B、D均错,只有C符合要求。
3.C[Si、S、Cl同在第三周期且从左至右,根据非金属性从左到右依次增强,Cl的非金属性最强,Cl、I处于同主族且I在下,根据同主族元素从上到下非金属性依次减弱,则非金属性:
Cl>
I。
4.B[碱属于电解质,电解质属于化合物,A对;
置换反应属于氧化还原反应,但离子反应与氧化还原反应不存在从属关系,B错;
碱性氧化物属于金属氧化物,金属氧化物属于氧化物,C对;
胶体属于分散系,分散系属于混合物,D对。
5.C[试管和坩埚可以直接加热,烧杯加热时应垫石棉网,量筒不能加热,故选C。
6.A[OH-是氢氧根离子,基团是不带电荷的—OH、
分别是羟基、碳碳双键、碳碳叁键均属于官能团。
7.C[设所取每份硫酸的体积为V1,使硫酸由pH=1变为pH=2,所加水的体积为9V1;
设所加NaOH溶液的体积为V2,则有c(H+)=
mol·
L-1=0.01mol·
L-1,解得V2=
V1,即V水∶VNaOH=6∶1。
8.B[判断物理变化和化学变化的依据是看是否有新物质生成。
A中用食醋除去暖瓶中的水垢,是利用乙酸与水垢中的CaCO3、Mg(OH)2反应生成可溶性的醋酸钙和醋酸镁,有新物质生成,属于化学变化;
B中蛋白质溶液中加入硫酸铵溶液析出蛋白质,是发生盐析降低了蛋白质的溶解性造成的,属于物理变化;
C中煤的气化、液化均属于化学变化;
D中用75%的酒精进行皮肤消毒是使蛋白质变性,属于化学反应。
9.D[制水泥的原料没有硅而是黏土、石灰石和石膏,黏土中含有硅酸盐。
10.B[①金属钠在纯氧中燃烧生成Na2O2,Na2O2呈淡黄色;
②CuSO4溶液中滴入NaOH溶液最后生成蓝色的Cu(OH)2沉淀;
③FeCl3溶液中加入足量的铁粉生成浅绿色的FeCl2溶液;
④硝酸银溶液滴入稀盐酸中生成白色的氯化银沉淀。
11.B[A项棉花属于纤维素,而羊毛属于蛋白质;
B项甲烷和苯均不能使酸性高锰酸钾溶液褪色;
C项蛋白质属于高分子化合物,而油脂不属于高分子化合物;
D项煤的干馏为化学变化。
12.B[二氧化硫具有漂白性和还原性,可以使品红溶液、溴水和酸性高锰酸钾溶液褪色,而二氧化碳则不能;
但二氧化碳与二氧化硫都能使澄清的石灰水变浑浊,故不能用澄清的石灰水来鉴别。
13.D[检验某溶液中是否含有SO
的方法是先用盐酸酸化(若有沉淀,过滤),再加入BaCl2溶液,若有白色沉淀产生,说明含有SO
。
14.D[NH
是由一个N原子(含有7个电子)和四个H原子(共含有4个电子)并失去一个电子构成,因此0.1molNH
含有NA个电子;
1molNa反应时失去1mol电子,所以B项错误;
标准状况下CCl4为液态,所以不能用气体摩尔体积去计算。
15.B[通入氨气生成氨水,c(OH-)增大,平衡逆向移动,A错误;
Kw只与温度有关,温度不变Kw不变,B正确;
CH3COONa水解促进水的电离,平衡正向移动,C错误;
加热,平衡正向移动,c(H+)增大,pH减小,D错误。
16.C[溶液酸碱性的根本判断依据是c(H+)与c(OH-)的相对大小,若c(H+)>
c(OH-)则显酸性;
若c(H+)=c(OH-)则显中性;
若c(H+)<
c(OH-)则显碱性。
C正确。
17.D[氯化铁水解生成氢氧化铁胶体,吸附水中的杂质用来净水,A正确;
热的纯碱溶液水解出的OH-浓度增大除油污效果好,B正确;
配制FeCl3溶液时加入少量稀盐酸用来抑制其水解,C正确;
实验室制氢气时加入CuSO4可形成原电池而加快反应速率,所以选D。
18.B[A项不符合反应事实,正确的离子方程式为Fe+2H+===Fe2++H2↑;
B项正确;
C项中忽略了Cu2+与OH-的反应;
D项中MgCO3微溶于水,应用化学式表示。
19.C[氯气与水的反应中氯气既是氧化剂也是还原剂;
同一元素的不同核素化学性质几乎完全相同而物理性质不同;
D中Cl2的体积未指明是标准状况。
实验室制备Cl2,可用排饱和食盐水集气法收集也可用向上排空气法收集,故C正确。
20.C[A项,分子组成为AB4,可以表示甲烷,为正四面体结构,与乙醇不相符合,错误;
B项,分子组成为A2B4,可以表示乙烯,为平面结构,与乙醇的结构不符合,错误;
C项,分子组成为A2B6C,可以表示乙醇,正确;
D项,分子组成为A6B6,可以表示苯,是平面结构,与乙醇组成不符合,错误。
21.C[醋酸钠溶液显碱性,pH>
7,其中存在醋酸分子,选项A不正确;
选项B中两者发生反应后溶液中的溶质为等浓度的醋酸、氯化钠和醋酸钠,醋酸的电离程度大于醋酸根离子的水解程度,溶液显酸性,正确的关系为c(CH3COO-)>
c(CH3COOH)>
c(H+),B错;
对于弱电解质溶液,溶液越稀越容易电离,0.01mol·
L-1醋酸的电离程度大于0.1mol·
L-1醋酸的电离程度,因此选项C正确;
根据电荷守恒,在NaF溶液中c(Na+)-c(F-)=c(OH-)-c(H+),同理在CH3COOK溶液中c(K+)-c(CH3COO-)=c(OH-)-c(H+),由于两溶液的pH相等,因此有c(Na+)-c(F-)=c(K+)-c(CH3COO-),D错。
22.D[A项,内电路中不存在电子的移动;
B项,若是由铝、镁、氢氧化钠溶液构成的原电池,则负极是铝;
C项,若是由锌、铜、硫酸铜溶液构成的原电池,则正极表面析出铜,没有气泡产生。
23.B[元素的非金属性F>Cl>Br>I,原子得电子能力F>Cl>Br>I,故阴离子的还原能力F-<
Cl-<
Br-<
I-,B项错误。
24.B[氯化铁溶液不仅可以溶解铜粉,也可以溶解铁粉,因铁的还原性比铜的强,FeCl3先氧化铁粉,再氧化铜粉。
故本题有如下三种情形:
①若FeCl3过量,则铁、铜全部溶解;
②若FeCl3少量,仅反应一部分铁粉,则铁粉和铜粉都有;
③若FeCl3适量,溶解完铁粉还可能溶解一部分铜粉,此时,剩余粉末中有铜无铁。
25.A[由题干无色溶液可知没有Fe3+;
由①知水解呈碱性则SO
和CO
至少有一种;
由②知没有SO
;
由③知没有CO
,则必有SO
被氧化成SO
CCl4层呈橙色则说明有Br-;
④加入的氯水中含Cl-,故选A。
26.解析乙烯的产量可以用来衡量一个国家的石油化工水平,故A为乙烯,在一定条件下乙烯与水发生加成反应生成乙醇(B),而乙醇可被酸性高锰酸钾溶液氧化为乙酸(C),乙醇和乙酸可发生酯化反