讲座十三 硼族元素文档格式.docx
《讲座十三 硼族元素文档格式.docx》由会员分享,可在线阅读,更多相关《讲座十三 硼族元素文档格式.docx(77页珍藏版)》请在冰豆网上搜索。
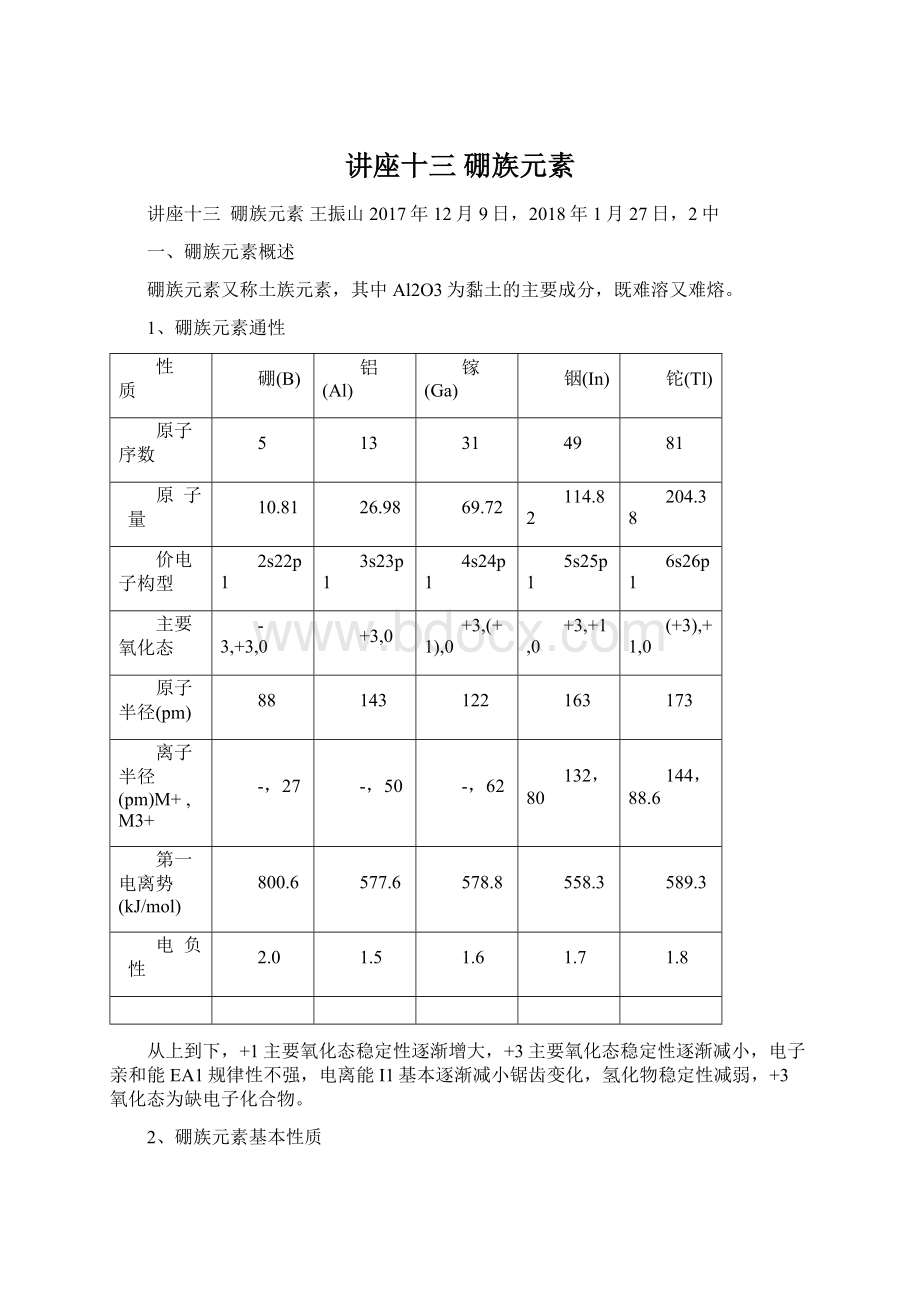
-,62
132,80
144,88.6
第一电离势(kJ/mol)
800.6
577.6
578.8
558.3
589.3
电
负
性
2.0
1.5
1.6
1.7
1.8
从上到下,+1主要氧化态稳定性逐渐增大,+3主要氧化态稳定性逐渐减小,电子亲和能EA1规律性不强,电离能I1基本逐渐减小锯齿变化,氢化物稳定性减弱,+3氧化态为缺电子化合物。
2、硼族元素基本性质
◆价电子构型:
ns2np1,◆最大特征是缺电子元素:
价电子数3<
价层轨道数4,可形成缺电子化合物。
▽缺电子化合物:
成键电子对数<
价层轨道数。
缺电子原子的特征表现:
①、有空轨道,可形成多中心缺电子键(如B2H6中有3c-2e键);
②、缺电子化合物是典型的Lewis酸(如BF3)。
易形成配位化合物(如H[BF4]),易形成双聚物(如Al2Cl6)。
注意:
H[BF4]不是缺电子化合物。
3、硼族元素的电势图
二、硼及其化合物
硼在自然界中的存在:
自然界没有游离硼,硼是自然界中分布较广的元素,
存地壳中的质量分数为1.0×
10-3%。
最丰富的硼矿是电气石,它是一种复杂的铝
硅酸盐,约含10%的硼。
硼在自然界主要以含氧化合物的形式存在,其主要的矿物有:
硼砂Na2B4O7·
10H2O、斜方硼砂Na2B4O7·
4H2O(四水硼砂)、方硼矿
Mg5B14O26·
MgCl2(2Mg3B8O15·
MgCl2)、硼镁矿Mg2B2O5·
H2O、硬硼钙石Ca2B6O11·
5H2O、纤维硼镁石Mg(BO2)OH、硼钠钙石NaCa(B5O9)·
8H2O、少量的天然硼酸H3BO3等。
硼在自然界中丰度之所以低,是因为105B+10n→42He+73Li,所以硼材料可作为
核反应堆的减速剂和生物防护。
单质硼是高效的中子吸收剂,含硼控制棒是核
电站的最重要部件之一,用于控制核反应的速率。
1、硼原子成键的三大特性:
⑴、共价性(主要特征)
B原子半径小,电离能(I1、I2、I3)大,B以形成共价键为特征。
硼的所有化合物都是共价化合物,固态和水溶液中都不存在B3+离子。
B:
sp2杂化,平面三角,BX3、B(OH)3,缺电子体,Lewis酸;
sp3杂化,四面体,如BF4-、BH4-、B(OH)4-加合物。
⑵、B缺电子性(ns2np1)
价轨道数4:
2s2px2py2pz;
价电子数3:
2s22p1;
配位数=3或4,BX3,B(OH)3,BF4-。
BF3+F-=BF4-,BF3:
Lewis酸。
除了作为电子对受体易与电子对供体形成配键以外,还有形成多中心键的特征;
硼的化学性质主要表现在其缺电子性上,氧化态为+3。
⑶、形成多中心缺电子键,形成多面体习性
硼晶体中有B-B-B,硼烷中有B-B-B,或B-H-B;
3c-2e键。
晶态硼和许多硼的化合物为多面体或多面体的碎片而成笼状或巢状等结构。
2、硼单质
⑴、硼的几种同素异形体
相关链接:
已知的硼同位素有14种,其中10B和11B属于天然稳定同位素,
其他同位素都带有放射性。
硼的同素异形体包括无定形硼和多种晶形硼。
目前报道的晶形硼至少有16种,绝大多数都没有深入地鉴定。
但纯相只有晶状硼有α-菱形硼(B12)、β-菱形硼(B105)、四方硼B192和正交相γ硼-B28,以及六方形,*三方形等六种。
不存在独立的B12分子。
(B12)二十面体只是原子晶体中的一个基本单元或称为基本结构单元(不是结构基元)。
B12单元在空间采取不同的排布连接方式,则形成晶体硼单质的不同晶型。
单质硼有多种复杂的晶体结构,其中最重要的一种是α-菱形硼,其基本结构单元为正二十面体的对称几何构型,然后由B12的这种二十面体的排布起来组成六方晶系的α-菱形硼。
α-菱形硼是由B12单元组成的层状结构,晶体中既有普通的σ键,又有三中心二电子键。
许多B原子的成键电子在相当大的程度上是离域的,这样的晶体属于原子晶体。
⑵、α-菱形硼
①、认识基本结构单元B12
定理:
简单多面体的顶点数V、棱数E及面数F间有关系,欧拉公式:
V-E+F=2。
B12正二十面体共20个面,每个面都是正三角形;
每个面角都是五面角;
共12个顶点。
每个B与另5个B相连,有5条棱与之有关,合计5×
12/2=30条棱。
B12中有3×
12=36个价电子。
-菱形硼中,在每个二十面体内部,相邻硼原子之间的键长分别为173ppm、178ppm和179ppm,平均值是177ppm(可以看作每个硼原子与邻近的5个硼原子距离相等,dB-B=177pm)。
二十面体的排列可将其点阵划分成六方晶胞,a0=490.8ppm,c0=1256.7ppm。
②、α-菱形硼中B12二十面体
B为sp3杂化,上下各有5个等边三角形,中部有10个等边三角形,见图1-1。
α-菱形硼(B12)的结构:
由于硼的缺电子特征,其晶体结构在所有元素中具有最
特殊的复杂性。
α-菱形硼的基本结构单元(B12)是正二十面体,形成多中心缺电子
键,构成多面体。
其中有正常B-B,2c-2e键;
B-B-B键,3c-2e键。
基本结构单
元间以3c-2e键和σ键相互连接而成硼晶体。
B12单元中,前面3个硼原子(红色球)构成的三角形,其所在的平面与后面
3个硼原子(蓝色球)构成的三角形所在的平面互相平行。
B12单元中,中层6个硼原子不在同一平面内,见图1-2。
图1-1
,图1-2
③、-菱形硼结构六方晶格
B12是晶体硼中的一个单元结构,是以每一个B为顶点,每个B上都向外伸出
一个键与其它单元结构相连。
如果将每个单元结构所围成的区域叫做空穴,那么以这个空穴为中心的B框架又是B12。
-菱形硼结构六方晶格
图1-3
,图1-4
,图1-5
α-菱形硼-----层状结构。
在α-菱形硼中的三中心二电子键(虚线三角形表示三
中心键,虚线三角形角顶位置的3个B原子之间共用2个电子成键)。
见图1-3
与外部B12成键。
●腰部:
6个B原子(1、2、7、12、10、4)与同一平面内相邻的另6个B12共形成6个3c-2e键,其B-B键长203nm,用去6×
2/3e=4e;
见图1-3。
●顶部和底部:
顶部(3、8、9见上面图1-5黄色的▲)和底部(5、6、11),各3个B原子与上一层3个B原子或下一层3个B原子共形成6个正常B-B,2c-2e键,见图1-4。
其B-B键长171nm,共用去6×
(2/2)e=6e;
每个B12与外部B12成键共用去4e+6e=10e。
在B12中:
36个价电子参与成键情况如下:
与外部B12成键小结
在α-菱形硼晶格中,每个二十面体通过处在腰部的6个B原子以三中心两电子键与在同一平面内的相邻的6个二十面体连接起来(其中虚线三角形表示三中心二电子键,键长203pm)。
二十面体组成的片层一层又一层结合起来,层间结合靠二十面体上下各3个硼原子以6个正常B-B共价键(即二中心二电子键,键长171pm)同上下两层的6个邻近的二十面体相连接,3个在上一层,3个在下一层。
在α-菱形硼的晶体结构中由三角形二十面相互连接成的密堆积层。
图中由3个B原子的三线段相交于一点代表3c-2eB-B-B键,而不代表原子。
前后片层之间,通过B-B键结合。
这些B原子是B12结构单元中前部和后部的硼原子。
与内部成键
B12单元内部成键,根据多面体顶角规则,由n个顶角形成的多面体中成键轨道为n+1个,可容纳电子数为2n+2。
在B12中多面体顶点数n=12,所以成键轨道数n+1=13,用于形成正二十面体、亦即B12单元内部成键,所需电子数目为2n+2=13×
2=26。
总的36个电子分配用于内部成键的电子数为26e,与外部B12成键共用去4e+6e=10e。
总的价电子数:
10+26=36
与B12价电子数一致。
在一个封闭型-Bn骨干中,只有3个2c-2eB-B共价键,还有(n-2)个B-B-B3c-2e
键。
对于B12三角二十面体单元,有3个2c-2eB-B键和10个3c-2eB-B-B多中
心键。
B12单元中的化学键(3个2c-2eB-B键:
1-10,3-11和5-12,还有10个B-B-B
3c-2e键:
例如1-2-7,1-6-8,…)的位置见图1-6和图1-7
图1-6
,图1-7
-菱形硼的结构较为复杂,它的点阵和-菱形硼属同一空间群,但晶格常数为a0=1014.5ppm,c0=6528.0ppm,每个晶胞含105个硼原子,有B84+2B10+B的复杂排列。
B84单元内的B-B键长比-菱形硼中的B12单元内的B-B键长有所增加,平均值为183ppm。
四方硼有三种变体:
四方硼-I、四方硼-II和四方硼-III,四方硼-I亦称-四方硼,其晶胞大小为:
a0=875ppm,c0=506ppm,含50个硼原子,B-B键长为175-185ppm。
3、硼的物理性质:
无定形硼为棕色粉末,化学活性高。
晶体硼黑灰色,硬度大(莫氏硬度9.5接近金刚石),电导率随温度升高增大。
熔沸点(m.p.2277℃,b.p.3658℃)都很高,原子晶体。
4、硼的化学性质
对于单质硼的同素异构形体而言,结晶状单质硼较惰性,无定形硼则比较活泼。
硼通常呈现+3氧化态,负氧化态的情况很少,形成化学键时具有较强的共价键倾向。
硼原子的缺电子性对它的化学行为有着决定性影响。
B是亲F、亲O元素
B-F
Si-F
B-O
Si-O
C-F
C-O
键能/kJ·
mol-1
613
565
560-690
452
485
358
硼和硅一样在常温下较惰性,仅与F2反应。
在高温下活泼显还原性。
⑴、无定形硼较活泼,高温下显还原性。
高温下能与非金属N2,O2,S,X2以及金属发生反应,硼的化学是高温化学。
①、跟卤素反应
R.T.2B(s)+3F2(g)=2BF3,(B亲F);
2B+3Cl2=2BCl3与硅相似,2B+3X2
2BX3(X=Cl,Br,I);
卤素单质
Cl2
Br2
I2
反应温度/℃
400
600
700
产物
BCl3
BBr3
BI3
②、跟氧反应:
700℃,4B(s)+3O2(g)
2B2O3(B亲O),放出大量热
ΔrHmӨ(298.15K)=-2887kJ·
mol-1,ΔrGmӨ(298.15K)=-2368kJ·
mol-1;
硼与氧大约在4500C时发生反应,由于生成的B2O3覆盖层阻碍进一步氧化,所以反应会逐渐停止下来。
只有1000℃以上覆盖层蒸发,反应才得以持续进行。
硼能将CO、CO2、N2O、NO、P2O5、SO2、As2O3、As2O5等还原。
(B亲O)∴B在炼钢中作脱氧剂。
③、硼与其他非金属反应的产物及所需温度条件列在下表中
非金属单质
S
P
N2
As
Si
1600
1000
1050
800
<
1370
>
1370
B2S3
B12S
BP
BN(c)
BAs
B4Si
B6Si
2B+3S
将n(B):
n(S)=12:
1的硼和硫的混合物迅速加热至1600~17000C,可以生成B12S。
硼粉与氮在1050~12000下反应,生成BN;
2B(s)+N2(g)
2BN(s)白色石墨。
与硅相似;
立方氮化硼,高温超硬材料,氮化硼是一种优质的磨料。
六方氮化硼:
具有石墨结构,为B-N键极性,为绝缘体。
硼在高温下与碳反应,可形成一系列产物,如B12C3、B4C等。
4B+C
B4C
④、生成金属硼化物
在高温下硼几乎能与所有金属反应生成非化学计量的金属型化合物——金属硼化物。
M4B、M2B、MB、M3B4、MB2、MB6等(M为金属元素),如MgB2、Nb3B4、Cr4B、LaB6、…等。
金属硼化物一般不符合原子价规律,是一些非整比化合物,组成中B原子数目越多,其结构越复杂。
这些化合物一般具有硬度大,熔点高、耐高温、抗化学腐蚀等特点,通常它们都具有特殊的物理和化学性质,有的还具有超导性。
属于一种新型材料。
(注:
金属化合物的类型:
Ⅰ、正常价金属化合物:
其组成是固定的,符合化合价规则。
Ⅱ、电子化合物:
大多数的金属化合物是电子化合物。
其组成可以在一定范围内变动,不符合化合价规则。
Ⅲ、间隙化合物:
间隙化合物的组成固定,但不符合化合价规律。
间隙化合物原子之间的结合既有共价键性质,又有金属键性质。
)
4B+3Nb
Nb3B4,2B+Zr
ZrB2,6B+La
LaB6,2B+3Mg=Mg3B2
3B4C+2CaO+2O2=2CaB6+3CO2,
四硼化镧是一种化学物质,分子式是LaB4,四方晶系。
B6八面体和B2原子连接成三维骨架。
六硼化镧(LaB6)具有CsCl结构,属简单立方晶系,B6八面体连接成三维骨架。
例如,硼化镁(MgB2)是一种离子化合物,m.p.830℃,平面六角形层,晶体结构属六方晶系。
它是一种插层型化合物,镁层和硼层交替排列。
研究人员在2001年发现,它在40K(相当于-233℃)会转变为超导体。
MgB2的层状结构图
;
中国化学会2001年全国高中学生化学
竞赛(省级赛区)试题第5题,晶体沿C轴方向的投影,白球是镁原子投影,黑球是硼原子投影。
解析:
,晶胞
或
。
硼的配位数是6,镁的配位数是12。
空间群p6/mmm
【阅读内容:
硼与电负性比其它的元素所形成的化合物称为硼化物。
绝大多数硼化物是硼与金属所形成的二元化合物,二元硼化物MxBy已知有数百种。
当硼化物中B原子所占比例较少时,常以孤立原子出现;
当硼原子的比例增加,B原子倾向于互相结合在一起,形成多种不同的形式:
B2原子对、Bn单链、Bn双链、平面网格和B6、B12等多面体。
金属硼化物的排列方式可分为独个硼原子型(M2B、M3B和M4B)、锯齿链型(MB)、双链型(M3B4)、六方形层(MB2)及三维骨架型(MB4、MB6和MB12)等。
金属硼化物常常具有特殊的化学和物理性质。
一般都很硬,熔点高(耐火物质),化学极端惰性,抗腐蚀,能导电,有的还具有超导性。
硼化物的一般特征是化学惰性,特别是对非氧化性试剂其化学惰性更为突出。
主族元素硼化物的耐蚀能力随硼含量的增加而增强,过渡金属元素硼化物的耐蚀能力随金属原子的原子序数增加而增强。
所有硼化物都能溶解在王水、以及硝酸和硫酸、硝酸和过氧化氢等一些氧化性混合酸中,金属硼化物常常可与无水酸反应。
各类硼化物都能与氟剧烈地反应,在加热条件下都可被空气氧化。
由于金属硼化物是耐高温的难熔、坚硬材料,熔点高、抗化学侵蚀、优良的导体,因此过渡金属硼化物常用作涡轮机的叶片、燃烧室的衬里、火箭喷咀、烧蚀挡板及磁流体发电的电力发生部件等。
例如,六硼化钙的分子式CaB6,立方晶体结构,是黑灰色粉末,高熔点为2235℃,相对密度2.33g/cm3(15℃),高硬度(莫氏硬度9),高化学稳定性,不溶于盐酸、氢氟酸、稀硫酸。
不溶于水,能被氯、氟、硝酸及过氧化氢等氧化剂所侵蚀,与碱反应很慢。
在常温下,空气中稳定不易燃。
具有半导体性质和中子吸收性能、CaB6砖是相当便宜的中子防护板,无毒性。
六硼化物是优良的电子发射材料。
金属硼化物的制备方法主要有:
单质高温的直接合成,单质硼还原金属氧化物以及金属氢化物、氢气还原卤化硼和金属卤化物的混合物,金属还原卤化硼,熔盐的电解合成,碳还原B2O3和金属氧化物的混合物,碳化硼还原金属氧化物,金属还原B2O3和金属氧化物的混合物,金属与碳化硼反应及在水溶液中用NaB
H4还原金属离子等方法。
】
⑵、与非金属氧化物作用
B能与许多稳定的氧化物反应,如从SiO2、P2O5、H2O中夺取氧而作还原剂(硼氧键的键能很大)。
赤热下,无定形硼可以同水蒸气作用生成硼酸:
与硅相似。
2B(无定形)+6H2O(g)
2B(OH)3+3H2↑,3SiO2+4B
3Si+2B2O3
10B+3P2O5
5B2O3+6P
⑶、与氧化性的酸反应,生成H3BO3
无定形硼不与非氧化性酸(如盐酸)作用,但可被氧化性酸氧化,如无定形B被热的浓H2SO4或浓HNO3氧化,比硅活泼些:
2B(s)+3H2SO4(浓)=2H3BO3+3SO2(g),B(s)+3HNO3(浓)=H3BO3+3NO2(g)
⑷、晶状体硼对沸腾的浓NaOH溶液和<
500℃熔融的NaOH有耐蚀性(抵御作用)。
但是,有氧化剂存在时,晶状硼就可以与熔融的强碱起反应:
2B+2KOH+3KNO3
3KNO2+2KBO2+H2O
无定形硼与浓强碱溶液的反应,无定形硼与NaOH的反应类似于硅的反应,
2B+2NaOH(浓)+2H2O
2NaBO2+3H2↑,2B+6NaOH(熔融)=2Na3BO3+3H2
*比较:
白磷、硅、硫磺、硼与强碱反应不同。
Si和强碱的作用类似于砷,比砷更容易些;
Si+2NaOH+H2O=Na2SiO3+2H2↑
P4+3NaOH+3H2O
PH3+3NaH2PO2(次磷酸钠用于化学镀镍)
3S+6NaOH
2Na2S+Na2SO3+3H2O
5、单质硼的制备,和Si制备相比较
⑴、高温金属热还原法:
(用Mg或Al还原B2O3,相当于用C还原SiO2)
B2O3(用Na、Mg、Zn、CaC2),BCl3(用Na、Zn),BF3(用CaH2)。
镁热还原法:
B2O3+3Mg
2B+3MgO,KBF4+3Na=3NaF+KF+B。
这种方法制备的硼通常是纯度95~98%的无定形硼。
这是由于单质硼的高熔沸点和高温具有高反应活性,故不易制得纯B。
为什么不能用铝来还原?
答:
B2O3+2Al=2B+Al2O3,产物中的杂质硼化物、氧化物,用碱、HCl、HF溶除。
而高温灼热过的Al2O3不溶于酸、碱,还有黑色的AlB12杂质生成,难与B(s)分离。
对比:
用Mg还原SiO2也可以制Si,但要注意Si和Mg将进一步结合成Mg2Si。
⑵、硼的卤化物的氢热还原,最纯的单质硼用氢还原法制得:
用H2还原三溴化硼,相当于用H2还原SiCl4。
令氢和三溴化硼的混合气体经过钽丝或钨丝,电热温度达到1100~1300℃,三溴化硼在高温下被氢还原,生成的硼在钽丝(钨丝)上成片状或针状结构。
2BBr3(g)+3H2(g)
2B(s)+6HBr(g),得到的四方硼,它是由B12二十面体构成;
如果反应温度在10000C左右,则生成-菱形硼晶体为主的产物;
在1100~12000C时,生成以-菱形硼晶体为主的产物。
B(晶态硼)>
99.95%。
⑶、卤化硼热分解法:
(晶态纯硼)
BBr3、BI3用卤化硼热分解可得到纯度达99.95%的α-菱形硼,使熔融硼结晶,
可得到-菱形硼。
在钽丝、钨丝或氮化硼表面,加热到800~1300℃热分解BI3、硼氢化物等:
12BI3=B12(c)+18I2(g),12BBr3=B12(c)+18Br2(g)
高纯硼的制备除采用热丝法和热解法外,还可采用真空熔炼和区域熔融等方法提纯单质。
⑷、电解法:
电解还原熔融的硼酸盐或四硼酸盐
将KBF4在800℃下,加入KCl-KF助熔剂,电解还原可得到纯度为95%的粉
末状的粗硼,这种方法相对成本较低。
该体系中各组分的熔点相对较低,KCl为775℃,KF为858℃,KBF4为530℃。
B2O3在KBF4中的融体电解,可得棕色的粉末硼。
在以NaCl-KCl-Na2B4O7-B2O3四元系电解质的熔盐电解时,阴极的电解产物非晶态的硼粉是阴极电解生成的金属钠化学还原氧化硼生成的。
⑸、用硼砂制取无定形硼:
Na2B4O7→H3BO3→B2O3→B,用氢氧化钠、盐酸和氢氟酸处理反应产物。
Na2B4O7·
10H2O+2HCl=4H3BO3+2NaCl+5H2O,2H3BO3=B2O3+3H2O(800K)
高温还原氧化硼,用活泼金属Na,Mg等还原剂,制得无定形硼。
B2O3+3Mg=3MgO+2B(800K)
用盐酸洗去氧化镁和未反应的金属镁,就得到棕色的无定形硼。
硼在高温下
跟多种金属反应而生成硼化物,因此此时得到的无定形硼中往往还含有金属氧化物、金属硼化物和未还原的硼的氧化物杂质(酸不溶物xMgO·
B2O3、MgxBy、BxO)。
要除去这些杂质,应使产物跟稀盐酸一起煮沸,再用氢氟酸处理。
得到的棕色或暗黑色粉末无定形硼,其纯度较低(95~98%)。
MgO+2HCl=MgCl2+H2O,B2O3+6HF=2BF3(g)+3H2O,BF3+HF=HBF4
⑹、硼的工业制法
①、*碱法:
从硼镁矿→单质硼→精制硼
a、碱溶:
Mg2B2O5·
H2O+2NaOH(浓)=2NaBO2+2Mg(OH)2,用热浓碱溶液复分解硼镁矿,得到偏硼酸钠NaBO2晶体,然后使之溶于水,分离NaBO2结晶出来浓的水溶液。
b、通入CO2调节pH,浓缩,分离出硼砂:
4NaBO2+CO2+10H2O=Na2B4O7·
10H2O+Na2CO3
c、分离出的硼砂溶于水,用H2SO4调节酸度,可析出溶解度小的硼酸晶体:
Na2B4O7+H2SO4+5H2O=4H3BO3+Na2SO4
d、加热脱水:
2H3BO3
B2O3+3H2O
e、还原:
用Mg还原,得到无定形粗硼:
2B(粗硼)+3MgO
粗硼含金属氧化物、硼化物及未反应完的B2O3,用HCl,NaOH,HF(l)处理,→纯硼(95%~98%)
f、精制:
2B(95%~98%的纯硼)+3I2=2BI3
热分解2BI3
2B(晶态硼α-菱形硼)+3I2(反应条件:
800-1100℃,Ta金属丝)
99.95%
②、*酸法:
可以采用硫酸一步分解硼镁矿制H3BO3的方法,
H2O+2H2SO4
2H3BO3+2MgSO4
虽然一步可以得到H3BO3,但需要满足耐酸设备等苛刻条件,不如碱法简单。
6、硼烷(硼的氢化物)
硼氢化合物性质与碳的氢化物(烷烃)、硅的氢化物(硅烷)相似。
这类氢化物的
物理性质相似于烷烃,故硼的氢化物称为硼烷。
硼氢化合物虽没有碳氢化合物种
类多,但远比硅烷多。
其结构比烷烃、硅烷复杂。
类型
通式
BnHn+4
BnHn+6
举例
B2H6(乙硼烷),B5H9(戊硼烷-9)
B4H10(丁硼烷-10),B5H11(戊硼烷-11)
由于硼烷及其衍生物的特殊结构、性质和用途,使硼烷及其有关的碳硼烷化学成为目前无机化学主要发展领域之一。
⑴、组成:
缺电子的硼氢簇合物B2H6和C2H4等电子。
多数硼烷组成为少氢型BnHn+4和多氢型BnHn+6两大类。
少数为BnHn+8、BnHn+10。
BnHn+4类和BnHn+6类,共20多种,以