全国大联考辽宁新课标Ⅱ辽宁省部分重点中学协作体届高三模拟考试理科综合化学试题Word格式文档下载.docx
《全国大联考辽宁新课标Ⅱ辽宁省部分重点中学协作体届高三模拟考试理科综合化学试题Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《全国大联考辽宁新课标Ⅱ辽宁省部分重点中学协作体届高三模拟考试理科综合化学试题Word格式文档下载.docx(19页珍藏版)》请在冰豆网上搜索。
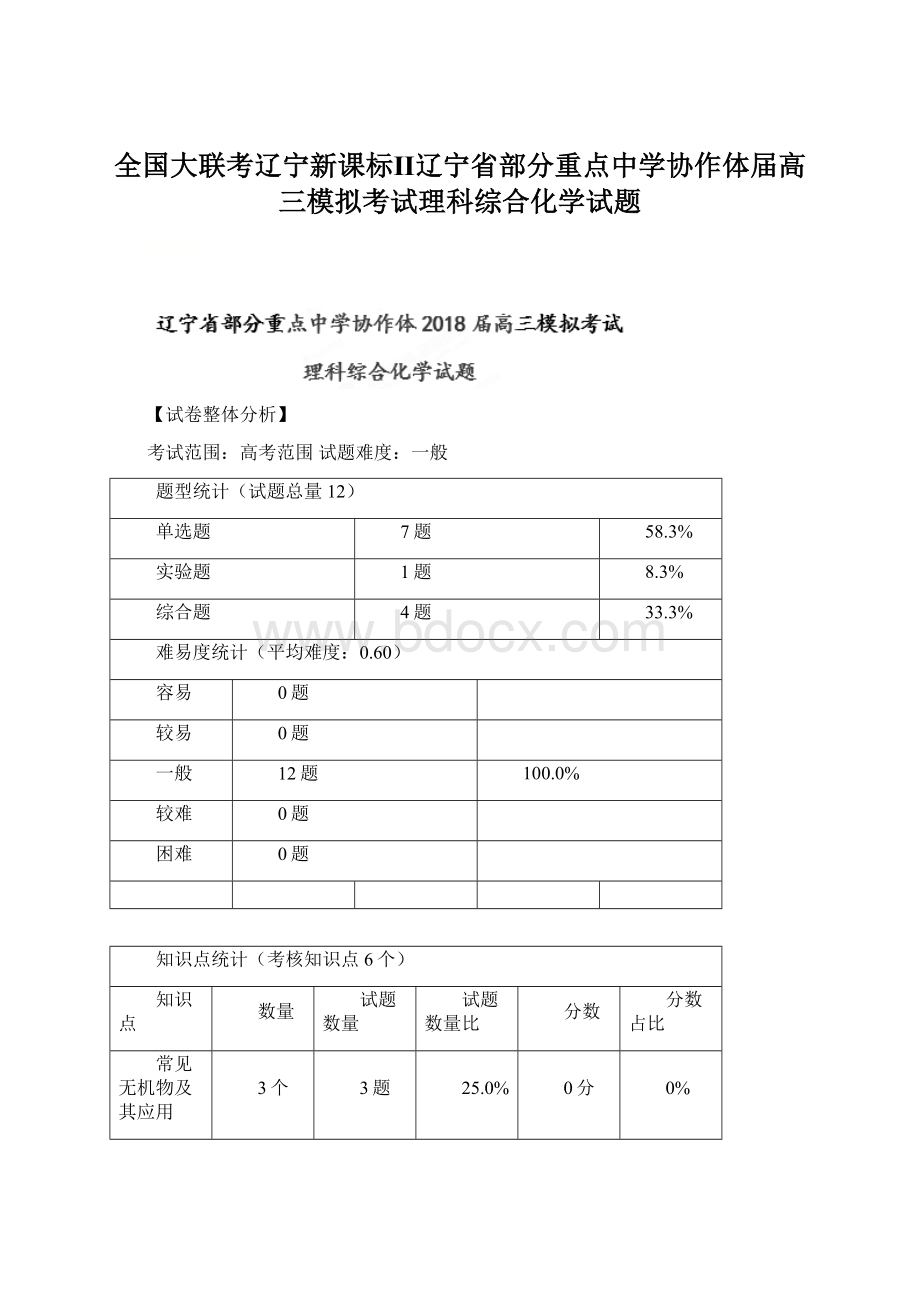
题型
1
有机物的合成
2
同分异构体确定途径——官能团异构
3
含氧化铝的混合物的提纯
4
阿伏加德罗常数的求算
5
焰色反应
6
电解原理的应用
7
探究物质组成或测量物质的含量
8
杂化轨道理论理解
9
化学反应原理综合考查
10
无机综合推断
11
沉淀转化
12
酸碱中和滴定原理的应用
辽宁省部分重点中学协作体2018届高三模拟考试
理科综合化学试题
第I卷(选择题)
1.中华传统文化源远流长,古代化学与生产生活密切相关。
下列对描述内容分析错误的是()
选项
描述
分析
A
“丹砂(HgS)烧之成水银,积变又还成丹砂”
此过程涉及化学变化
B
“用浓酒和糟入甑,蒸令气上……其清如水”
涉及的操作是蒸馏
C
“以火烧之,紫青烟起,乃真硝石也”
硝石中含碘单质
D
“采蒿蓼之属,晒干烧灰,以水淋汁,浣衣发面,去垢”
利用其水解显碱性去污
【答案】C
【解析】A、“丹砂(HgS)烧之成水银,积变又还成丹砂”发生汞与氧气反应生成氧化汞,氧化汞加热分解生成汞和氧气,涉及化学反应,选项A正确;
B、“用浓酒和糟入甑,蒸令气上……其清如水”可见,烧酒的酿造方法为:
加热浓酒和糟,利用沸点的不同,将酒蒸出,然后用器皿盛装冷凝后的馏分,即蒸馏,选项B正确;
C、硝石为硝酸钾,不含碘单质,选项C错误;
D、“采蒿蓼之属,晒干烧灰”,说明“石碱”成分来自植物烧成的灰中的成分碳酸钾,其水解显碱性能洗去油污,选项D正确。
答案选C。
2.设NA为阿伏加德罗常数的值。
下列叙述正确的是()
A.室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
B.1mol硝基(-NO2)与46g二氧化氮所含的电子数均为23NA
C.16.2g14C10H22中含有的共价键数目为3.2NA
D.向含1molFeI2的溶液中通入1molCl2充分反应,该反应转移电子数为3NA
【答案】B
【解析】A.酸或碱抑制水的电离,水的电离程度减小,故室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为10-13NA,选项A错误;
B.硝基(-NO2)与二氧化氮分子中均含有23个电子,所以1mol硝基(-NO2)与46g二氧化氮所含的电子数均为23NA,选项B正确;
C.16.2g14C10H22,即0.1mol,含有的共价键数目为0.1
(22+10-1)NA=3.1NA,选项C错误;
D.向含1molFeI2的溶液中通入1molCl2充分反应,氯气不足,该反应转移电子数为2NA,选项D错误。
答案选B。
点睛:
本题考查了阿伏伽德罗常数的应用,主要考查溶液组成的计算,烷烃分子结构的特征应用,溶液中存在水的电离,气体摩尔体积的条件应用。
易错点为选项B,硝基(-NO2)与二氧化氮分子中均含有23个电子,所以1mol硝基(-NO2)与46g二氧化氮所含的电子数均为23NA。
3.下列关于有机化合物的叙述不正确的是()
A.正丁烷与新戊烷互为同系物,
与
互为同分异构体
B.甲酸甲酯、油脂分别与热NaOH溶液发生水解反应,均有醇生成
C.用水只能鉴别苯和溴苯,不能分离苯和溴苯的混合物
D.
的一氯代物有9种(不考虑立体异构)
【答案】D
4.x、y、z、w是原子序数依次增大的短周期元素,由这四种元素组成的一种化合物a在加热时完全分解为三种产物,其中一种产物b是能使品红溶液褪色的气体,另一种产物c是能使湿润红色石蕊试纸变蓝的气体。
下列说法正确的是()
A.简单离子半径:
x<
y<
z<
w
B.y的简单氢化物的热稳定性比z的强
C.a、b、c中均含有极性共价健:
a属于电解质,b和c都属于
非电解质
D.x、y、z
三种元素形成的化合物一定会抑制水的电离
【解析】x、y、z、w是原子序数依次增大的短周期元素,由这四种元素组成的一种化合物a在加热时完全分解为三种产物,其中一种产物b是能使品红溶液褪色的二氧化硫气体,另一种产物c是能使湿润红色石蕊试纸变蓝的气体氨气,另一种为水,故a为亚硫酸氢铵或亚硫酸铵,x、y、z、w分别为H、N、O、S。
A.具有相同电子式结构的离子核电荷数越大,半径越小,故简单离子半径:
z<
y<
w,选项A错误;
B.非金属性越强气态氢化物的稳定性越强,故y的简单氢化物的热稳定性比z的弱,选项B错误;
a为亚硫酸氢铵或亚硫酸铵属于电解质,b为二氧化硫和c为氨气都属于
非电解质,选项C正确;
三种元素形成的化合物若为硝酸铵则水解促进水的电离,选项D错误。
5.下列实验中,对应的操作、现象及实验原理或结论均正确的是()
实验目的
操作和现象
实验原理或结论
验证Fe(OH)3的溶解度小于Mg(OH)2
向1mLlmol·
L-1MgCl2溶液中滴加2滴2mol·
L-1NaOH溶液,生成白色沉淀;
再滴加2滴1mol·
L-1'
FeCl3溶液,白色沉淀变成红褐色沉淀
3Mg(OH)2(s)+2Fe3+(aq)
2Fe(OH)3(s)+3Mg2+(aq)
比
较
HClO
和CH3COOH
的酸性
室温下,用pH试纸分别测定浓度为0.1mol·
L-1NaClO溶液和0.1mol·
L-1CH3COONa溶液的pH
酸越弱,酸根离子水解程度越大,其盐溶液碱性越强
提纯混有少量硝酸钾的氯化钠固体
在较高温度下制得浓溶液再冷却结晶、过滤、干燥
氯化钠溶解度随温度升高变化不大,而硝酸钾溶解度随温度升高显著增大
检验某溶液中是否含有SO42-
向该溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成
该溶液中一定含有SO42-
【答案】A
【解析】A.溶解度大的物质能转化为溶解度小的物质,产生白色沉淀后,将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,发生反应3Mg(OH)2(s)+2Fe3+(aq)
2Fe(OH)3(s)+3Mg2+(aq),白色沉淀转化为红褐色,选项A正确;
;
B.NaClO溶液具有强氧化性,可使pH试纸褪色,应用pH计,选项B错误;
C、氯化钠中混有少量的硝酸钾,氯化钠是大量的,制得的饱和溶液中硝酸钾量较少,不能采取降温结晶的方法,选项C错误;
D、向溶液中滴加用盐酸酸化的BaCl2溶液,可能生成AgCl沉淀,应先加入盐酸酸化,如无现象,再加入氯化钡,选项D错误;
答案选A。
本题考查化学实验方案评价,为高频考点,涉及物质分离提纯、盐类水解、弱电解质的电离、难溶物转化等知识点,明确实验原理及物质性质是解本题关键,注意根据物质性质差异性选取合适的分离提纯方法。
注意溶解度大的物质能转化为溶解度小的物质。
6.目前海水液化可采用双极膜电液析法、同时获得副产品,其模拟工作原理如图所示。
其中双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源。
M、N
为离子交换膜。
A.X
电极为电解池的阴极,该电极反应式为:
2H+-2e-=H2↑
B.电子流向:
电源负极→X电极→Y
电极→电源正极
C.电路中每转移1mol
电子,X、Y两极共得到标准状况下16.8L的气体
D.M为阳离子交换膜,A室获得副产品NaOH;
若去掉B室双极膜,B室产物不变
本题考查电解原理,注意审题,不再是电解饱和食盐水的反应,由于双极膜(BP)是阴、阳复合膜的存在,使电解反应变成了电解水,是易错点。
阴极是物质得到电子,发生还原反应;
溶液中的阳离子向阴极移动,阴离子向阳极移动。
7.用0.1mol·
L-1KOH溶液滴定20mL0.1mol·
L-1H2A
溶液的滴定曲线如图所示(曲线上的数字为pH)。
已知pKa=-lgKa,25℃时H2A的pKa1=1.85,pKa2=7.19。
A.a点所得溶液中:
2c(H2A)+c(A2-)=0.1mol/L
B.b点所得溶液中:
2c(H2A)+c(H+)=c(A2-)+c(OH-)
C.c
点所得溶液中:
c(K+)<
3c(HA-)
D.d点所得溶液中A2-第一级水解平衡常数为10-6.81
本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析判断及计算能力,明确电离平衡常数概念及表达式、溶液中各点溶质成分及其性质是解本题关键,难点是电离平衡常数的灵活运用,注意利用溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断。
第II卷(非选择题)
8.亚硝酸钠(NaNO2)
是一种工业盐,外观与食盐相似。
下面是某学习小组设计的NaNO2制取实验和纯度检验实验。
该小组收集了相关资料:
①SO2
和HNO3溶液反应生成NOx
和H2SO4
②3NO2-+2H+=2NO↑+NO3-+H2O
③NO2-+Ag+=AgNO2↓(AgNO2为淡黄色接近白色固体,在水中形成沉淀)
Ⅰ.亚硝酸钠的制取实验
(1)
仪器a的名称为________________________,A装置中发生的化学反应方程式为_____________________________________________。
(2)B装置中多孔球泡的作用是_________________________________________________。
(3)若装置B中逸出的NO与NO2气体物质的量之比为2∶1,则装置B中发生反应的化学方程式为_________________________________________________________。
(4)实验过程中需控制C装置中溶液pH>
7,否则C中生成的NaNO2的产量会下降,理由是_____________________________________________________。
(5)
请根据题干所给信息设计实验证明C装置中有NO2产生:
_________________________________。
(限选用的试剂:
稀硝酸、硝酸银溶液、NaOH溶液)
Ⅱ.亚硝酸钠的纯度检验
已知:
NO2-
+
MnO4-+
H+→NO3-+
Mn2++H2O
(6)反应结束后C中溶液通过结晶获得NaNO2粗产品mg,溶解后稀释至250mL,分别取25.00mL用cmol/L的酸性KMnO4溶液平行滴定三次,平均每次消耗酸性KMnO4溶液的体积为VmL。
则粗产品中NaNO2的质量分数为_____________(用含c、V、m的式子表示)。
【答案】分液漏斗Na2SO3+H2SO4
(浓)=Na2SO4+SO2↑+H2O增大气体与溶液的接触面积,让反应充分进行7SO2+6HNO3+4H2O=4NO+2NO2+7H2SO4如果pH<
7,亚硝酸盐会转化为硝酸盐和NO气体,使其产量下降取C中溶液少量于试管中,加足量稀硝酸有气体生成,遇空气变红棕色,则证明C中有NO2-
生成(345cv/2m)
%或3.45cv/2m
【解析】
仪器a的名称为分液漏斗,A装置中利用浓硫酸与亚硫酸钠反应生成硫酸钠、二氧化硫和水制备二氧化硫,发生的化学反应方程式为Na2SO3+H2SO4
(浓)=Na2SO4+SO2↑+H2O;
(2)B装置中多孔球泡的作用是增大气体与溶液的接触面积,让反应充分进行;
(3)若装置B中逸出的NO与NO2气体物质的量之比为2∶1,则装置B中发生反应的化学方程式为7SO2+6HNO3+4H2O=4NO+2NO2+7H2SO4;
(4)根据已知信息可知如果pH<
7,亚硝酸盐会转化为硝酸盐和NO气体,使NaNO2的产量会下降;
取C中溶液少量于试管中,加足量稀硝酸有气体生成,遇空气变红棕色,则证明C中有NO2-
生成;
(6)消耗酸性KMnO4是0.001cVmol,根据方程式可知亚硝酸钠是0.0025cVmol,因此粗产品中NaNO2的质量分数为
。
9.用方铅矿精矿(
主要为PbS)和软锰矿(主要为MnO2,还有少量Fe2O3,Al2O3等杂质)
制备PbSO4和Mn3O4的工艺流程如下:
①PbS+MnO2+
4
H+=
Mn2++Pb2++S+2H2O
②25℃
时,Ksp(PbCl2)=1.6×
10-5,Ksp(PbSO4)=1.8×
10-8
③PbCl2
(s)+2Cl-(aq)
PbCl42-(aq)
△H>
(1)80℃用盐酸处理两种矿石,为加快酸浸速率,还可采用的方法是_______________(任写一种)。
(2)向酸浸液中加入饱和食盐水的目的是_________________;
加入物质X可用于调节酸浸液的pH值,物质X可以是___________(填字母)。
A.MnCO3B.NaOHC.ZnOD.PbO
(3)滤渣中含有两种金属杂质形成的化合物,其成分为_____________(写化学式);
请设计分离两种金属化合物的路线图(用化学式表示物质,用箭头表示转化关系,箭头上注明试剂和分离方法)。
______________________________________
(4)向滤液2中通入NH3和O2发生反应,写出总反应的离子方程式。
________________________
(5)用Mn3O4为原料可以获得金属锰,选择合适的冶炼方法为___________
(填字母)。
A.热还原法B.电解法C.热分解法
(6)求25℃氯化铅沉淀转化为硫酸铅沉淀反应的平衡常数K=___________(保留到整数位)。
【答案】粉碎矿石或搅拌或适当增加盐酸浓度增大PbCl2的溶解度ADAl(OH)3、Fe
(OH)3
6Mn2++12NH3+6H2O+O2=2Mn3O4+12NH4+A889
K=
=
10.甲醇可采用多种方法制备,其用途广泛,是重要的化工原料。
Ⅰ.利用合成气(CO、CO2、H2)在催化剂作用下合成甲醇,发生反应如下:
①CO(g)+2H2(g)
CH3OH(g)
②CO2(g)+3H2(g)
CH3OH(g)
H2O(g)
(1)反应①过程中能量变化如下图所示,下列说法正确的是______________(填选项标号)。
A.①反应的△H=逆反应活化能-正反应活化能
B.把1molCO(g)和2molH2(g)充入密闭容器中充分反应,达平衡时放出的热量为91kJ
C.从图中信息可知加入催化剂能改变反应历程和热效应
D.相同条件下,CO(g)和H2(g)反应生成1mol液态CH3OH放出的热量大于91kJ
(2)
现利用①和②两个反应合成CH3OH,
已知CO可使反应的催化剂寿命下降。
若氢碳比表示为f=[(n(H2)-n(CO2)]/[(n(CO)-n(CO2)],则理论上f=______________时,原料气的利用率最高。
但生产中往往采用略高于该值的氢碳比,理由是:
______________________________。
Ⅱ.甲醇可用于制取甲酸甲酯,其反应方程式为:
CH3OH(g)+CO(g)
HCOOCH3(g)
△H<
0。
科研人员的部分研究结果如下:
(3)从反应压强对甲醇转化率的影响“效率”图和生产成本角度分析,工业制取甲酸甲酯应选择的最佳压强是______________________(填“3.5×
106
Pa”“4.0×
Pa”或“5.0×
Pa”)。
(4)实际工业生产中采用的温度是80℃,其理由是_______________________________________。
Ⅲ.甲醇还可以用于合成二甲醚,发生的反应为2CH3OH(g)
CH3OCH3(g)+H2O(g)
己知该反应在某温度下的平衡常数为900,此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分浓度如下:
物质
CH3OH
CH3OCH3
H2O
浓度(mol/L)
1.25
0.9
(5)比较此时正、逆反应速率的大小:
v正___________v逆
(填“>
“<
”或“=”)。
(6)
若加入CH3OH后,经6min反应达到平衡,则该时间内平均反应速率v
(CH3OH)
=___________mol/
(L·
min)。
【答案】D2使CO充分反应,避免反应催化剂寿命下降4.0×
106Pa低于80℃、反应速事较小,高于80℃,温度对反应速率影响较小,且反应放热,升温平衡逆向移动,转化率降低>
0.5
(5)Q=
,平衡正向移动,
v正>
v逆
设平衡时生成物的浓度为0.9+x,则甲醇的浓度为(1.25-2x)有:
900=
,解得x=0.6mol/L,故1.25-2x=0.05mol/L,
由表可知,甲醇的起始浓度度为(1.25+1.8)mol/L=3.05mol/L,其平衡浓度为0.05mol/L,
6min变化的浓度为3.0mol/L,故该时间内平均反应速率v
=0.5mol/
11.铁、钛、镍等过渡元素在工业生产和科学研究中具有重要作用,请回答下列问题。
(1)有机铁肥[Fe(H2NCONH2)6](NO3)3的名称叫三硝酸六尿素合铁,是一种配合物,它的中心离子Fe3+的价电子排布式为____________;
该配合物中N
原子的杂化方式有_______________;
它所含非金属元素的电负性由小到大的顺序是__________________。
(2)钛被称为继铁、铝之后的“第三金属”,也叫“未来金属”。
①钛位于周期表的_______区,基态Ti原子的电子占据了____________个原子轨道。
②
工业上可用TiCl4(常温下呈液态)与Mg高温下反应制备钛单质,同时生成MgCl2,
详细解释TiCl4熔点比MgCl2低很多的原因_______________________________________________________。
(3)镍与CO生成的配合物Ni(CO)4中,易提供孤电子对的成键原子是_______________(填元素名称);
1molNi(CO)4中含有的σ键数目为_________________;
写出与CO互为等电子体的一种离子的化学式___________。
(4)镍钛记忆合金用于飞机和字宙飞船。
已知一种钛镍合金的晶胞结构如图所示,其中Ti原子采用面心立方最密堆积方式,该合金中与Ti原子距离最近且相等的Ni原子个数为________;
若合金的密度为ρg/cm3,NA代表阿伏加德罗常数的值,则晶胞中两个钛原子间的最近距离是____________pm。
(用
含
ρ和NA的计算式表示,不必化简)
【答案】3d5sp3杂化和sp2杂化H<
C<
N﹤Od12TiCl4属于分子晶体,熔融时破坏分子间作用力;
而MgCl2属于离子晶体,熔融时破坏离子键,分子间作用力比离子键弱得多,所以TiCl4熔点低得多。
碳8NACN-或C22-6
×
1010
(1)Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:
1s22s22p63s23p63d64s2,铁原子失去最外层4s能级2个电子,然后失去3d能级上的1个电子形成Fe3+,Fe3+的电子排布式为1s22s22p63s23p63d5,所以基态Fe3+的价电子排布式为3d5;
由尿素分子的结构式H2NCONH2可知,尿素分子中N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化;
NO3-中含有3对价层电子对,其离子构型为平面三角形,N原子采取sp2杂化;
元素非金属性越强电负性越大,故电负性H<
N﹤O;
(2)①钛位于周期表的d区,Ti原子核外电子
cm=
1010pm。
12.热播剧《外科风云》中对利多卡因过敏一事的调查拉开了该剧的序幕。
利多卡因的合成路线如下(部分产物略去):
①标准状况下气态烃A的密度ρ=1.16g/L。
②D是分子式为C8H10的芳香烃。
③红外光谱显示C分子中含有
结构。
④
不稳定易转化为
⑤R-NO2
R-NH2(R为烃基结构)。
回答下列问题:
(1)CH2Cl-COOH
的官能团名称________________。
(2)实验室制备烃A的化学方程式_______________________________________________。
(3)B→C的化学方程式_________________________________________________________。
(4)CH2Cl-COOH
CH2Cl-COCl转化过程中CH2Cl-COOH
和COCl2物质的量之比为1∶1时,同时生成的两种无机化合物是_____________。
(5)F→G反应类型为_____________;
G
的结构简式为_______________。
(6)已知:
RCH2-COOH
RCHCl-COOH(R
为烃基或氢原子)。
结合本题信息,以苯和乙醇为有机原料制备
(无机试剂任选),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
_______________
【答案】氯原子、羧基CaC2+2H2O→Ca(OH)2+C2H2↑CHCl2-CHCl2+NaOH
CCl2=CHCl+NaCl+H2OHCl和CO2;
取代反应
【解析】标准状况下气态烃A的密度ρ=1.16g/L,则A的摩尔质量为1.16g/L×
22.4L/mol=26g/mol,故烃A为乙炔;
乙炔与足量氯气发生加成反应生成B为1,1,2,2-四氯乙烷;
红外光谱显示C分子中含有
结构,故B发生消去反应生成C应为1,1,2-三氯乙烯;
D是分子式为C8H10的芳香烃,根据利多卡因分子结构可知D为间二甲苯,间二甲苯在浓硫酸催化下与浓硝酸发生硝化反应生成E为