广西陆川县中学届高三上学期月考理综化学试题Word格式文档下载.docx
《广西陆川县中学届高三上学期月考理综化学试题Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《广西陆川县中学届高三上学期月考理综化学试题Word格式文档下载.docx(16页珍藏版)》请在冰豆网上搜索。
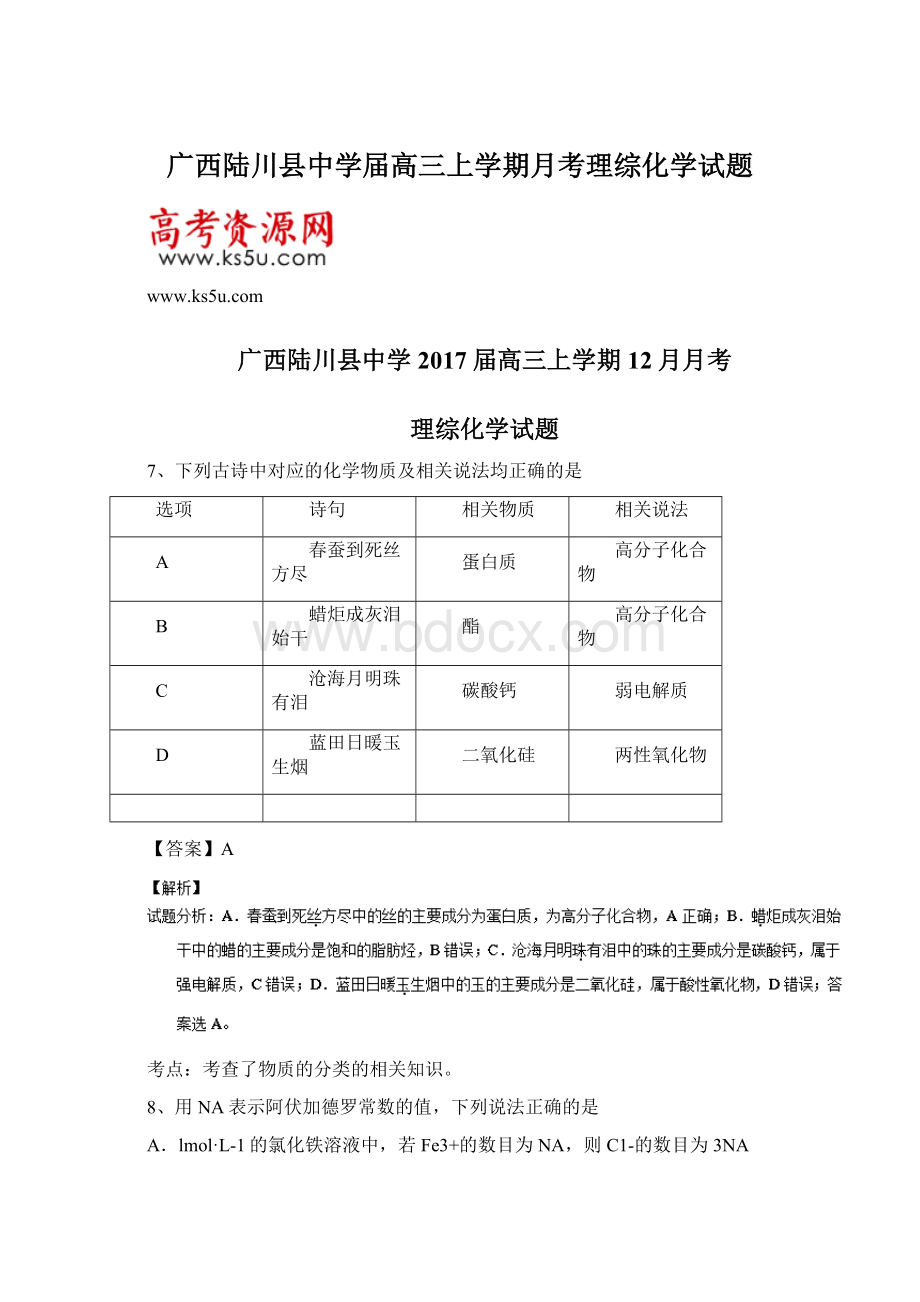
=0.1NA,C正确;
D.标准状况下,2.24LC12是0.1mol,溶于水和水反应生成盐酸和次氯酸,但反应是可逆反应,则转移电子的数目小于0.1NA,D错误,答案选C。
【考点定位】考查阿伏加德罗常数的计算
【名师点晴】要准确把握阿伏加德罗常
数的应用,一要认真理清知识的联系,关注状况条件和物质状态、准确运用物质结构计算、电离和水解知识的融入、留心特殊的化学反应,如本题中Cl2与H2O的反应、阿伏加德罗定律和化学平衡的应用。
避免粗枝大叶不求甚解,做题时才能有的放矢。
二要学会留心关键字词,做题时谨慎细致,避免急于求成而忽略问题的本质。
必须以阿伏加德罗常数为基础点进行辐射,将相关知识总结归纳,在准确把握各量与阿伏加德罗常数之间关系的前提下,着重关注易错点
,并通过练习加强理解掌握,这样才能通过复习切实提高得分率。
9、己知某烃A相对氢气的密度为35,且该烃能使溴的CCl4溶液褪色。
则A的可能结构共有(不考虑立体异构)
A.4种B.5种C.6种D.7种
【答案】B
【考点定位】本题考查了同分异构体的书写方法
【名师点晴】该题是高频考点,题目难度不大,根据题干信息确定该有机物分子式及含有官能团类型为解答关键,注意熟练掌握同分异构体的书写原则,试题培养了学生的灵活应用能力。
10、用下列实验装置进行的实验中,能达到相应实验目的的是
A.用装置甲制取氯气
B.用装置乙干燥氨气
C.用装置丙除去甲烷中混有的乙烯
D.利用装置丁制取硫酸和氢氧化钠,其中b为阴离子交换膜、c为阳离子交换膜
【答案】D
【考点定位】本题考查化学实验方案评价
【名师点晴】该题为高频考点,涉及气体制备、气体干燥、除杂、电解等知识点,明确实验原理及物质性质是解本题关键,侧重考查学生分析判断能力,知道交换膜类型的方法。
11、下列选项中,离子方程式书写正确的是
A.“84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:
C1O3-+5Cl-+6H+=3Cl2↑+3H2O
B.泡沫灭火器的灭火原理:
2A13++3CO32-+3H2O=2Al(OH)3+3CO2↑
C.加入NaClO将污水中的NH3氧化成N2:
3C1O-+2NH3=N2↑+3Cl-+3H2O
D.用足量的氨水吸收硫酸工业尾气中的SO2:
SO2+NH3•H2O=NH4++HSO3-
A.“84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体是氯气:
lO-+Cl-+2H+=Cl2↑+H2O,A错误;
A13++3HCO3-=Al(OH)3+3CO2↑,B错误;
3C1O-+2NH3=N2↑+3Cl-+3H2O,C正确;
SO2+2NH3•H2O=2NH4++SO32—+H2O,D错误,答案选C。
考查离子方程式正误判断
12、下列说法正确的是
A.有HX和HY两种弱酸且酸性HX>
HY,则物质的量浓度相同的NaX和NaY两溶液等体积混合的溶液中有c(X-)>
c(Y-)>
c(OH-)>
c(H+)
B.绝热容器中,向50mL1mol·
L-1的盐酸中加入固体烧碱,水的Kw不变
C.相同温度时,BaSO4分别在相同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液中的溶解度相同
D.相同条件下,测得Na2CO3溶液的pH大于相同物质的量浓度的Na2SO3溶液,说明非金属性:
C<
S
考查弱电解质的电离、盐类水解以及离子浓度大小比较等
26、(15分)2016年3·
15晚会曝光:
“北口义齿”用废钢料制造假牙,经过反复冋收再利用的这种“碎钢”,有害元素浓度越来越高,危害人体!
而纯钛、钴铬、诺必灵等都是正规的义齿金属原料。
钛合金烤瓷牙是目前国内使用最为普遍的一种烤瓷牙。
(1)TiCl4是生产金属钛和钛白的原料,工业上主要用TiO2氯化的方法来制取。
①有人拟用以下氯化反应来制取TiCl4:
TiO2(s)+2Cl2(g)
TiCl4(l)+O2(g)△H=+151kJ/mol,
既能提高TiCl4的产量又加快反应速率,可采用的措施_____________。
(任写1个)
②工业上通常往TiO2和C12反应体系中加入碳单质,在一定条件下制取TiCl4,从化学平衡的角度解释此方法能顺利制取TiCl4的原因______________________________。
(2)某化学实验小组以TiO2和足量CCl4为原料制取TiCl4,装置图如下:
下表是有关物质的性质:
物质
熔点/℃
沸点/℃
其他
CCl4
-23
76.8
与TiCl4互溶
TiCl4
-25
136
遇潮湿空气产生白雾
请回答下列问题:
(1)D仪器的名称为_________________。
写出CCl4的电子式_________________________。
(2)本实验中仪器a采用题给的加热方式的优点是_______________________。
(3)B中TiO2发生反应的化学方程式是__________________。
(4)欲分离C装置中的TiCl4,应采用的实验操作为_____________________(填操作名称)。
(5)若将生成的气体X(少量)缓缓通入Ba(OH)2溶液中,发生反应的离子方程式是______________。
【答案】
(1)①升高温度或增加Cl2的浓度(2分)
②加入的碳与氧气反应,减小产物O2浓度,使该反应平衡向右移动,故能制取TiCl4。
(2分)
(2)①(球形)干燥管(2分);
②受热均匀,能为反应提供稳定的CCl4蒸汽流(2分);
③TiO2+CCl4
TiCl4+CO2↑(2分)
④蒸馏(1分);
⑤CO2+Ba2++2OH-=BaCO3↓+H2O(2分)
(2)为防止产品TiCl4被氧化,实验开始时先点燃A处的酒精灯,使四氯化碳挥发,排尽系统(装置)中的空气,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,B中装置在加热条件下,发生反应TiO2+CCl4
TiCl4+CO2↑;
CCl4、TiCl4熔点较低,C装置使这两种物质转化为液态,二者能互溶,应该采用蒸馏
方法分离,D装置连接空气,由于TiCl4遇潮湿空气产生白雾,发生水解反应,故D装置作用是防止空气中水蒸进入。
①D仪器的名称为(球形)干燥管。
CCl4是共价化合物,电子式为
;
②水浴加热优点是受热均匀,能为反应提供稳定的CCl4蒸汽流;
③TiO2和CCl4为在加热条件下生成TiCl4和CO2,方程式为TiO2+CCl4
④CCl4、TiCl4二者能互溶,应该采用蒸馏方法分离;
⑤向Ba(OH)2溶液中通入CO2,开始产生沉淀,反应的方程式为CO2+Ba2++2OH-=BaCO3↓+H2O。
【考点定位】本题考查实验制备方案设计
【名师点晴】明确原理是解题关键,侧重考查学生装置的分析评价,注意对题目信息的提取与应用,是对学生综合能力的考查。
实验方案设计的注意事项:
1、实验操作顺序:
装置选择与连接→气密性检查→加固体药品→加液体药品→开始实验(按程序)→拆卸仪器→其他处理等。
2、加热操作先后顺序的选择:
若气体制备实验需加热,应先加热气体发生装置,产生气体排出装置中的空气后,再给实验中需要加热的物质加热。
目的是:
①防止爆炸(如氢气还原氧化铜);
②保证产品纯度,阻止反应物或生成物与空气中的物质反应。
熄灭酒精灯的顺序则相反。
3、实验中试剂或产物防止变质或损失:
(1)实验中反应物或产物若易吸水、潮解、水解等,要采取措施防止吸水。
(2)易挥发的液体产物要及时冷却。
(3)易挥发的液体反应物,需在反应装置中加装冷凝回流装置(如长导管、竖直的干燥管、冷凝管等)。
(4)注意防止倒吸的问题。
27、(14分)氮及其化合物在工业生产和国防建设中有广泛应用。
回答下列问题:
(1)氮气性质稳定,可用作保护气。
但在闪电下氮气与氧气可反应,写出该反应式:
__________________。
(2)联氨(N2H4)是一种还原剂。
试结合下表数据,写出N2H4(g)燃烧生成H2O(g)和N2的热化学方程式:
____________________________。
化学键
N-H
N-N
N=N
N
O=O
O-H
键能(kJ/mol)
390.8
193
418
946
497.3
462.8
(3)KCN可用于溶解难溶金属卤化物。
将AgI溶于KCN溶液中,形成稳定的Ag(CN)2-,该转化的离子方程式为:
若已知Ksp(AgI)=1.5×
10-16,Ka=1.0×
10-21,则上述转化的离子方程式的平衡常数K=_________________。
(4)氨的催化氧化生成一氧化氮和水。
该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式:
__________________________。
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2(g)
N2O4(g)△H<
0其相关图像如下。
①0~3s时
v(NO2)增大的原因是_________________________。
②5s时NO2转化率为__________________________。
(1)N2+O2=2NO(2分)
(2)N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543.7kJ/mol(2分)
(3)AgI(s)+2CN-(aq)
Ag(CN)2-(aq)+I-(aq)(2分);
1.5×
105(2分)
(4)NH3—5e—+5OH-=NO+4H2O(2分)
(5)①容器为绝热体系,该反应正向进行放热,体系温度升高,v(NO2)增大(2分)②75%(2分)
将AgI溶于KCN溶液中,形成稳定的Ag(CN)2—,该转化的离子方程式为AgI(s)+2CN-(aq)
Ag(CN)2-(aq)+I-(aq);
上述转化方程式的平衡常数K=
=
=1.5×
105;
(4)氨的催化氧化的方程式为4NH3+5O2
4NO+6H2O,该反应设计成新型电池,在碱性环境下,该电池的负极上氨气失去电子生成一氧化氮气体,电极反应式为NH3—5e-+5OH-=NO+4H2O;
(5)①依据反应是放热反应,在绝热恒容容器中,反应放热,温度升高,反应速率增大,随反应进行二氧化氮浓度减小,反应未达到平衡,0~3s时v(NO2)增大是由于体系温度升高。
②分析图象5s二氧化氮变化浓度=2mol/L-0.5mol/L=1.5mol/L,因此5s时NO2转化率为=
×
100%=75%。
【考点定位】本题主要是考查热化学方程式的书写、电极方程式的书写、Ksp的计算以及外界条件对反应速率和平衡状态的影响等
【名师点晴】应用盖斯定律进行简单计算时,关键在于设计反应过程,同时注意:
①参照新的热化学方程式(目标热化学方程式),结合原热化学方程式(一般2~3个)进行合理“变形”,如热化学方程式颠倒、乘除以某一个数,然后将它们相加、减,得到目标热化学方程式,求出目标热化学方程式的ΔH与原热化学方程式之间ΔH的换算关系。
②当热化学方程式乘、除以某一个数时,ΔH也应相应地乘、除以某一个数;
方程式进行加减运算时,ΔH也同样要进行加减运算,且要带“+”“-”符号,即把ΔH看作一个整体进行运算。
③将一个热化学方程式颠倒书写时,ΔH的符号也随之改变,但数值不变。
④在设计反应过程中,会遇到同一物质的三态(固、液、气)的相互转化,状态由固→液→气变化时,会吸热;
反之会放热。
答题时注意灵活应用。
28、(14分)工业上制取铬酸钠(Na2CrO4)晶体以铬铁矿(主要成分是FeO•Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料,其工艺流程如下:
已知:
①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO2-形式存在且易氧化;
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下。
阳离子
Fe3+
Fe2+
Mg2+
Al3+
Cr3+
开始沉淀时的pH
2.7
7.6
9.0
--
沉淀完全时的pH
3.7
9.6
11.0
8(>
8溶解)
9(>9溶解)
(1)流程中第一次过滤后滤渣的主要成分是__________________(填化学式),两次使用了H2O2进行氧化,写出第二次氧化时的反应离子方程式________________________________________。
(2)流程图中“□”内的操作是________________________________________________。
(3)工业废水中的Na2CrO4遇酸时可转化为Na2Cr2O7,含Cr2O7的废水毒性较大,为了使废水的排放达标,进行如下处理:
①绿矾化学式为FeSO4·
7H20,反应(Ⅰ)的离子方程式为_______________________。
②若处理后的废水中c(Cr3+)=3.0×
10-6mol·
L-1,则废水中c(Fe3+)=___________________mol·
L-1。
(Ksp)=4.0×
10-38,Ksp=6.0×
10-31)
③也可用铁作电极电解处理含Cr2O72-的废水,写出阳极的电极反应式_________________________。
(4)某工厂为了测定重铬酸钠样品的纯度,称取重铬酸钠试样2.5g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL
2
mol/LH2SO4溶液和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,再加入淀粉指示剂,用0.12mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①判断达到滴定终点的依据是_______________________________________。
②若实验中共用去Na2S2O3标准溶液40.00mL,则该工厂的重铬酸钠样品的纯度为__________。
(设整个过程中其它杂质不参与反应)
(除标注外,其余每空2分共14分)(l)SiO2(1分);
2CrO2-+3H2O2+2OH-=2CrO42-+4H2O
(2)蒸发浓缩、冷却结晶、过滤、洗涤、干燥
(3)①Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
②2×
10-13;
③Fe-2e-=Fe2+
(4)①当滴入最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,且30s内不恢复蓝色(1分);
②83.84%
(2)Na2CrO4溶液得到Na2CrO4晶体,可以采取蒸发浓缩、冷却结晶的方法,涉及到的操作有蒸发浓缩、冷却结晶、过滤、洗涤、干燥等;
(3)①反应(I)Cr2O72-转化为Cr3+,亚铁离子被氧化为铁离子,电子转移:
Cr2O72-~2Cr3+~6e-;
6Fe2+~6Fe3+~6e-,所以结合电荷守恒和原子守恒得到离子方程式为:
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
②由KspFe(OH)3=4.0×
10-38,KspCr(OH)3=6.0×
10-31,已知电解后的溶液中c(Cr3+)为3×
10-6mol•L-1,由c(Fe3+)/c(Cr3+)=ksp/Ksp,则溶液中c(Fe3+)=4.0×
10−38/6.0×
10−31×
3×
10-6mol/L=2×
10-13mol/L;
③也可用铁作电极电解处理含Cr2O72-的废水,则铁应该作阳极,因此阳极的电极反应式为Fe-2e-=Fe2+。
所得产品的中重铬酸钠的纯度=2.096/2.500×
100%=83.84%。
【考点定位】本题属于工艺流程制备题目,考查制备原理、实验方案评价、物质分离提纯、计算能力、获取信息的能力,是对基础知识的综合考查
【名师点晴】注意(4)从氧化还原反应的角度分析。
流程题的解题思路为:
明确整个流程及每一部分的目的→仔细分析每步反应发生的条件以及得到的产物的物理或化学性质→结合基础理论与实际问题思考→注意答题的模式与要点。
解决本
类题目的基本方法和步骤为:
(1)从题干中获取有用信息,了解生产的产品。
(2
)然后整体浏览一下流程,基本辨别出预处理、反应、提纯、分离等阶段。
(3)分析流程中的每一步骤,从以下几个方面了解流程:
①反应物是什么;
②发生了什么反应;
③该反应造成了什么后果,对制造产品有什么作用。
抓住一个关键点:
一切反应或操作都是为获得产品而服务。
35、【化学一一物质结构与性质】
(15分)
X、Y、Z、W、A五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57。
X为周期表中原子半径最小的元素,Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W单质可作半导体,A原子的最外层电子数是最内层电子数的一半,其d轨道处于全充满状态。
(1)A2+的外围电子排布式为___________________________。
(2)Y、Z、W的电负性的大小
比较为_______________________________(用元素符号表示)Y与Z原子的半径大小比较为________________(用元素符号表示)。
(3)X、Y、Z可以形成化学式为XYZ的分子,该分子中各原子均达到稀有气体稳定结构,则该分子中Y采取的杂化轨道类型为_____;
X于Z形成的最简单化合物Q的水溶液呈碱性,写出A2+与Q形成的配离子的离子反应方程式______________________________。
(4)Y与W的化合物是一种常用的耐磨材枓,而磷化硼(BP)也是一种有价值的耐磨硬涂层材料,这种陶瓷材料可作为金属表面的保护薄膜。
它是通过在高温氢气氛围下(>
750℃)三溴化硼和三溴化磷反应制得。
BP晶胞如图所示。
①画出三溴化硼的空间结构式。
三溴化硼________________________。
②在BP晶胞中B的堆积方式为____________________。
③计算当晶胞的参数为478pm(即图中立方体的毎条边长为478pm)时磷化硼中硼原子和磷原子之间的最近距离___________________。
(1)3d9(2分);
(2)N>
C>
Si(2分);
C>
N(2分)
(3)sp杂化(2分);
Cu2++4NH3=Cu(NH3)42+(2分)
(4)①
(1分)(要体现平面三角形)②面心立方堆积(2分)③207pm或239
/2(2分)
(1)A2+为Cu2+,Cu原子失去4s能级1个、3d能级1个电子形成Cu2+,Cu2+的外围电子排布式为3d9;
(2)非金属性越强,电负性越大,则Y、Z、W的电负性的大小比较为N>
Si;
同周期自左向右原子半径逐渐减小,则Y与Z原子的半径大小比较为C>
N。
(3)H、C、N可以形成化学式为HCN的分子,该分子中各原子均达到稀有气体稳定结构,则该分子结构式为H-C≡N,则该分子中C原子价层电子对个数是2且不含孤电子对,C原子采取的杂化方式为sp;
X于Z形成的最简单化合物Q的水溶液呈碱性,则Q是氨气,Cu2+与氨气形成的配离子的离子反应方程式Cu2++4NH3=Cu(NH3)42+;
(4)①BBr3中硼原子的价层电子对数为3+(3−1×
3)/2=3,没有孤电子对,所以分子空间构型为平面三角形,结构式为
②由晶胞结构可知,B原子处于晶胞顶点与面心,在BP晶胞中B的堆积方式为面心立方密堆积;
③P原子与周围的4个B原子最近且形成正四面体结构,二者连线处于体对角线上,为体对角线的1/4,立方体的每条边长为478pm,则晶胞体对角线长为
,因此P原子与B原子最近距离为
。
【考点定位】本题是对物质结构与性质的考查
【名师点晴】该题是高频考点,考查的知识点较多,涉及核外电子排布、杂化方式判断、配合物、晶胞结构与计算等,综合性强,难度较大。
(4)中晶胞中原子距离计算为易错点、难点,需要学生具备一定的空间想象与数学计算能力。
36、【化学-选修有机化学基础】
(15分)中国本土科学家屠呦呦凭借发现抗疟特效药青蒿素,赢得了2015年度诺贝尔生理学奖。
青蒿素的发明不仅治愈了众多疟疾患者,更为中医药走出国门开创了先河。
青蒿素的一种化学合成部分工艺流程如下:
由青蒿素还可以合成药效增强的系列衍生物
(1)青蒿素分子中含有的含氧官能团有:
______、______和过氧基。
双氢青蒿素分子结构中有若干个六元环和七元环组成,其中含有七元环数为___________。
蒿甲醚的化学式为___________。
(2)反应B→C,实际上可看作两步进行,依次发生的反应类型是______、消去反应。
(3)合成路线中设计E→F、G→H的目的是_________________________。
(4)A在Sn-β沸石作用下,可异构为异蒲勒醇
,则异蒲勒醇分子有__________个手性碳原子(连有四种不同原子或原子团的碳原子称为手性碳原子)。
异蒲勒醇可通过两步反应生成
,请写出相关化学反应方程式______________________________________________,_____________________________。
(5)写出与A互为同分异构体,且满足以下条件的同分异构体数
目为________种(不考虑空间异构)。
其中核磁共振氢谱有七个峰,且峰面积比为1∶1∶4∶4∶1∶1∶6的是:
_________。
(填结构简式)
①分子中只含有一个六元环,
②六元环上只有二个取代基且在不同的碳原子上
③能够发生银镜反应
【答案】⑴酯基、醚键;
2;
Cl6H26O5;
(每空1分);
(2分)加成反应(1分)⑶保护羰基;
(1分)
⑷3(1分)
(2分)