高考化学同步课件+讲义+习题 2Word文档格式.docx
《高考化学同步课件+讲义+习题 2Word文档格式.docx》由会员分享,可在线阅读,更多相关《高考化学同步课件+讲义+习题 2Word文档格式.docx(19页珍藏版)》请在冰豆网上搜索。
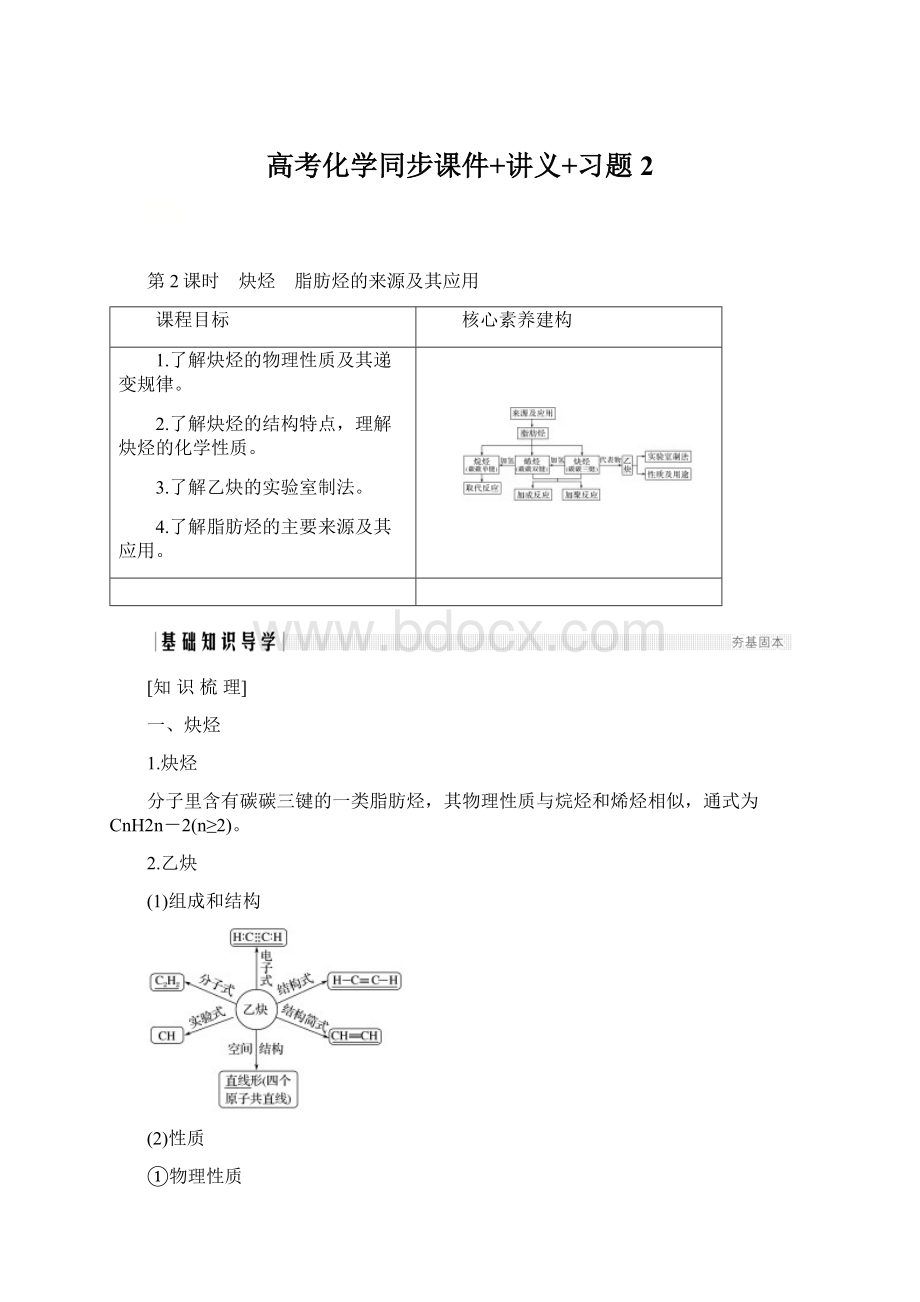
常压分馏
石油气、汽油、煤油、柴油等
减压分馏
润滑油、石蜡等
催化裂化、裂解
轻质油、气态烯烃
催化重整
芳香烃
天然气
—
甲烷
煤
煤焦油分馏
直接或间接液化
燃料油、化工原料
[自我检测]
1.判断正误,正确的打“√”,错误的打“×
”。
(1)由乙炔的结构可推测所有炔烃均为直线型结构。
(×
)
(2)实验室制乙炔时可用排空气法收集乙炔。
(3)石油分馏可得大量烯烃。
(4)实验室制乙炔时,用饱和食盐水代替水,是为了减缓电石与水的反应速率。
(√)
2.按要求回答下列问题。
(1)炔烃的通式是CnH2n-2,符合该通式的都属于炔烃吗?
答案 不一定。
也有可能是二烯烃,如
CH2===CH—CH===CH2或环烯烃,如
(环己烯)。
(2)由乙炔如何制取聚氯乙烯?
(3)石油分馏和煤的干馏都属于物理变化,这种说法对吗?
答案 不对。
石油分馏是物理变化,煤的干馏是化学变化。
(4)怎样鉴别直馏汽油和裂化汽油?
答案 鉴别直馏汽油和裂化汽油的方法是分别滴加溴的四氯化碳溶液,褪色的是裂化汽油,不褪色的是直馏汽油。
3.纯净的乙炔是________颜色、________气味的气体;
实验室制取乙炔的化学方程式是___________________________________________,收集乙炔常采用________法;
乙炔在纯氧中燃烧的化学方程式为________________________,
产生的氧炔焰温度可达________,因此可用于___________________________;
乙炔与溴水完全加成的化学方程式_____________________________________。
答案 没有 没有 CaC2+2H2O―→Ca(OH)2+C2H2↑ 排水 2C2H2+5O2
4CO2+2H2O 3000℃以上 焊接或切割金属
提升一、乙炔的实验室制法及性质检验
【名师点拨】
1.乙炔的实验室制法及性质验证
(1)实验装置
(2)反应原理:
装置①:
CaC2+2H2O―→Ca(OH)2+C2H2↑。
(3)性质验证
装置②:
CuSO4+H2S===CuS↓+H2SO4,除去杂质。
装置③:
酸性KMnO4溶液褪色。
装置④:
溴的四氯化碳溶液褪色,反应为:
CH≡CH+2Br2―→CHBr2CHBr2
装置⑤:
有明亮的火焰并有浓烟产生。
2.制取乙炔的注意事项
(1)实验装置在使用前,要先检查气密性。
(2)盛电石的试剂瓶要及时密封并放于干燥处,严防电石吸水而失效。
取电石要用镊子夹取,切忌用手拿。
(3)制取乙炔时,由于CaC2和水反应剧烈,并产生泡沫,为防止产生的泡沫进入导管,应在导气管口附近塞入少量棉花。
(4)电石与水反应很剧烈。
为得到平稳的乙炔气流,可用饱和食盐水代替水,并用分液漏斗控制水流的速度,让水逐滴慢慢地滴入。
(5)制取乙炔不能用启普发生器或具有启普发生器原理的实验装置,原因是:
①碳化钙吸水性强,与水反应剧烈,不能随用、随停。
②反应过程中放出大量的热,易使启普发生器炸裂。
③生成的Ca(OH)2呈糊状易堵塞球形漏斗。
(6)由电石制得的乙炔中往往含有H2S、PH3等杂质,使混合气体通过盛有NaOH溶液或CuSO4溶液的洗气瓶可将杂质除去。
【例1】如图中的实验装置可用于制取乙炔。
请回答下列问题:
(1)图中,A管的作用是______________________________________________,
制取乙炔的化学方程式是____________________________________________,
为避免反应太迅速,可采取的措施为_________________________。
(2)乙炔通入KMnO4酸性溶液中,观察到的现象是________________________
__________________________________________,乙炔发生了________反应。
(3)乙炔通入溴的CCl4溶液中,可观察到的现象是________________________
___________________________________________,乙炔发生了__________反应。
(4)为了安全,点燃乙炔前应______________________________,乙炔燃烧时的实验现象是____________________________________________。
(5)若把乙炔与HCl加成,1mol乙炔最多可与______molHCl加成,1mol其加成产物能和________molCl2发生取代反应。
解析
(1)由图可以看出A管通过橡胶软管与右侧相连,A管的高低可调节右管中的水是否与电石接触,从而控制反应能否发生。
若反应太快,可把水换成饱和食盐水。
(2)乙炔易被高锰酸钾酸性溶液氧化而使高锰酸钾酸性溶液褪色。
(3)乙炔还可与溴发生加成反应生成无色的溴代烃,使溴的CCl4溶液褪色。
(4)可燃性气体在点燃前都应检验纯度,这是常识。
由于乙炔的含碳量较高,所以燃烧时火焰明亮并伴有浓烈的黑烟。
(5)C2H2
C2H4Cl2
C2Cl6+4HCl。
答案
(1)调节水面高度以控制反应的发生和停止
CaC2+2H2O→Ca(OH)2+C2H2↑ 把水换成饱和食盐水
(2)KMnO4酸性溶液褪色 氧化
(3)溴的CCl4溶液褪色 加成
(4)检验乙炔的纯度 火焰明亮并伴有浓烈的黑烟
(5)2 4
【深度思考】
1.实验室制备乙炔的反应有什么特点?
提示 固+液→气,反应不需要加热。
2.制取乙炔的发生装置还可以用来制取哪些气体?
提示 H2、CO2、O2(H2O2分解)等。
3.如何收集乙炔气体?
提示 利用排水法收集。
【变式训练】
1.以下是几种常见的制气装置,其中可用于制取乙炔的是( )
解析 A装置适合于“液+液(固)
气”;
B适合于“固+固
C适合于“固(液)+液―→(不加热)气”;
D适合于“块状固体且难溶+液―→(不加热)气”。
由于CaC2遇水易变成粉末,不能始终保持块状,不适于用D装置。
答案 C
2.下列说法错误的是( )
A.石油中含有C5~C11的烷烃,通过石油的分馏得到汽油
B.含C20以上的重油经催化裂化可以得到汽油
C.开采天然气(主要成分是甲烷)应做到安全规范的操作
D.煤中含有苯和甲苯,可用分馏的方法把它们分离出来
解析 石油中含有C5~C11的烷烃,可以通过石油的常压分馏得到汽油、煤油、柴油等;
含C20以上的重油经催化裂化可以得到汽油、煤油、柴油等;
天然气的主要成分是甲烷,开采天然气必须安全规范地操作,否则易造成井喷事件;
煤焦油中含苯和甲苯,可以通过分馏的方法将它们分离出来,但煤是多种无机物和有机物的混合物,并不含苯和甲苯等芳香烃。
答案 D
3.下列说法错误的是( )
分馏产品
乙烯
CH2BrCH2Br
A.石油主要是由烃组成的混合物
B.①主要发生物理变化
C.②包括裂化、裂解等过程
D.③是加成反应,产物名称是二溴乙烷
解析 石油的主要成分是各种烷烃、环烷环、芳香烃的混合物,即石油主要是由烃组成的混合物,故A正确;
分馏是利用沸点不同进行分离的,所以分馏属于物理变化,故B正确;
裂化、裂解等过程是把大分子的烃转化为小分子烃,过程中有乙烯生成,所以②包括裂化、裂解等过程,故C正确;
乙烯与溴加成生成CH2BrCH2Br,所以③是加成反应,CH2BrCH2Br的名称为1,2-二溴乙烷,故D错误。
提升二、烃燃烧的规律及应用
(1)等物质的量的烃CxHy完全燃烧时,消耗氧气的量决定于“x+
”的值,值越大,耗氧量越多。
(2)等质量的烃完全燃烧时,消耗氧气的量决定于CxHy中“
(3)若烃分子的组成中碳、氢原子个数比为1∶2,则完全燃烧后生成的二氧化碳和水的物质的量相等。
(4)等质量的且最简式相同的各种烃完全燃烧时其耗氧量、生成的二氧化碳和水的量均相等。
(5)气态烃CxHy完全燃烧后生成CO2和H2O。
CxHy+
O2
xCO2+
H2O
当H2O为气态时(>100℃),1mol气态烃完全燃烧前后气体总体积的变化有以下三种情况:
①当y=4时,ΔV=0,反应后气体总体积不变,常温常压下呈气态的烃中,只有甲烷、乙烯、丙炔;
②当y>4时,ΔV=
-1>
0,反应后气体总体积增大;
③当y<4时,ΔV=
-1<
0,反应后气体总体积减小。
【例2】25℃某气态烃与O2混合,在密闭容器中点燃爆炸后又恢复至25℃,此时容器内压强为原来的一半,再经NaOH溶液处理,容器内几乎成为真空。
该烃的分子式可能为( )
A.C2H2B.C2H6
C.C3H6D.C3H8
解析 设该烃的分子式为CxHy,则
由题意可知,烃和O2的物质的量之和应为CO2物质的量的2倍,即1+
=2x,解得x=1+
。
讨论:
当y=4时,x=2;
当y=6时,x=2.5,不合题意;
当y=8时,x=3。
1.为什么等质量的烃,含氢量越高耗氧量越大?
提示 因为12g(1mol)碳原子消耗1molO2,4g(4mol)氢原子消耗1molO2,故等质量的烃含氢量越高,耗氧量越大。
2.充分燃烧某液态烃CxHy,并收集产生的全部水,恢复到室温时得到水的质量跟原液态烃的质量相等。
求x与y的关系。
提示 由燃烧通式CxHy+(x+
)O2
H2O及“得到水的质量跟原液态烃的质量相等”,可知该液态烃中碳的质量与生成物水中氧的质量相等,即12x=
×
16,可得y=1.5x。
4.等质量的下列烃完全燃烧时,所需O2的量最多的是( )
A.C6H6B.C2H6
C.C2H4D.C4H6
解析 在等质量前提下,烃中H百分含量越高耗氧量越多,而一个碳原子平均结合的氢原子个数为
A.C6H6:
=1;
B.C2H6:
=3;
C.C2H4:
=2;
D.C4H6:
=1.5。
答案 B
5.区别CH4、CH2===CH2、CH≡CH的最简易方法是( )
A.分别通入溴水
B.分别通入酸性高锰酸钾溶液
C.分别在空气中点燃
D.分别通入盛有碱石灰的干燥管
解析 本题考查CH4、CH2===CH2、CH≡CH三者的鉴别方法。
CH2===CH2和CH≡CH都能使溴水和酸性高锰酸钾溶液褪色,三种气体通过盛有碱石灰的干燥管均无现象。
最简易的方法是点燃,因为燃烧时火焰的明亮程度和有无浓烟这两个方面的现象是非常明显的。
6.某气态烃0.5mol能与1molHCl完全加成,加成后的产物分子上的氢原子又可被3molCl2完全取代。
则此气态烃可能是( )
A.HC≡CHB.CH2===CH2
C.HC≡C—CH3D.CH2===C(CH3)CH3
7.400K、101kPa时,1.5L某烃蒸气能在aLO2中完全燃烧,体积增大至(a+3)L(相同状况)。
(1)该烃分子组成上必须满足的条件是________。
(2)当a=10时,烃可能的分子式为________。
(3)该烃为C7H8时,a的取值范围是________。
解析
(1)设该烃分子式为CxHy,则其燃烧的化学方程式为:
得
-1=1 即y=8
所以该烃分子中氢原子数为8。
(2)当a=10时,1.5L该烃蒸气完全燃烧需满足
1.5L×
(x+
)≤10L,即x≤4.7,该烃可能的分子式为C3H8和C4H8。
(3)若该烃为C7H8,则1.5L烃的蒸气完全燃烧消耗O2的体积为1.5L×
(7+
)=13.5L,故a的取值范围为a≥13.5。
答案
(1)分子中氢原子数为8
(2)C3H8,C4H8 (3)a≥13.5
课时作业
基础题组
1.乙烷、乙烯、乙炔共同具有的性质是( )
A.都难溶于水,且密度比水小
B.能够使溴水和酸性KMnO4溶液褪色
C.分子中各原子都处在同一平面内
D.都能发生聚合反应生成高分子化合物
解析 乙烷分子中各原子不能处于同一平面上;
乙烷不能发生聚合反应;
乙烷不能使溴水和酸性KMnO4溶液褪色。
答案 A
2.用乙炔为原料制取CH2Br—CHBrCl,可行的反应途径是( )
A.先加Cl2,再加Br2B.先加Cl2,再加HBr
C.先加HCl,再加HBrD.先加HCl,再加Br2
解析 CH2Br—CHBrCl与乙炔相比,多了1个HCl和1个Br2,所以选D项。
3.下列关于乙炔制取的说法不正确的是( )
A.为了减缓反应速率可用饱和食盐水代替水反应
B.此反应是放热反应
C.为了除去杂质气体,除了用硫化铜外还需用氢氧化钠溶液
D.反应中不需加碎瓷片作沸石
解析 为了除去杂质气体,要用硫酸铜和氢氧化钠溶液,C项不正确。
4.下列关于乙炔性质的叙述中,既不同于乙烯又不同于乙烷的是( )
A.能燃烧生成二氧化碳和水
B.能与溴水发生加成反应
C.能与酸性高锰酸钾溶液发生氧化反应
D.能与氯化氢反应生成氯乙烯
解析 乙烯、乙烷、乙炔都能燃烧生成二氧化碳和水,乙烯和乙炔都能与溴水发生加成反应,都能与酸性高锰酸钾溶液发生氧化反应,使酸性高锰酸钾溶液褪色,故A、B、C都不是乙炔独特的性质。
与HCl反应生成氯乙烯是乙炔的性质,而不是乙烯和乙烷的性质。
5.某烃甲与氢气反应后的产物乙为(CH3)2CHCH2CH3,则相关说法不合理的是( )
A.产物乙的系统命名为2-甲基丁烷
B.烃甲可能是2-甲基-1,3丁二烯
C.0.1mol产物乙完全燃烧可消耗17.92LO2
D.烃甲与乙炔可能是同系物
解析 烃甲可能为烯烃、二烯烃、炔烃,如2-甲基-1-丁烯、2-甲基-1,3-丁二烯、3-甲基-1-丁炔,B、D正确;
0.1mol产物乙完全燃烧可消耗0.8molO2,标准状况下为17.92L,C选项未说明状态,C错误。
6.下列各选项能说明分子式为C4H6的某烃是CH≡C—CH2—CH3,而不是CH2===CH—CH===CH2的事实是( )
A.燃烧有浓烟
B.能使KMnO4酸性溶液褪色
C.能与溴发生1∶2加成反应
D.与足量溴水反应,生成物中只有2个碳原子上有溴原子
解析 无论是HC≡C—CH2—CH3,还是CH2===CH—CH===CH2,A、B、C项均能发生,而与足量溴加成后前者产物为
,后者产物为
7.某炔烃含有一个三键,与H2发生加成后的产物为
该炔烃可能具有的结构有( )
A.1种B.2种
C.3种D.4种
解析 加成产物的结构中可以放入三键的位置为乙基的碳碳之间,但右侧的两个乙基是等价的。
8.下列关于煤、石油、天然气等资源的说法中正确的是( )
A.石油裂解得到的汽油是纯净物
B.石油产品都可用于聚合反应
C.天然气是一种清洁的化工原料
D.水煤气是通过煤的液化得到的气体燃料
解析 石油裂解产物有烯烃和烷烃,属于混合物,烷烃不能发生聚合反应,A、B项错误;
甲烷是含碳量最少的烃,易充分燃烧,且燃烧产物不污染空气,C项正确;
水煤气是碳与水高温下反应得到的CO、H2的混合气,D项错误。
9.用石油和煤可以得到有机化工生产中需要的众多原料,例如由石油得到的乙烯和由煤得到的苯制聚苯乙烯,生产过程如下:
下列说法不正确的是( )
A.通过裂解可以从石油中获得更多的乙烯
B.煤干馏不能直接得到苯
C.制聚苯乙烯的反应①为加成反应
D.反应①②③的原子利用率都达到了100%
解析 石油裂解是为了得到更多的有机化工原料,如乙烯等;
煤干馏只能得到苯和苯的同系物等的混合物,还要进行分馏才能得到苯;
根据反应特点可知①为加成反应;
反应①③的原子利用率都达到了100%,而反应②中除生成目标产物外,还生成了其他产物,原子利用率小于100%。
10.下列物质中不能用于萃取溴水中溴的是( )
A.直馏汽油B.裂化汽油
C.己烷D.苯
解析 裂化过程中,相对分子质量较大、沸点较高的烃在断裂成相对分子质量较小、沸点较低的烃的过程中产生了不饱和烃,所以裂化汽油能与溴发生加成反应,不能萃取溴水中的溴,而直馏汽油不能和溴发生加成反应,能萃取溴水中的溴。
11.下列关于分子组成为CxHy的烷烃、烯烃、炔烃的说法中不正确的是( )
A.当x≤4时,常温常压下均为气体
B.y一定为偶数
C.燃烧1molCxHy时,消耗氧气(x+
)mol
D.在密闭容器中完全燃烧,150℃时测得的压强一定比燃烧前增加
解析 根据CxHy的燃烧通式可知:
CxHy+(x+
H2O(150℃时,水为气态),反应前后物质的量(压强)变化为(x+
)-(1+x+
)=
-1。
当y=4时,反应前后压强不变,如CH4、C2H4;
当y>
4时,反应后压强增大,如C2H6;
当y<
4时,反应后压强减小,如C2H2。
12.一种形状像布袋结构的烯烃分子Bowtiediene,其形状和结构如图所示。
有关该分子的说法不正确的是( )
A.该烯烃的分子式为C5H4
B.该分子所有碳原子在同一平面
C.1mol该有机物最多可与2molBr2发生加成反应
D.与其互为同分异构体且只含三键的链烃不止一种
解析 由图可知该烃的分子式为C5H4,中心碳原子连有4个键,空间构型类似于甲烷,是四面体结构,所有碳原子不可能共平面;
由于有2个双键的存在,1mol该烃最多可与2molBr2发生加成反应;
与其互为同分异构体且只含三键的烃分子有CH≡C—C≡C—CH3以及CH≡C—CH2—C≡CH两种。
13.已知:
,如果要合成
,所用的起始原料可以是( )
①2-甲基-1,3-丁二烯和2-丁炔
②1,3-戊二烯和2-丁炔
③2,3-二甲基-1,3-戊二烯和乙炔
④2,3-二甲基-1,3-丁二烯和丙炔
A.①④B.②③C.①③D.②④
解析 由信息:
断键后可得到
和
,
,若按①断键可得到CH3C≡CH(丙炔)和
(2,3-二甲基-1,3-丁二烯),若按②断键可得到
(2-甲基-1,3-丁二烯)和CH3—C≡C—CH3(2-丁炔)。
14.已知烯烃、炔烃在臭氧作用下发生以下反应:
CH3—CH===CH—CH2—CH===CH2
CH3—CHO+OHC—CH2—CHO+HCHO
CH3—C≡C—CH2—C≡CH
CH3COOH+
HOOC—CH2—COOH+HCOOH
某烃的分子式为C10H10,在同样条件下发生反应:
C10H10
CH3COOH+3HOOC—CHO+CH3CHO
试回答下列问题:
(1)1个C10H10分子中含有____个双键,____个三键。
(2)C10H10的结构简式为________________________________。
解析
(1)由已知,在臭氧作用下,1个双键生成2个—CHO,1个三键生成2个—COOH。
题给反应的产物中共4个—CHO和4个—COOH,推知1个C10H10分子中含有2个双键、2个三键。
答案
(1)2 2
(2)CH3—C≡C—CH===CH—C≡C—CH===CH—CH3
能力题组
15.煤和石油等化石燃料对促进社会经济发展起到了重要的作用,这些燃料合理的综合利用是当前节能减排的要求。
(1)石油分馏是石油炼制的重要环节,这种操作是在________(填设备名称)内完成的。
工业上通常使用的分馏石油的方法有常压分馏和________,分馏的目的是
___________________________________________。
(2)石油不仅是重要的燃料,还是重要的化工原料的来源,如利用石油生产乙烯。
为了使石油分馏产物进一步生成更多的乙烯、丙烯等短链烃而采取________措施。
(3)目前石油资源逐渐匮乏,人们把目光聚集到储量相对丰富的煤上。
目前煤综合利用的主要方法是___________、________和煤的气化,煤气化涉及的化学方程式:
______________________________。
解析
(1)石油分馏是在分馏塔中完成的,分馏的种类有常压分馏和减压分馏,这种分馏是物理变化。
(2)为了获得化工原料乙烯,往往对石油进行裂解,需要较高的温度(700~1000℃),这种反应属于化学反应。
(3)煤的干馏是化学变化,这是煤的综合利用;
而煤的气化、液化也是近年来煤综合利用的重要方法。
答案
(1)分馏塔 减压分馏 为了获得沸点不同的各种成分
(2)高温裂解 (3)煤的干馏 煤的液化
C+H2O(g)
CO+H2
16.用电石制备的乙炔气体中常混有少量H2S气体。
请用图中仪器和药品组成一套制备并净化乙炔,检验其性质,并可通过测定乙炔的量。
从而计算电石纯度的装置。
(1)进行实验时,所制气体从左向右进行,仪器的正确连接顺是________________(填接口字母);
(2)为了使实验中气流平稳,甲中分液漏斗里的液体X通常用____________________________________________。
(3)若在标准状况下溴水与乙炔完全反应生成C2H2Br4,已知称取电石mg,测得量筒内液体体积VmL,则电石纯度可表示为________;
(4)若没有除H2S的装置,测定结果将会________(填“偏高”“偏低”或“不变”),理由是______________________________________。
(用化学方程式表示)
解析
(1)连接顺序:
制备→净化(长进短出)→性质检验(长进短出)→收集(短进长出);
(2)为了使实验中气流平稳,可采取降低水的浓度的方法,如用食盐水代替水;
(3)电石与足量水反应生成乙炔,其中混有的H2S可用NaOH溶液吸收,乙炔气体被溴水吸收后余下的部分通过排水法测量其体积。
电石纯度计算过程:
解得x=(