专题工艺流程题(2015-2017).doc
《专题工艺流程题(2015-2017).doc》由会员分享,可在线阅读,更多相关《专题工艺流程题(2015-2017).doc(19页珍藏版)》请在冰豆网上搜索。
高三化学工艺流程专题
1.【2017新课标1卷】(14分)
Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
回答下列问题:
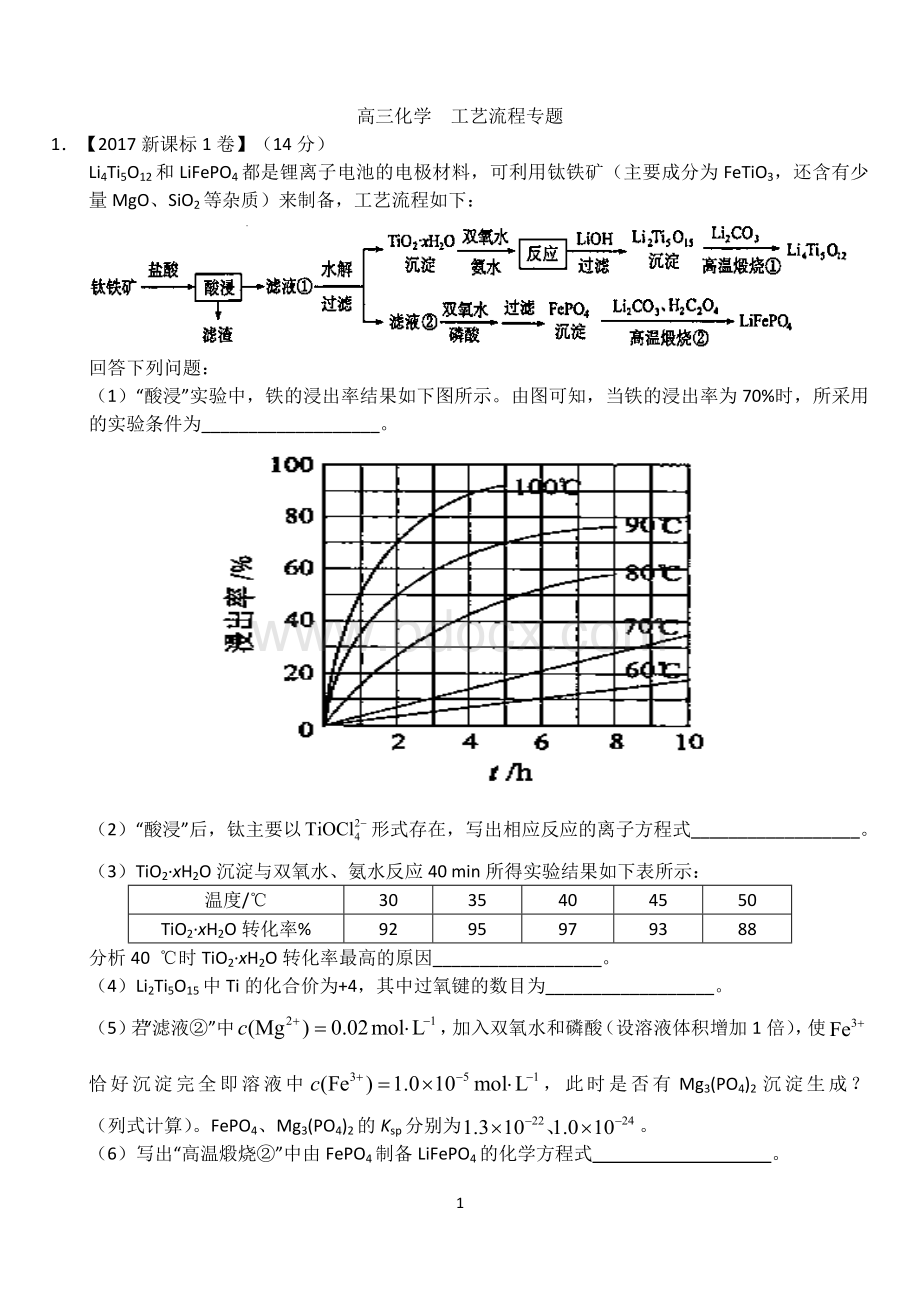
(1)“酸浸”实验中,铁的浸出率结果如下图所示。
由图可知,当铁的浸出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/℃
30
35
40
45
50
TiO2·xH2O转化率%
92
95
97
93
88
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中,加入双氧水和磷酸(设溶液体积增加1倍),使恰好沉淀完全即溶液中,此时是否有Mg3(PO4)2沉淀生成?
(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式。
2.【2017新课标3卷】(15分)
重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。
制备流程如图所示:
回答下列问题:
(1)步骤①的主要反应为:
FeO·Cr2O3+Na2CO3+NaNO3Na2CrO4+Fe2O3+CO2+NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为_______。
该步骤不能使用陶瓷容器,原因是_____。
(2)滤渣1中含量最多的金属元素是_______,滤渣2的主要成分是__________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是_____________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。
向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。
冷却到___________(填标号)得到的K2Cr2O7固体产品最多。
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1kg铬铁矿粉(含Cr2O340%)制备K2Cr2O7,最终得到产品m2kg,产率为_____________。
3.【2017北京卷】(13分)TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:
资料:
TiCl4及所含杂质氯化物的性质
化合物
SiCl4
TiCl4
AlCl3
FeCl3
MgCl2
沸点/℃
58
136
181(升华)
316
1412
熔点/℃
−69
−25
193
304
714
在TiCl4中的溶解性
互溶
——
微溶
难溶
(1)氯化过程:
TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:
TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)ΔH1=+175.4kJ·mol-1
2C(s)+O2(g)=2CO(g)ΔH2=-220.9kJ·mol-1
①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:
_______________________。
②氯化过程中CO和CO2可以相互转化,根据如图判断:
CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:
_______________。
③氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________。
④氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________。
(2)精制过程:
粗TiCl4经两步蒸馏得纯TiCl4。
示意图如下:
物质a是______________,T2应控制在_________。
4.【2017江苏卷】(12分)铝是应用广泛的金属。
以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
注:
SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________(填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。
阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
(5)铝粉在1000℃时可与N2反应制备AlN。
在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
5.【2017江苏卷】(15分)某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含量过低,对实验的影响可忽略)。
已知:
①NaClO溶液在受热或酸性条件下易分解,如:
3NaClO2NaCl+NaClO3
②AgCl可溶于氨水:
AgCl+2NH3·H2OAg(NH3)2++Cl−+2H2O
③常温时N2H4·H2O(水合肼)在碱性条件下能还原Ag(NH3)2+:
4Ag(NH3)2++N2H4·H2O4Ag↓+N2↑+4NH4++4NH3↑+H2O
(1)“氧化”阶段需在80℃条件下进行,适宜的加热方式为__________________。
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为________________。
HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是____________________。
(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并_______________________。
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3·H2O反应外(该条件下NaClO3与NH3·H2O不反应),还因为_____________________。
(5)请设计从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案:
________________________(实验中须使用的试剂有:
2mol·L−1水合肼溶液,1mol·L−1H2SO4)。
6.【2016新课标1卷】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
回答下列问题:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式_______。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。
“电解”中阴极反应的主要产物是______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。
此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是_________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:
每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。
NaClO2的有效氯含量为____。
(计算结果保留两位小数)
7.【2016新课标3卷】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。
从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。
废钒催化剂的主要成分为:
物质
V2O5
V2O4
K2SO4
SiO2
Fe2O3
Al2O3
质量分数/%
2.2~2.9
2.8~3.1
22~28
60~65
1~2
<1
以下是一种废钒催化剂回收工艺路线:
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。
“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124−形式存在于溶液中。
“废渣2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:
4ROH+V4O124−R4V4O12+4OH−(ROH为强碱性阴离子交换树脂)。
为了提高洗脱效率,淋洗液应该呈_____性(填“酸”、“碱”或“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
8.【2016北京卷】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。
其工作流程如下:
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:
2Fe2++PbO2+4H++SO42−=2Fe3++PbSO4+2H2O
ii:
……
①写出ii的离子方程式:
________________。
②下列实验方案可证实上述催化过程。
将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.______________。
(3)PbO溶解在NaOH溶液中,存在平衡:
PbO(s)+NaOH(aq)NaHPbO2(aq),其溶解度曲线如图所示。
①过程Ⅱ的目的是脱硫。
滤液1经处理后可在过程Ⅱ中重复使用,其目的是____(选填序号)。
A.减少PbO的损失,提高产品的产率
B.重复利用氢氧化钠,提高原料的利用率
C.增加Na2SO4浓度,提高脱硫效率
②过滤Ⅲ的目的是提纯,综合上述溶解度曲线,简述过程Ⅲ的操作___________。
9.【2016海南卷】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。
实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。
回答下列问题:
(1)为尽量少引入杂质,试剂①应选用___(填标号)。
a.HCl溶液b.H2SO4溶液c.氨水d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为________。
(3)沉淀B的化学式为___;将少量明矾溶于水,溶液呈弱酸性,其原因是_____。
(4)已知:
Kw=1.0×10-14,Al(OH)3AlO2-+H++H2OK=2.0×