中考化学化学溶解度综合练习题及详细答案Word文件下载.docx
《中考化学化学溶解度综合练习题及详细答案Word文件下载.docx》由会员分享,可在线阅读,更多相关《中考化学化学溶解度综合练习题及详细答案Word文件下载.docx(23页珍藏版)》请在冰豆网上搜索。
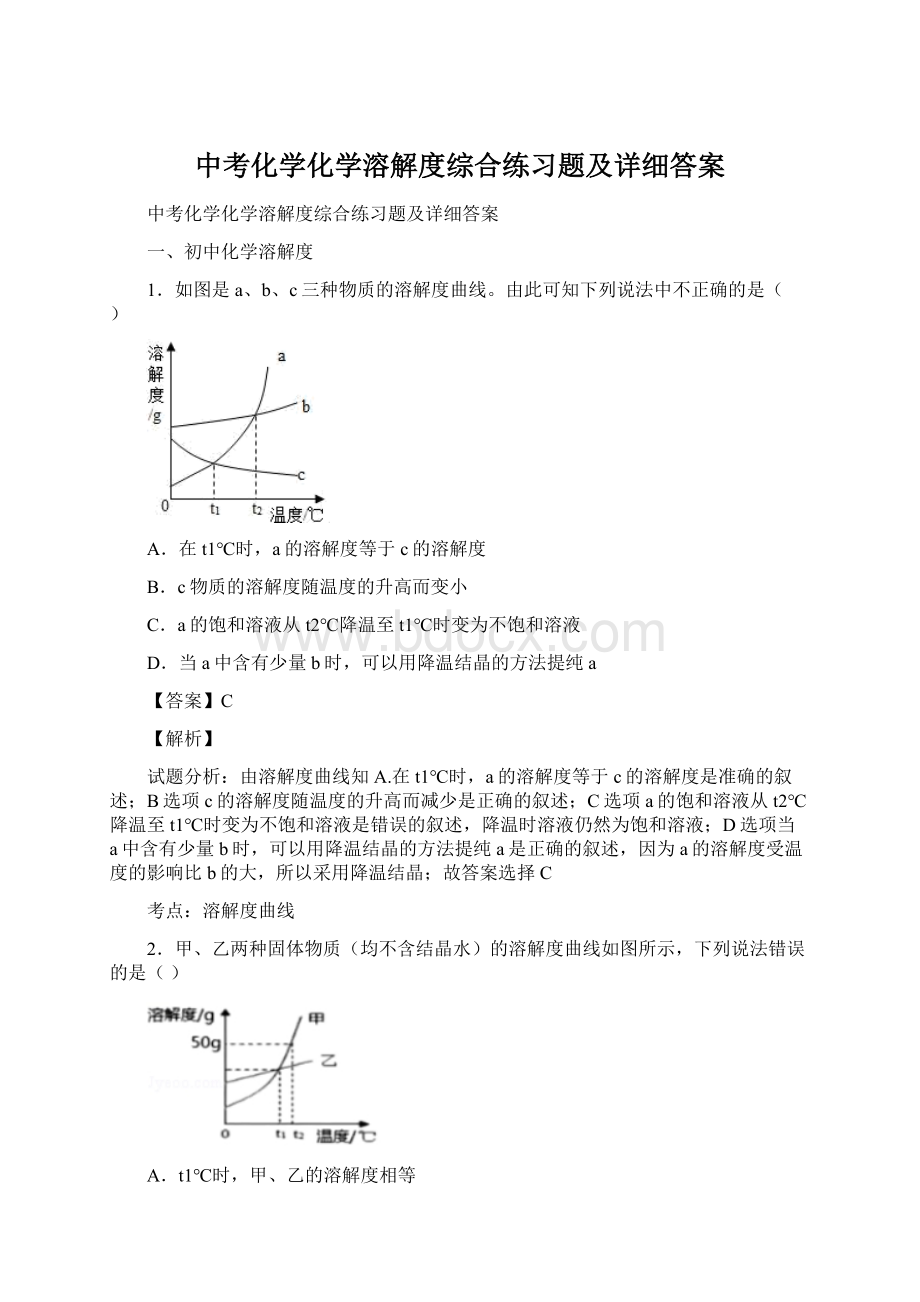
A.A
B.B
C.C
D.AB
由题中所给的坐标曲线可知,A、B两物质的溶解度随温度升高而升高,C物质随温度的升高而降低,所以当等质量的A、B、C三种物质的饱和溶液同时从t=2℃降温到t=1℃时,C物质的溶解度增大,没有物质析出,所以溶质质量分数不变,A、B均有溶质析出,所以溶质质量分数减小。
溶解度曲线的意义
点评:
关于溶解度曲线的题目属于中考必考的题型,通常在选择题较为靠后的位置出现,有一定的难度,考生应熟知基础知识点,仔细审题,理解其曲线的含义。
4.在一定温度下,将少量生石灰放入一定的饱和石灰水中,搅拌并冷却、到原来的温度,下列说法中正确的是( )
A.溶剂质量不变B.溶质质量增加
C.溶液浓度不变D.溶解度增加
由于生石灰会与水反应生成氢氧化钙,同时还会放出大量的热,A、溶剂质量应变小,而不是不变,错误,B、由于饱和溶液水分减少,故溶质会结晶析出,故溶质质量也减少,而不是增加,错误,C、因为最后冷却到原来的温度,成为同温下的饱和溶液,故溶液浓度不变,正确,D、温度没变,溶解度也不变,错误,故选C
溶液的成分,氧化钙的化学性质,溶解度的影响因素,溶质质量分数的计算
5.下列有关溶解度的说法错误的是( )
A.20℃时,甲和乙的溶解度相等
B.40℃时,若将40g乙放入160g水中充分溶解,所得溶液的溶质质量分数为20%
C.40℃时,将甲、乙两物质的饱和溶液各100g,降温至20℃,析出晶体(均不含结晶水)的质量关系是:
m(甲)=m(乙)
D.20℃时,将甲物质的饱和溶液升温到40℃,溶液变为不饱和溶液
A、通过分析溶解度曲线可知,20℃时,甲和乙的溶解度相等,故A正确,不符合题意;
B、40℃时,乙物质的溶解度是40g,所以若将40g乙放入160g水中充分溶解将完全溶解,故所得溶液的溶质质量分数为
100%=20%,故B正确,不符合题意;
C、40℃时,甲物质的溶解度大于乙物质的溶解度,将甲、乙两物质的饱和溶液各100g,降温至20℃,甲、乙物质的溶解度相等,所以析出晶体(均不含结晶水)的质量关系是:
m(甲)>m(乙),故C错误,符合题意;
D、20℃时,将甲物质的饱和溶液升温到40℃,溶解度增大,所以溶液变为不饱和溶液,故D正确,不符合题意。
故选C。
6.甲、乙两种物质的溶解度曲线如图所示。
下列说法正确的是()
A.甲的溶解度大于乙的溶解度
B.两种物质的溶解度都随温度升高而增大
C.t1℃时,甲、乙两种物质的溶液中,溶质质量分数相等
D.t2℃时,甲饱和溶液溶质质量分数为50%
【分析】
从图示看:
当温度大于t1℃时,甲的溶解度大于乙的溶解度;
两种物质的溶解度都随温度升高而增大;
t1℃时,甲.乙两种物质的饱和溶液中,溶质的质量分数相等;
t2℃时,甲的饱和溶液溶质质量分数为50克/150克×
100%=33.3%。
溶解度溶质的质量分数溶解度曲线
7.如图是M、N两种物质的溶解度曲线,由溶解度曲线得出以下几条信息,你认为正确的是( )
A.
时,M、N两物质溶液溶质质量分数相等
B.由
升温到
时,N物质溶液溶质质量分数不变
C.M物质的溶解度大于N物质的溶解度
D.N物质的溶解度随温度的升高而降低
【答案】D
A、在t2℃时,M的溶解度大于N的溶解度,则在t2℃时,M的饱和溶液中溶质的质量分数比N大,此选项错误;
B、由于N的溶解度随温度的升高而减小,因此如果把N的饱和溶液由t1℃升温到t2℃时,N的饱和溶液中就会有晶体析出,则溶液中溶质的质量分数就会减小,此选项错误;
C、比较溶解度大小必须指明温度,由两物质的溶解度曲线可知,在高于t1℃时的某一温度,M的溶解度才大于N的溶解度,此选项错误;
D、由N的溶解度曲线不难看出,N的溶解度随温度的升高而减小,此选项正确。
故选:
D。
8.图1可表示“M与N的并列关系”,图2可表示“M属于N的从属关系”。
下列概念间的关系符合图3所示关系的是( )
选项
X
Y
Z
A
溶质
溶液
B
悬浊液
乳浊液
C
氧化物
单质
化合物
D
饱和溶液
不饱和溶液
浓溶液
A.AB.BC.CD.D
【答案】A
概念间的关系符合图3所示关系是X、Y从属Z中,而X、Y之间的关系是并列。
A、溶液是由溶质和溶剂组成的,则溶质、溶剂、溶液符合关系,故A正确;
B、悬浊液、乳浊液、溶液是并列关系,故B不正确;
C、单质并不包含于化合物,故C不正确;
D、饱和溶液、不饱和溶液与浓溶液属于交叉关系,故D不正确。
故选A。
【点睛】
溶液包括溶质和溶剂,纯净物包括单质和化合物。
9.通常要使一种不饱和溶液变为饱和溶液,最简单的方法是()
A.加入溶质
B.降低温度
C.升高温度
D.恒温蒸发溶剂
A、向不饱和溶液中增加溶质,随着不饱和溶液继续溶解溶质而逐渐变成饱和溶液,故A正确;
B、降温时,大多数固体物质的溶解度会减小,但气体物质、氢氧化钙等却会随温度降低而溶解度增大,它们的不饱和溶液也就会更不饱和,故B不正确;
C、升温时,对于大多数固体物质而言,物质的溶解度会增大,使不饱和溶液变得更不饱和溶液,因此,故C不正确;
D、恒温蒸发部分溶剂后有晶体析出,变为饱和溶液,但是操作比较复杂,故D不正确。
大多数物质不饱和溶液变成饱和溶液一般采取三种方法:
增加溶质、恒温蒸发溶剂、改变温度。
10.X、Y两种固体物质的溶解度曲线如图所示。
下列说法正确的是( )
A.t1℃时X的饱和溶液升温至t2℃时仍是饱和溶液
B.分别将t1℃时X、Y的饱和溶液升温至t2℃,所得溶液中溶质的质量分数相等
C.相同温度时,X的溶解度一定大于Y的溶解度
D.Y的溶解度随温度的升高而增大
A、根据溶解度曲线可知,X的溶解度随温度的升高而增大,t1℃X的饱和溶液升温至t2℃变成不饱和溶液,错误;
B、根据溶解度曲线可知,X、Y的溶解度从t1℃升温至t2℃时,溶解度变大,溶质的质量分数不变,t1℃时X、Y溶解度相等,它们的饱和溶液的质量分数相等,分别将t1℃X、Y的饱和溶液升温至t2℃,所得溶液中溶质的质量分数相等,正确;
C、根据溶解度曲线可知,相同温度时,X的溶解度不一定大于Y的溶解度,错误;
D、根据溶解度曲线可知,Y的溶解度随温度的升高先升高后减少,错误。
11.甲、乙两种固体物质(不含结晶水)的溶解度曲线如下图。
下列说法不正确的是( )
A.甲物质的溶解度可能大于乙物质的溶解度
B.t1℃时,60克甲的饱和溶液中加入10克乙物质,溶液质量可能仍为60g
C.t2℃时,甲、乙饱和溶液分别降温至t1℃,析出甲的质量可能比乙大
D.t2℃时,甲溶液的溶质质量分数可能大于乙溶液的溶质质量分数
A、由溶解度曲线可知,甲物质的溶解度可能大于乙物质的溶解度,说法正确;
故不符合题意;
B、t1℃时,60克甲的饱和溶液中加入10克乙物质,全部溶解,故溶液质量是70g,说法错误;
故符合题意;
C、甲的溶解度随温度的升高增大明显,故t2℃时,等质量的甲、乙饱和溶液分别降温至t1℃,甲析出晶体的质量比乙多,说法正确;
D、t2℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液的溶质质量分数,若不是饱和则有可能乙溶液的溶质质量分数大于甲溶液的溶质质量分数,说法正确;
故选B
本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
12.t℃时,向饱和溶液中加入一定量的水后,下列有关该溶液的叙述正确的是( )
A.仍为饱和溶液B.溶质的质量变小
C.溶质的溶解度不变D.溶质的质量分数不变
A、t℃时,向硝酸钠饱和溶液中加入一定量的水,溶液能继续溶解硝酸钠,溶液变为不饱和溶液,故选项说法错误;
B、t℃时,向硝酸钠饱和溶液中加入一定量的水,溶质质量不变,故选项说法错误;
C、固体物质的溶解度受温度影响较大,不受溶剂质量、溶液质量多少的影响,由于温度不变,溶质的溶解度不变,故选项说法正确;
D、t℃时,向硝酸钠饱和溶液中加入一定量的水,溶质质量不变,溶剂质量增加,溶质的质量分数变小,故选项说法错误。
掌握饱和溶液与饱和溶液的特征与转化、溶质质量分数、溶解度的概念等并能灵活运用是正确解答本题的关键。
13.根据如图物质的溶解度曲线,判断下列说法正确的是
A.将乙的饱和溶液过滤,能得到不饱和溶液
B.t1℃时,甲溶液、乙溶液的溶质质量相等
C.t2℃185g甲溶液降温至t1℃时,能析出49g晶体
D.将26%的甲溶液从t2℃降温到t1℃时,溶质质量分数不变
A、将饱和溶液变为不饱和溶液最可靠的方法是加溶剂或者是改变温度。
将乙的饱和溶液过滤,不能得到不饱和溶液,说法错误;
B、由图可知t1℃时,甲、乙溶解度相等。
t1℃时,甲溶液、乙溶液是否饱和不清楚,溶质质量是否相等无法判断,说法错误;
C、t2℃185g甲溶液是否饱和不清楚,故将t2℃185g甲溶液降温至t1℃时,能析出49g晶体,说法错误;
D、t1℃时,甲物质的溶解度是36g,饱和溶液溶质质量分数=
×
100%=26.5%,所以将26%的甲溶液从t2℃降温到t1℃时,溶质质量分数不变,正确;
点睛:
根据固体的溶解度曲线可以:
①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
14.甲、乙两种不含结晶水的固体物质的溶解度曲线如图,下列说法中正确的是
A.甲的溶解度比乙大
B.t2℃时,甲、乙的两种溶液中溶质的质量分数相等
C.t1℃时,将50g水加入15g甲物质中,可得到65g溶液
D.要使接近饱和的乙溶液转化为饱和溶液,可采用蒸发溶剂的方法
没有的指定温度,无法比较溶解度,A错误;
t2℃时,甲、乙的两种溶液的溶解度相等,则t2℃时,甲、乙的饱和溶液中溶质的质量分数相等,B错误;
t1℃时,甲的溶解度为20g,将50g水加入15g甲物质中,只能溶解10g,可得到60g溶液,;
C错误。
溶解度曲线。
15.向t℃时饱和的Na2CO3溶液中加入ng无水Na2CO3,会析出mgNa2CO3·
10H2O,则(m-n)的值为( )
A.饱和溶液失去水的质量
B.饱和溶液失去溶质的质量
C.饱和溶液失去水和溶质的质量之和
D.其数值为0,即溶液质量不变
解:
设原溶液共为xg,析出mgNa2CO3·
10H2O后溶液为yg。
则x+n-m=y,
解得,x-y=m-n,
即饱和溶液失去水和溶质的质量之和=m-n;
16.如图是KNO3、MgSO4、NaCl三种物质的溶解度曲线。
A.t2℃时,把40gKNO3放入50g水中能得到KNO3饱和溶液,其中溶质和溶液的质量比为4:
9
B.t3℃时,图中三种物质的饱和溶液降温至t1℃,所得溶液中溶质质量分数大小关系为NaCl>MgSO4>KNO3
C.t4℃时,其他条件不变,把MgSO4饱和溶液升温到t5℃,在此操作过程中溶液里无明显现象
D.KNO3中含有少量的NaCl杂质,采用蒸发结晶法提纯
A、t2℃时,硝酸钾的溶解度是40g,所以把40gKNO3放入50g水中能得到KNO3饱和溶液,其中溶质和溶液的质量比为20g:
70g=2:
7,故A错误;
B、t1℃时,氯化钠的溶解度最大,硝酸钾的溶解度最小,所以t3℃时,图中三种物质的饱和溶液降温至t1℃,所得溶液中溶质质量分数大小关系为NaCl>MgSO4>KNO3,故B正确;
C、t4℃时,其他条件不变,把MgSO4饱和溶液升温到t5℃,溶解度减小,在此操作过程中溶液里会析出晶体,故C错误;
D、硝酸钾的溶解度受温度变化影响较大,所以KNO3中含有少量的NaCl杂质,采用降温结晶法提纯,故D错误。
B。
17.甲、乙两种固体物质的溶解度曲线如图所示.下列叙述中正确的是()
A.甲物质的溶解度大于乙物质的溶解度
B.t1℃时,甲、乙两物质饱和溶液的溶质质量分数一定相等
C.t2℃时,将30g甲物质放入70g水中,所得饱和溶液的质量为100g
D.t2℃时,甲、乙两物质的饱和溶液降温到t1℃,析出晶体质量甲>乙
A、比较物质的溶解度大小,须确定温度,不知温度,则无法比较,故错误;
B、t1℃时,甲、乙物质的溶解度相等,饱和溶液的溶质质量分数=S/(100+S)×
100%.甲、乙物质的饱和溶液的溶质质量分数相等,故正确;
C、t2℃时,甲的溶解度是30g,100g水中最多溶解30g,30g甲溶解在70g水中形成溶液的质量=21g+70g=91g,不是100g溶液;
故错误;
D、甲、乙的饱和溶液的质量不确定,所以从t2℃降到t1℃,析出晶体的质量也不确定,故错误;
18.饱和溶液用水稀释变成不饱和溶液的过程中,保持不变的是( )
A.溶质的质量
B.溶剂的质量
C.溶液的质量
D.溶质与溶剂的质量比
A项,饱和溶液用水稀释变成不饱和溶液的过程中,溶质的质量不变,正确;
B项,饱和溶液用水稀释变成不饱和溶液的过程中,溶剂的质量增加,错误;
C项,饱和溶液用水稀释变成不饱和溶液的过程中,溶液的质量增加,错误;
D项,饱和溶液用水稀释变成不饱和溶液的过程中,溶质与溶剂的质量比发生改变,错误。
19.在一定温度下,有一杯完全溶解的、饱和的氯化铵溶液,如果想把它变为不饱和溶液,下列可采取的措施有(已知氯化铵固体的溶解度随温度的升高而增大)①降低温度,②升高温度,③加氯化铵固体,④加溶剂,⑤恒温蒸发溶剂
A.①③④
B.①③⑤
C.②④
D.②⑤
在一定温度下,有一杯完全溶解的、饱和的氯化铵溶液,氯化铵固体的溶解度随温度的升高而增大,升高温度,氯化铵的溶解度增大,能变为不饱和溶液;
温度越低,氯化铵的溶解度减小,氯化铵饱和溶液降温后会析出晶体,仍然是饱和溶液。
加入氯化铵固体,不能继续溶解,溶液仍为饱和溶液。
加溶剂,氯化铵能继续溶解,能变为不饱和溶液。
恒温蒸发溶剂,有氯化铵析出,溶液仍为饱和溶液。
故②④能将饱和溶液转化为不饱和溶液。
20.下图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,下列说法正确的是
A.蒸发前原溶液是饱和溶液
B.甲的溶解度随温度的升高而减小
C.n的数值是11
D.20℃时甲的溶解度是6g
A、蒸发前烧杯中的溶液没有固体剩余,故可能是饱和溶液也可能是不饱和溶液,错误;
B、该过程中温度不变,故不能判断该物质的溶解度和温度的关系,错误;
C、第一次蒸发10g水后有晶体析出,故得到的溶液是饱和溶液,再次蒸发10g水后共有6g甲,即10g水中能溶解5g甲,那么第三次蒸发10g水也能析出5g甲,故三次共析出甲11g,即n=11,正确;
D、20℃时10g水中能溶解5g甲得到饱和状态,那么100g水中能溶解50g甲,故20℃时甲的溶解度是50g,错误。
21.甲、乙、丙三种固体物质的溶解度曲线如图所示,下列说法正确的是( )
A.降温可使丙物质的不饱和溶液变成饱和溶液
B.t2℃时,等质量甲、乙、丙的饱和溶液中溶剂的质量:
甲>乙>丙
C.t2℃时,将15g甲物质加入到50g水中,再降温到t1℃,所得溶液溶质的质量分数不变
D.分别将甲、乙、丙三种物质t2℃的饱和溶液降温到t1℃,所得溶液溶质的质量分数乙>甲=丙
A、丙物质随着温度升高溶解度降低,故降温不可使丙物质的不饱和溶液变成饱和溶液,错误;
B、t2℃时,甲、乙、丙的饱和溶液,溶质质量分数根据图可知,甲>乙>丙,故等质量甲、乙、丙的饱和溶液中溶质的质量:
甲>乙>丙,溶剂=溶液-溶质,故答案顺序正好反了,错误;
C、t2℃时,将15g甲物质加入到50g水中,再降温到t1℃,溶解度为30g,即100g水中溶解30g,得50g水最多溶解正好为15g,所以所得溶液溶质的质量分数不变,正确;
D、分别将甲、乙、丙三种物质t2℃的饱和溶液降温到t1℃,应该是图像的平移,丙不变,甲、乙分别减小到t1℃和两溶解度曲线的交点,故所得溶液溶质的质量分数乙>甲>丙,错误。
22.甲、乙两种物质的溶解度曲线如图所示。
A.依据溶解度曲线可判断,甲的溶解度比乙大
B.10℃时,甲、乙饱和溶液溶质的质量相同
C.20℃时,把30g甲放入50g水中形成的溶液中溶质质量分数为37.5%
D.将20℃时的甲、乙饱和溶液升温至30℃,甲、乙溶液中溶质的质量分数均不变
A、在溶解度曲线图上,横坐标是温度,纵坐标是溶解度。
温度影响溶解度,所以不指名温度,无法比较溶解度的大小,错误;
B、
,10℃时,甲、乙的溶解度相同,饱和溶液溶质的质量分数相同,溶液的质量不确定,错误;
C、20℃时,甲的溶解度为40g,溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量,把30g甲放入50g水中,溶质为20g,形成的溶液中溶质质量分数为20g÷
70×
100%≈28.6%,错误;
D、将20℃时的甲、乙饱和溶液升温至30℃,甲、乙的溶解度变大,溶液变成不饱和溶液,溶质、溶剂的量都不变,溶液中溶质的质量分数均不变,正确。
故选D。
23.abc三种物质的溶解度曲线如图所示,则下列说法正确的是( )
A.a的溶解度大于b的溶解度
B.t1℃时bc两物质饱和溶液中所含有的溶质相等
C.t2℃时,abc三种物质的饱和溶液降温到t1℃,三种溶液的溶质质量分数大小顺序是b=c>a
D.除去a中含有少量的c可以采用降温结晶的方法
根据题目信息和溶解度曲线可知:
a、b两种固体物质的溶解度,都是随温度升高而增大,而c的溶解度随温度的升高而减少。
A、a的溶解度大于b的溶解度错误,因为没有指明温度;
故A不正确;
B、t1℃时b、c两物质饱和溶液中所含有的溶质相等错误,因为没有指明是等质量的饱和溶液;
故B不正确;
C、t2℃时,a、b、c三种物质的饱和溶液降温到t1℃,三种溶液的溶质质量分数大小顺序是b>a>c,故C不正确;
D、除去a中含有少量的c可以采用降温结晶的方法正确,因为a的溶解度受温度的影响比较大故D正确;
固体物质的溶解度是在某一温度下,100克溶剂中溶解某种溶质达到饱和状态时溶解的溶质的质量。
24.下图是甲、乙、丙三种固体物质的溶解度曲线。
下列叙述错误的是
A.t1℃时,三种物质的溶解度大小顺序为:
丙>
乙>
甲
B.t2℃时,甲、丙两种物质的溶液中溶质的质量分数相等
C.若甲物质中混有少量的乙物质,可用降温结晶的方法提纯甲
D.若要将组成在N点的甲溶液转变为M点的甲溶液,可以采用恒温蒸发溶剂的方法
A、由t1℃时溶解度的大小可知,选项A正确;
B、t2℃时,甲、丙两种物质的溶液中溶质的质量分数相等是错误的叙述,因为题中没有说明溶液是否饱和,是饱和溶液溶质的质量分数相等,不饱和溶液就不一定相等,选项B不正确;
C、若甲物质中混有少量的乙物质,可用降温结晶的方法提纯甲是正确的,选项C正确;
D、若要将组成在N点的甲溶液转变为M点的甲溶液,可以采用恒温蒸发溶剂的方法是正确的选项D正确。
25.如图为四种物质的溶解度曲线。
则下列说法错误的是()
A.当温度为10℃时,物质溶解度关系为①>③>②>
④
B.若NH4H2PO4中混有少量NaCl杂质,可在较高温度配成饱和溶液,再降温结晶
C.在10℃时把NH4H2PO4和Ce2(SO4)3的饱和溶液升温到30℃,有晶体析出的是Ce2(SO4)3
D.22℃时(NH4)2HPO4饱和溶液的质量分数约为70%
A.在溶解度曲线图上,横坐标是温度,纵坐标是溶解度。
当温度为10℃时,物质溶解度关系为①>③>②>
④;
B.若NH4H2PO4中混有少量NaCl杂质,可在较高温度配成饱和溶液,再降温结晶,磷酸二氢铵因溶解度迅速减小而析出,氯化钠的溶解度受温度很小,氯化钠的量又少,所不析出,过滤可得较纯净的磷酸二氢铵;
C.在l0℃时把NH4H2PO4和Ce2(SO4)3的饱和溶液升温到30℃,Ce2(SO4)3因溶解度变小,有晶体析出,NH4H2PO4的溶解度增大,变成不饱和溶液,不析出晶体;
D.溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。
饱和溶液溶质的质量分数=溶解度