非金属元素及化合物知识点总结Word文件下载.docx
《非金属元素及化合物知识点总结Word文件下载.docx》由会员分享,可在线阅读,更多相关《非金属元素及化合物知识点总结Word文件下载.docx(20页珍藏版)》请在冰豆网上搜索。
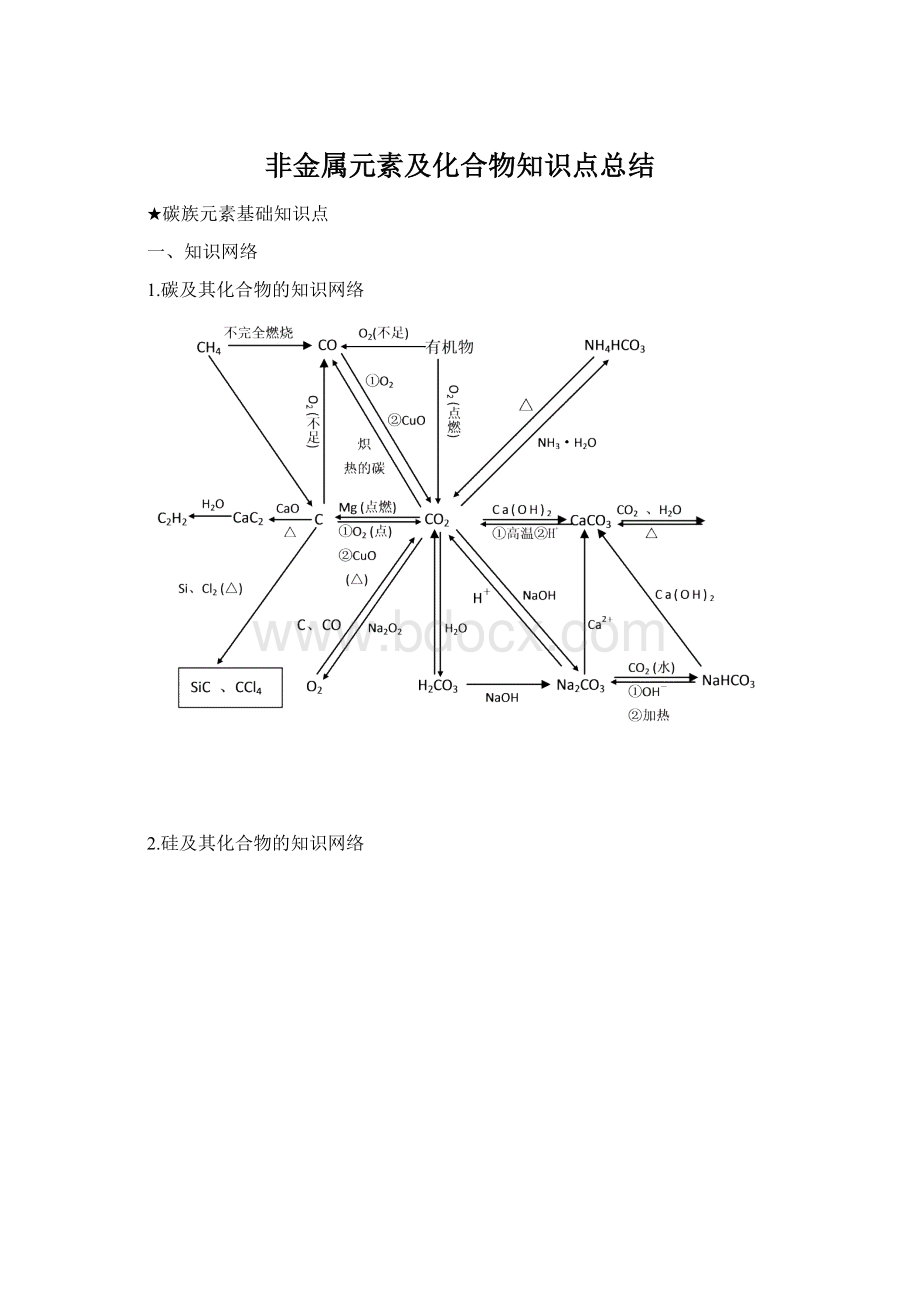
碱金属正盐>
碱金属酸式盐:
Na2CO3>
③相互转化:
碳酸正盐
碳酸酸式盐(除杂用)
6.硅
①硅在地壳中只有化合态,没有游离态。
其含量在地壳中居第二,仅次于氧,是构成矿物和岩石的主要成分。
②晶体硅是灰黑色,有金属光泽,硬而脆的固体,是半导体,具有较高的硬度和熔点。
③硅的化学性质不活泼,常温下,只能与氟气、氢氟酸及强碱溶液反应:
Si+2F2→SiF4、
Si+4HF→SiF4+2H2↑、Si+2NaOH+H2O→Na2SiO3+2H2↑;
在加热条件下,能与氧气、氯气等少数非金属单质化合:
Si+O2
SiO2。
7.SiO2①SiO2为原子晶体,是一种坚硬难熔的固体,硬度、熔点都很高。
②二氧化硅的化学性质很稳定,不能跟酸(氢氟酸除外)发生反应。
由于它是一种酸性氧化物,所以能跟碱性氧化物或强碱反应
SiO2+CaO
CaSiO3
SiO2+2NaOH→Na2SiO3+H2O(碱溶液不能在使用磨口玻璃塞的试剂瓶中)
③二氧化硅是一种特殊的酸性氧化物
a.酸性氧化物大都能直接跟水化合生成酸,但二氧化硅却不能直接跟水化合,它的对应水化物(硅酸)只能用相应的可溶性硅酸盐跟盐酸作用制得
b.酸性氧化物一般不跟酸作用,但二氧化硅却能跟氢氟酸起反应:
SiO2+4HF→SiF4+2H2O(氢氟酸不能盛放在玻璃容器中)。
④光导纤维⑤石英、水晶
8.硅酸和硅胶
①硅酸:
硅酸酸性比碳酸还弱,由下列反应可证明:
Na2SiO3+CO2+H2O→H2SiO3↓+Na2CO3
③硅胶:
烘干的硅胶是一种多孔性物质,具有良好的吸水性。
而且吸水后还能烘干重复使用,所以在实验室中常把硅胶作为作为干燥剂。
10.硅酸盐
①硅酸盐是构成地壳岩石的主要成分,其结构复杂,组成可用氧化物的形式表示。
例如:
硅酸钠Na2SiO3(Na2O·
SiO2);
镁橄榄石Mg2SiO4(2MgO·
高岭石Al2(Si2O5)(OH)4(A12O3·
2SiO2·
2H2O)
③人造硅酸盐:
主要有玻璃、水泥、各种陶瓷、砖瓦、耐火砖、水玻璃以及某些分子筛等。
④硅酸钠,其水溶液俗称水玻璃,是一种矿物胶,可作粘合剂,防腐剂。
11.水泥、玻璃、陶瓷
①普通水泥的主要成分是硅酸三钙(3CaO·
SiO2)、硅酸二钙(2CaO·
SiO2)和铝酸三钙(3CaO·
Al2O3),水泥具有水硬性,水泥、沙子和碎石的混合物叫混凝土。
②制玻璃的主要原料是纯碱、石灰石和石英,主要反应是:
SiO2+Na2CO3
Na2SiO3+CO2↑、SiO2+CaCO3
CaSiO3+CO2↑,玻璃是无固定熔点的混合物。
加入氧化钴后的玻璃呈蓝色,加入氧化亚铜后的玻璃呈红色,普通玻璃一般呈淡绿色,这是因为原料中混有二价铁的缘故。
③制造陶瓷的主要原料是黏土,黏土的主要成分:
Al2O3·
2H2O。
12.无机非金属材料
无机非金属材料包含除传统陶瓷外的各种性能优异的精细陶瓷:
耐高温的二氧化锆(ZrO2)陶瓷、高熔点的氮化硅(Si3N4)和碳化硅(SiC)陶瓷;
透明的氧化铝、砷化镓(GaAs)、硫化锌(ZnS)、硒化锌(ZnSe)、氟化镁(MgF2)、氟化钙(CaF2)等氧化物或非氧化物陶瓷;
生物陶瓷;
超细微粉体粒子制造的纳米陶瓷等。
氮族元素
1.氮和磷
[氮族元素]包括氮(7N)、磷、(15P)、砷(33As)、锑(51Sb)、铋(83Bi)五种元素.
[氮气]
(1)氮气的分子结构:
氮分子(N2)的电子式为
,结构式为N≡N.由于N2分子中的
N≡N键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼.
(2)氮气的化学性质:
①N2与H2化合生成NH3N2+3H2
2NH3
②N2与O2化合生成NO:
N2+O2
2NO
(3)氮气的用途:
①合成氨,制硝酸;
②代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化;
③在灯泡中填充氮气以防止钨丝被氧化或挥发;
④保存粮食、水果等食品,以防止腐烂;
⑤医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术;
⑥利用液氮制造低温环境,使某些超导材料获得超导性能.
[NO、NO2性质的比较]
氮的氧化物
一氧化氮(NO)
二氧化氮(NO2)
物理性质
为无色、不溶于水、有毒的气体
为红棕色、有刺激性气味、有毒的气体,易溶于水
化学性质
①极易被空气中的O2氧化:
2NO+O2=2NO2
②NO中的氮为+2价,处于中间价态,既有氧化性又有还原性
与H2O反应:
3NO2+H2O=2HNO3+NO
(工业制HNO3原理.在此反应中,NO2同时作氧化剂和还原剂)
[光化学烟雾]空气中的NO、NO2污染物主要来自于石油产品和煤燃烧的产物、汽车尾气以及制硝酸工厂的废气.NO2是造成光化学烟雾的主要因素.
(2)单质磷的化学性质:
①与O2反应:
4P+5O2
2P2O5
②磷在C12中燃烧:
2P+3C12(不足量)
2PCl32P+5Cl2(足量)
2PCl5
[磷的同素异形体——白磷与红磷]白磷
红磷
2.铵盐
[氨]
(1)氨的物理性质:
①氨是无色、有刺激性气味的气体,比空气轻;
②氨易液化.在常压下冷却或常温下加压,气态氨转化为无色的液态氨,同时放出大量热.液态氨气化时要吸收大量的热,使周围的温度急剧下降;
③氨气极易溶于水.在常温、常压下,1体积水中能溶解约700体积的氨气(因此,氨气可进行喷泉实验);
④氨对人的眼、鼻、喉等粘膜有刺激作用.若不慎接触过多的氨而出现病症,要及时吸入新鲜空气和水蒸气,并用大量水冲洗眼睛.
(2)氨分子的结构:
NH3的电子式为
,结构式为
,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°
18′,是极性分子.
(3)氨的化学性质:
①跟水反应.氨气溶于水时(氨气的水溶液叫氨水),大部分的NH3分子与H2O分子结合成NH3·
H2O(叫一水合氨).NH3·
H2O为弱电解质,只能部分电离成NH4+和OH-:
NH3+H2O
NH3·
H2O
NH4++OH-
a.氨水的性质:
氨水具有弱碱性,使无色酚酞试液变为浅红色,使红色石蕊试液变为蓝色NH3·
H2O不稳定,故加热氨水时有氨气逸出:
NH4++OH-
NH3↑+H2O
b.氨水的组成:
氨水是混合物(液氨是纯净物),其中含有3种分子(NH3、NH3·
H2O、H2O)和3种离子(NH4+和OH-、极少量的H+).
c.氨水的保存方法:
氨水对许多金属有腐蚀作用,所以不能用金属容器盛装氨水.通常把氨水盛装在玻璃容器、橡皮袋、陶瓷坛或内涂沥青的铁桶里.
②跟氯化氢气体的反应:
NH3+HCl=NH4C1
说明a.蘸有浓氨水的玻璃棒与蘸有浓盐酸的玻璃棒靠近时,产生白烟NH4C1晶体小颗粒.
b.氨气与挥发性酸(浓盐酸、浓硝酸等)相遇,因反应生成微小的铵盐晶体而冒白烟,这是检验氨气的方法之—.
c.氨气与不挥发性酸(如H2SO4、H3PO4等)反应时,无白烟生成.
③跟氧气反应:
4NH3+5O2
4NO+6H2O
(4)氨气的用途:
①是氮肥工业及制造硝酸、铵盐、纯碱的原料;
②是有机合成工业如合成纤维、塑料、染料、尿素等的常用原料;
③用作冰机中的致冷剂.
[铵盐]
①受热分解.固态铵盐受热都易分解.根据组成铵盐的酸根阴离子对应的酸的性质的不同,a.组成铵盐的酸根阴离子对应的酸是非氧化性的挥发性酸时,则加热时酸与氨气同时挥发,
冷却时又重新化合生成铵盐。
NH4Cl(固)
NH3↑+HCl↑NH3+HCl=NH4Cl
又如:
(NH4)2CO3
2NH3↑+H2O+CO2↑NH4HCO3
NH3↑+H2O+CO2↑
b.组成铵盐的酸根阴离子对应的酸是难挥发性酸,加热时则只有氨气逸出,酸或酸式盐仍残留在容器中.如:
(NH4)2SO4
NH4HSO4+NH3↑(NH4)3PO4
H3PO4+3NH3↑
②跟碱反应——铵盐的通性.
固态铵盐+强碱(NaOH、KOH)
无色有刺激性气味的气体
试纸变蓝色.
(2)氮肥的存放和施用.铵盐可用作氮肥.由于铵盐受热易分解,因此在贮存时应密封包装并存放在阴凉通风处;
施用氮肥时应埋在土下并及时灌水,以保证肥效.
[氨气的实验室制法]
(1)反应原理:
固态铵盐[如NH4Cl、(NH4)2SO4等]与消石灰混合共热:
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
(2)发生装置类型:
固体+固体
气体型装置(与制O2相同).
(3)干燥方法:
常用碱石灰(CaO和NaOH的混合物)作干燥剂.不能用浓H2SO4、P2O5等酸性干燥剂和CaCl2干燥氨气,因为CaCl2能与氨气发生反应生成CaCl2·
8NH3.
(4)收集方法:
只能用向下排气法,并在收集氨气的试管口放一团棉花,以防止氨气与空气形成对流而造成制得的氨气不纯.
(5)验满方法;
①将湿润的红色石蕊试纸接近集气瓶口,若试纸变蓝色,则说明氨气已充满集气瓶;
②将蘸有浓盐酸的玻璃棒接近集气瓶口,有白烟产生,说明氨气已充满集气瓶.
注意①制氨气所用的铵盐不能用NH4NO3、NH4HCO3、(NH4)2CO3等代替,因为NH4NO3在加热时易发生爆炸,而NH4HCO3、(NH4)2CO3极易分解产生CO2气体使制得的NH3不纯.
②消石灰不能用NaOH、KOH等强碱代替,因为NaOH、KOH具有吸湿性,易潮解结块,不利于生成的氨气逸出,而且NaOH、KOH对玻璃有强烈的腐蚀作用.
③NH3极易溶于水,制取和收集的容器必须干燥.
④实验室制取氨气的另一种常用方法:
将生石灰或烧碱加入浓氨水中并加热.有关反应的化学方程式为:
CaO+NH3·
Ca(OH)2+NH3↑
加烧碱的作用是增大溶液中的OH-浓度,促使NH3·
H2O转化为NH3,这种制氨气的发生装置与实验室制Cl2、HCl气体的装置相同.
难点3.硝酸
[硝酸]
(1)物理性质:
纯硝酸是无色、易挥发(沸点为83℃)、有刺激性气味的液体.打开盛浓硝酸的试剂瓶盖,有白雾产生.(与盐酸相同)质量分数为98%以上的浓硝酸通常叫做发烟硝酸
(2)化学性质:
不稳定性.HNO3见光或受热分解,HNO3越浓,越易分解.硝酸分解出NO2溶于其中而使硝酸呈黄色.有关反应的化学方程式为:
4HNO3
2H2O+4NO2↑+O2↑
强氧化性:
稀HNO3、浓HNO3,都具有极强的氧化性.HNO3浓度越大,氧化性越强.
金属+HNO3(浓)→硝酸盐+NO2↑+H2O
金属+HNO3(稀)→硝酸盐+NO↑+H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
该反应较缓慢,反应后溶液显蓝色,反应产生的无色气体遇到空气后变为红棕色(无色的NO被空气氧化为红棕色的NO2)。
实验室通常用此反应制取NO气体.
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
该反应较剧烈,反应过程中有红棕色气体产生.此外,随着反应的进行,硝酸的浓度渐渐变稀,反应产生的气体是NO2、NO等的混合气体.
b.常温下,浓HNO3能将金属Fe、A1钝化,使Fe、A1的表面氧化生成一薄层致密的氧化膜.因此,可用铁或铝制容器盛放浓硝酸
c.浓HNO3与浓盐酸按体积比1∶3配制而成的混合液叫王水.王水溶解金属的能力更强,能溶解金属Pt、Au.
d.能把许多非金属单质(如C、S、P等)氧化成最高价含氧酸或最高价非金属氧化物.例如:
C+4HNO3(浓)=CO2↑+4NO2↑+2H2O
e.能氧化某些具有还原性的物质,如H2S、SO2、Na2SO3、HI、HBr、Fe2+等.应注意的是,NO3-无氧化性,而当NO3-在酸性溶液中时,则具有强氧化性.
氧族元素知识归纳
一、硫及其化合物转化关系图
二 1.与氧气有关的反应
(1)有氧气参加的反应方程式
①与绝大多数金属单质作用
4Na+O2=2Na2O
②与绝大多数非金属单质作用
③与非还原性化合物作用
2NO+O2=2NO2
4FeS2+11O2
2Fe2O2+8SO2
④与有机物作用
⑤在空气中易被氧化而变质的物质
a.氢硫酸或可溶性硫化物:
2H2S+O2=2S↓+2H2O
b.亚硫酸及其可溶性盐2H2SO3+O2=2H2SO4,2Na2SO4+O2=2Na2SO4
c.亚铁盐、氢氧化亚铁4Fe(OH)2+O2+2H2O=4Fe(OH)3
d.苯酚
e.氢碘酸及其可溶性碘化物4HI+O2=2H2O+2I2
⑥吸氧腐蚀 (如:
铁生锈)
负极:
2Fe—4e—=2Fe2+正极:
O2+4e—+2H2O=4OH—Fe2++2OH—=Fe(OH)2
4Fe(OH)2+O2+2H2O=4Fe(OH)32Fe(OH)3=Fe2O3+3H2O
(2)生成氧气的反应方程式
2.氧气和臭氧的比较
物质名称
臭 氧
氧 气
通常状态
气 态
气 味
有刺激性臭味
无 味
熔点/℃
约—251
约—218
沸点/℃
约—112
约—183
颜 色
气态呈浅蓝色,液态呈深蓝色,固态呈紫黑色
气态无色,液态呈浅蓝色,固态仍呈浅蓝色
2.143
1.429
494
30.8
主要化学性质
氧化性极强,可氧化Ag、Hg等
氧化性强,但难氧化Ag、Hg等
主要用途
漂白、消毒;
地球上生物的天然保护伞;
刺激中枢神经,加速血液循环
供给呼吸,支持燃烧
自然存在
90%存在于距地面15km—50km的大气平流层中
主要存在于空气中,空气中O2占的体积分数约为20%
相互转化
3.硫元素的化学反应
(1)硫单质的反应
④S+Hg=HgS
⑥S+2Ag=Ag2S⑦3S+6KOH=2K2S+K2SO3+3H2O
⑩S+6HNO3(浓)=H2SO4+6NO2↑+2H2O
(2)H2S的反应
①H2S
H2+S↓②
③H2S+X2=2HX+S↓(X2是指卤素单质,即Cl2,Br2,I2)
④H2S+Pb(Ac)2=PbS↓+2HAc
⑤H2S+CuSO4=CuS↓+H2SO4
⑦FeS+2HCl=FeCl2+H2S↑(H2S的实验室制法)
(3)SO2的反应
①SO2+2H2S=3S↓+2H2O ②
③SO2+Na2O=Na2SO3④SO2+Na2O2=Na2SO4 ⑤SO2+2NaOH=Na2SO3+H2O
⑥Na2SO3+SO2+H2O=2NaHSO3⑦2NaHCO3+SO2=Na2SO3+2CO2+H2O
⑧Na2CO3+SO2=Na2SO3+CO2⑨
⑩SO2+X2+2H2O=H2SO4+2HXNa2SO3+X2+H2O=Na2SO4+2HX(X2=Cl2,Br2,I2)
2FeCl3+SO2+2H2O=2FeCl2+2HCl+H2SO4
SO2+NH3·
H2O=NH4HSO3
Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
2Na2SO3+O2=2Na2SO4(亚硫酸易被氧化而变质)
(4)浓H2SO4有关反应(稀H2SO4具有酸的通性)
4.硫化物的溶解性
硫化物
溶解性
反应举例
Na2S、K2S、(NH4)2S
溶于水,又溶于酸
(NH4)2S+2HCl=2NH4Cl+H2S↑
BaS、CaS、MgS、Al2S3
遇水分解
Al2S3+6H2O=2Al(OH)3↓+3H2S↑
ZnS(白)、FeS(黑)
不溶于水,但溶于酸
ZnSO4+Na2S=ZnS↓+Na2SO4
ZnS+H2SO4=ZnSO4+H2S↑
Ag2S、HgS、CuS、PbS(HgS为红色,其他均为黑色)
不溶于水,也不溶于酸
CuSO4+H2S=CuS↓+H2SO4
2AgNO3+Na2S=Ag2S↓+2NaNO3
5.工业制硫酸的十个“三”
(1)三原料(黄铁矿或硫、空气、水)
(2)三阶段 ①硫铁矿煅烧 ②SO2的制备和SO2的净化和氧化③SO3的吸收和H2SO4的
(3)三方程
SO3+H2O=H2SO4
(4)三条件(SO2转化为SO3需1个大气压、400℃—500℃、V2O5作催化剂)
(5)三设备
沸腾炉、接触室、吸收塔
(6)三杂质(矿尘、砷、硒的化合物、水蒸气)
(7)三净化(除尘、洗涤、干燥)
(8)三原理(热交换、逆流、增大接触面)
(9)三注意(粉碎硫铁矿、用98.3%的浓H2SO4吸收SO3、SO2的回收与利用)
(10)三关系(FeS2—2H2SO4,S—H2SO4,SO2—H2SO4)
10.浓H2SO4的吸水性与脱水性有何不同
(1)浓硫酸能够强烈地吸水而形成一系列稳定的水化物,如H2SO4·
H2O、H2SO4·
2H2O和H2SO4·
4H2O等。
例如,浓H2SO4可以吸收空气里的水分。
因而,浓H2SO4可用作某些气体的干燥剂。
吸水性是指浓硫酸吸收直接的H2O,这H2O可以是游离水或晶体中的结晶水或某反应生成的水
(2)浓硫酸也能夺取纸张、木材、衣服、皮肤等有机物中的氢原子和氧原子(按水的组成比),使它们炭化。
但并不是都游离出碳,例如浓硫酸使甲酸(HCOOH)脱水以后生成的是一氧化碳。
脱水性指浓硫酸吸收非现成的H2O,而在指把有机物中H、O原子按个数2∶1脱走
11.浓H2SO4能干燥的气体
(1)选择干燥剂时应掌握的原则:
一是干燥剂本身应具有吸水性,二是干燥剂与被干燥气体(主要成分)之间不能发生化学反应(氧化还原反应、复分解反应、络合反应、化合反应
(2)浓H2SO4具有酸性,因而不能用来干燥碱性气体氨气(NH3)
(3)浓H2SO4又具有强氧化性,所以不能用来干燥强还原性的气体,例如H2S、HI、HBr
(4)可用浓H2SO4干燥的气体有H2、O2、CO2、CO、SO2、N2、CH4、C2H4、HCl、Cl2等
(5)干燥用仪器为洗气瓶
卤族元素
卤族元素包括氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At)等,它们最外层电子数都是7个电子,是元素周期表中的第ⅦA元素。
1、氯
(1)物理性质:
氯气是一种黄绿色有刺激性气味的气味,常温下能溶于水(1︰2),比空气重,易液化,有剧毒。
(2)化学性质:
氯气(Cl2)是双原子分子,原子的最外层有七个电子,是典型的非金属元素,单质是强氧化剂。
①与金属反应
2Na+Cl2===2NaCl(反应剧烈,产生大量白烟)
2Fe+3Cl2======2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液)
Cu+Cl2====CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)
氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。
②与非金属的反应
H2+Cl2=====2HCl(纯净的氢气在氯气中安静的燃烧,苍白色火焰,瓶口处有白雾产生)H2+Cl2=====2HCl(发生爆炸)
2P+3Cl2=====2PCl3(液态)PCl3+Cl2===PCl5(固态)
磷在氯气中剧烈燃烧,产生大量的烟、雾。
雾是PCl3,烟是PCl5。
氯气能有很多非金属单质反应,如S、C、Si等。
③与碱反应
Cl2+2NaOH===NaCl+NaClO+H2O
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
将氯气通入Ca(OH)2溶液中制备漂白粉,漂白粉的主要成份是CaCl2、Ca(ClO)2,其有效成份是Ca(ClO)2。
工作原理:
Ca(ClO)2+H2O+CO2===CaCO3↓+2HClO
与碱溶液反应体现了氯气什么性质?
④与某些还原性物质反应:
Cl2+2FeCl2===2FeCl3Cl2+SO2+2H2O==2HCl+H2SO4
⑤有机反应
CH4+Cl2→CH3Cl+HClCH3Cl+Cl2→CH2Cl2+HCl
CH2Cl2+Cl2→CHCl3+HClCHCl3+Cl2→CCl4+HCl
氯气与甲烷的取代反应,如有1molCl2与4molCH4反应,产物有哪些物质?
何种物质含量最多?
Cl2+CH2=CH2→CH2Cl-CH2Cl(加成反应)
取代反应是两种物质反应生成两种物质而加成反应是两种物质反应生成一种物质。
上述两反应的鉴别方法可加入硝酸酸化的硝酸银溶液。
如是取代反应则有白色沉淀生成。
⑥与水反应
Cl2+H2OHCl+HClO(HClO为一元弱酸,弱电解质HClOH++ClO—)
分子:
H2O、Cl2、HClO离子:
H+、Cl—、OH—、ClO—
2、次氯酸的性质(HClO)
仅存在溶液中,浓溶液呈黄色,稀溶液无色,有非常刺鼻的气味。
①酸性:
次氯酸是弱酸,弱电解质。
具有酸的通性。
A、显色反应;
B、与活泼金属反应置换出氢气;
C、与碱反应生成盐和水;
D、与部分金属氧化物的反应,生成盐与水;
E、与某些盐的反应。
②氧化性
Ca(ClO)2+4HCl(浓)===CaCl