溶液中的离子反应练习Word文件下载.docx
《溶液中的离子反应练习Word文件下载.docx》由会员分享,可在线阅读,更多相关《溶液中的离子反应练习Word文件下载.docx(26页珍藏版)》请在冰豆网上搜索。
A.温度升高,平衡向逆反应方向移动B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1mol·
L-1HCl溶液,溶液中c(H+)减小
D.加入少量醋酸钠固体,CH3COOH溶液的电离度增大
5.[双选题]能抑制水的电离,并使溶液中c(H+)>c(OH-)的操作是( )
A.将水加热煮沸B.向水中投入一小块金属钠C.向水中通CO2D.加入NaHSO4(s)
6.在含有酚酞的0.1mol·
L-1氨水中加入少量的NH4Cl晶体,则溶液的颜色
A.变蓝色B.变深C.变浅D.不变
7.[双选题]已知室温时,0.1mol·
L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A.加入少量NaOH固体,电离度和电离常数都增大
B.升高温度,溶液的酸性减弱
C.此酸的电离平衡常数约为1×
10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
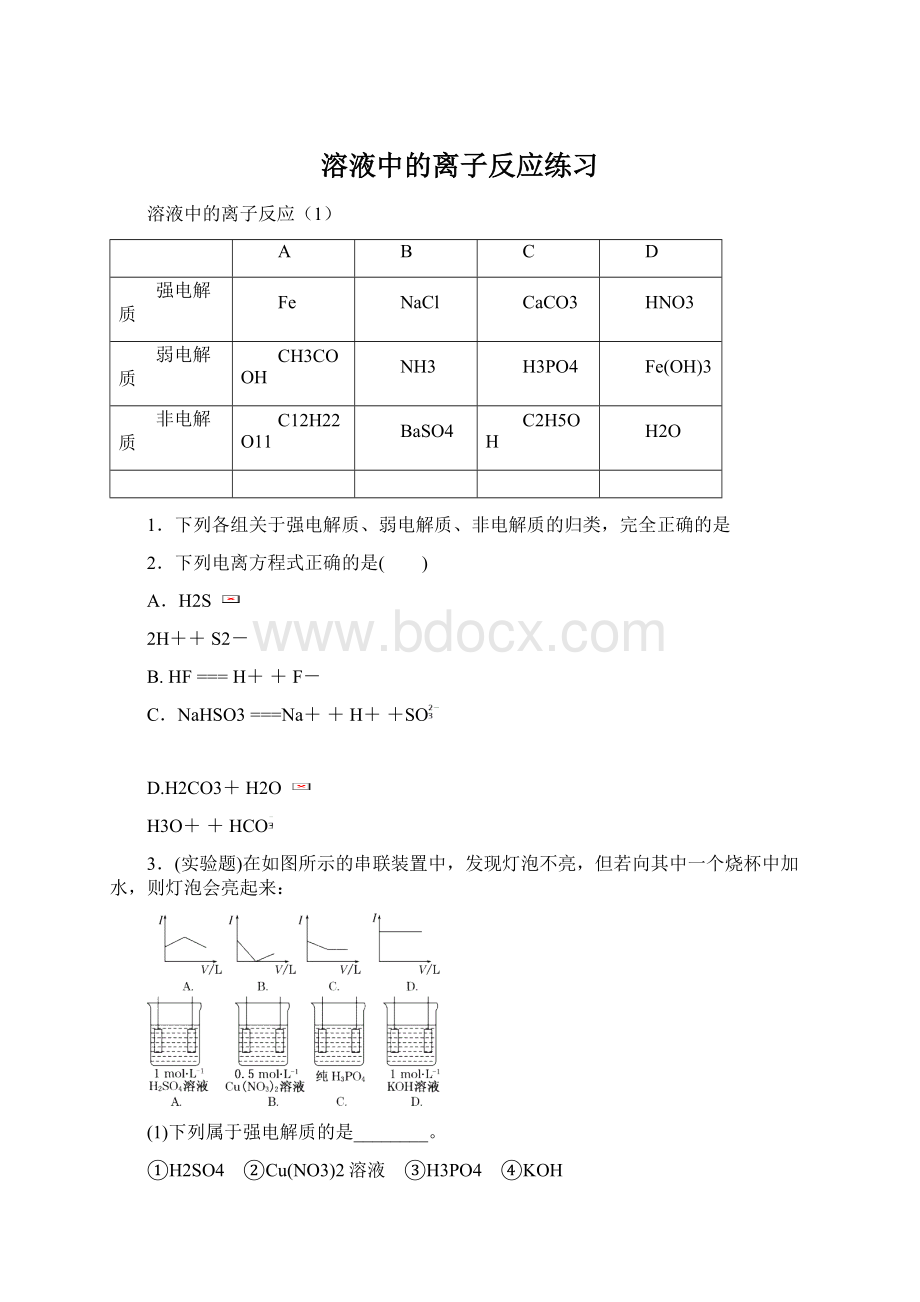
8、某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如右下图所示。
据图判断正确的是
A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点KW的数值比c点KW的数值大
D.b点酸的总浓度大于a点酸的总浓度
9、下表是几种常见弱酸的电离平衡常数(25℃)。
酸
电离方程式
电离平衡常数K
CH3COO-+H+
1.75×
10-5
H2CO3
H++HCO
HCO
H++CO
K1=4.4×
10-7
K2=4.7×
10-11
H2S
H++HS-
HS-
H++S2-
K1=1.3×
K2=7.1×
10-15
H++H2PO
H2PO
H++HPO
HPO
H++PO
K1=7.1×
10-3
K2=6.3×
10-8
K=4.2×
10-13
回答下列各题:
(1)当温度升高时,K值______(填“增大”“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?
________。
(3)若把CH3COOH、H2CO3、HCO
、H2S、HS-、H3PO4、H2PO
、HPO
都看作是酸,其中酸性最强的是________,最弱的是________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数。
对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是__________,产生此规律的原因是_________。
10、某温度下纯水的pH=6。
(1)pH=7的溶液呈________(填“酸性”、“中性”或“碱性”);
(2)该温度下0.1mol·
L-1的盐酸溶液的pH=________;
(3)0.05mol·
L-1的Ba(OH)2溶液的pH=________。
11、
(1)计算下列溶液中水电离出来的氢离子浓度
①pH=2的盐酸②pH=2的CH3COOH③pH=12Ba(OH)2④pH=12氨水
⑤pH=2的NH4Cl⑥pH=12CH3COONa
(2)①若某溶液中C(H+)水=1×
10﹣12mol·
L-1,那么溶液的PH=?
,该溶液可能是什么溶液?
②若某溶液中C(H+)水=1×
10﹣2mol·
答案:
1、C2、D3、
(1)①④
(2)A (3)C (4)B4、B5、CD6、C7、AB8、B
9、
(1)增大
(2)K值越大,酸性越强 (3)H3PO4 HS- (4)K1≫K2≫K3 上一级电离产生的H+对下一级电离有抑制作用
10、碱性111
11、
(1)C(H+)水=1×
L-1、C(H+)水=1×
L-1、C(H+)水=1×
L-1、
C(H+)水=1×
L-1
(2)①pH=2或pH=12可能是酸或碱
②pH=2或pH=12盐溶液
溶液中的离子反应
(2)
1.下列溶液一定呈中性的是(双选)( )
A.c(H+)=c(OH-)=10-6mol·
L-1溶液B.pH=7的溶液
C.c(H+)=D.由强酸与强碱等物质的量反应得到的溶液
2.[双选题]在100℃时,水的离子积为1×
10-12,若该温度下某溶液中的H+浓度为1×
10-7mol/L,则该溶液( )
A.呈碱性B.呈酸性C.呈中性D.c(OH-)=100c(H+)
3.常温时,将pH=10的NaOH溶液与pH=12的NaOH溶液以1:
2体积比混合,混合后的pH最接近于()
A.10.5B.11.8C.10.8D.11
4、(01全国)将pH==1的盐酸平均分成2份,1份加适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为()
A.9B.10C.11D.12
5、(08年全国理综Ⅱ·
9)取浓度相同的NaOH和HCl溶液,以3:
2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为()
A.0.01mol·
L-1B.0.017mol·
L-1C.005mol·
L-1D.0.50mol·
6、(08年天津理综·
9)醋酸溶液中存在电离平衡CH3COOH
H++CH3COO-,下列叙述不正确的是()
A.醋酸溶液中离子浓度的关系满足:
c(H+)=c(OH-)+c(CH3COO-)
B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
7、(08年江苏化学·
12)下列溶液中有关物质的量浓度关系正确的是()
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:
c(H+)+c(M+)==c(OH-)+c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-)+2c(OH-)==2c(H+)+c(CH3COOH)
D.0.1mol·
L-1的NaHA溶液,其pH=4:
c(HA-)>c(H+)>c(H2A)>c(A2-)
8、(07年高考海南化学卷·
3)下列叙述正确的是()
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.0.2mol·
L-1的盐酸,与等体积水混合后pH=1
D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7
9、(07年高考上海化学卷·
13)下列关于盐酸与醋酸两种稀溶液的说法正确的是()
A.相同浓度的两溶液中c(H+)相同
B.100mL0.1mol/L的两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液稀释100倍,pH都为5
D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小
10、.(07年高考全国理综卷
·
7)室温时,下列混合溶液的pH一定小于7的是()
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合
11、(07年高考全国理综卷
7)0.1mol/LNaHCO3溶液的pH最接近于()
A.5.6B.7.0C.8.4D.13.0
12.(07年高考理综山东卷·
10)物质的量浓度相同时,下列既能跟NaOH溶液反应、又能跟盐酸溶液反应的溶液中,pH最大的是()
A.Na2CO3溶液B.NH4HCO3溶液C.NaHCO3溶液D.NaHSO4溶液
13、(07年高考理综四川卷·
11)在25℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是()
A.c(Na+)=c(CH3COO-)+c(CH3COOH)B.c(H+)=c(CH3COO-)+c(OH-)
C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
14.(07年高考理综天津卷·
10)草酸是二元中弱酸,草酸氢钠溶液显酸性。
常温下,向10mL
0.01mol·
L-1NaHC2O4溶液中滴加0.01mol·
L-1NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是()
A.V(NaOH)=0时,c(H+)=1×
10-2mol·
B.V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-)
C.V(NaOH)=10mL时,c(H+)=1×
10-7mol·
D.V(NaOH)>10mL时,c(Na+)>c(C2O42-)>c(HC2O4-)
15.现有25℃时0.1mol·
L-1的氨水。
请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中
______(填“增大”“减小”或“不变”)。
(2)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH
)=amol·
L-1,则c(SO
)=______________。
(3)为了证明一水合氨(NH3·
H2O)是弱电解质,常温下,甲、乙、丙三人分别选用下列试剂进行实验:
0.010mol·
L-1氨水、0.1mol·
L-1NH4Cl溶液、NH4Cl晶体、酚酞试剂、pH试纸、蒸馏水。
①甲用pH试纸测出0.010mol·
L-1氨水的pH为10,则认定一水合氨是弱电解质,你认为这一方法是否正确?
______(填“是”或“否”),并说明理由____________________________。
②乙取出10mL0.010mol·
L-1氨水,用pH试纸测出其pH=a,然后用蒸馏水稀释至1000mL,再用pH试纸测出其pH为b,若要确认NH3·
H2O是弱电解质,则a、b值应满足的关系______________(用等式或不等式表示)。
1、AC2、AD3、B4、C5、C6、B7、AC8、C
9、B10、C11、C12、C13、D14、D
15、
(1)减小
(2)a/2mol·
L-1 (3)①是 若是强电解质,则0.010mol·
L-1氨水溶液中c(OH-)应为0.010mol·
L-1,pH=12 ②a-2<b<a
中和滴定(3)
1.下图曲线a
和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是( )
A.盐酸的物质的量浓度为1mol/LB.P点时反应恰好完全,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠的滴定曲线D.酚酞不能用作本实验的指示剂
2.常温下,某溶液中由水电离的c(H+)=1×
10-13mol·
L-1,该溶液可能是①二氧化硫水溶液 ②氯化铵水溶液 ③硝酸钠水溶液④氢氧化钠水溶液
A.①④B.①②C.②③D.③④
3.室温下,甲溶液中水电离出的H+浓度为10-12mol·
L-1,乙溶液中水电离出的H+浓度为10-2mol·
L-1,下列说法中正确的是( )(关注溶液中离子反应练习1第11题)
A.甲、乙两溶液的pH不可能相同B.甲、乙两种溶液中加入Al粉都会产生H2
C.HCO
不可能在甲、乙两溶液中大量共存D.甲不可能是盐溶液,乙不可能是酸或碱溶液
4.用标准的KOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是( )
A.配制标准溶液的固体KOH中混有NaOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
5.实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
6.量取25.00mL,KMnO4溶液可选用仪器()
A.50mL量筒B.100mL量筒C.50mL酸式滴定管D.50mL碱式滴定管
7.50ml的滴定管盛有溶液,液面恰好在20.00处,若把滴定管中溶液全部排出,则体积
A、等于30B、等于20C、大于30D、小于30
8、某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶
液时,选择甲基橙作指示剂。
请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_______________。
直到因加入一滴盐酸后,溶液由黄色变为橙色,并_______________为止。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________
(A)酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
(B)滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
(C)酸式滴定管在滴定前有气泡,滴定后气泡消失
(D)读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:
则起始读数为______mL,终点读数为______mL;
用盐酸溶液的体积为_______mL。
⑷某学生根据三次实验分别记录有关数据如下表:
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:
c(NaOH)=
9、实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH
+6HCHO===3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。
某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500g。
步骤Ⅱ 将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。
按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”、“偏小”或“无影响”)。
③滴定达到终点时,酚酞指示剂由______________色变成____________色。
(2)滴定结果如下表所示:
滴定
次数
待测溶液的体积/mL
标准溶液的体积
滴定前刻度/mL
滴定后刻度/mL
1
25.00
1.02
21.03
2
2.00
21.99
3
0.20
20.20
若NaOH标准溶液的浓度为0.1010mol/L,则该样品中氮的质量分数为________。
1-7:
BACACCC
8、
(1)锥形瓶内溶液颜色的变化;
30s内不恢复
(2)D
(3)0;
26.10;
26.10
(4)0.1044mol/L
9、
(1)①偏高 ②无影响 ③ 无色变浅红色
(2)18.85%
盐类水解(4)
1.下面提到的问题中,与盐的水解无关的是( )
①明矾和FeCl3可作净水剂.
②为保存FeCl3溶液,要在溶液中加少量盐酸.
③实验室配制AlCl3溶液时,应先把它溶在盐酸中,而后加水稀释.
④NH4Cl与ZnCl2溶液可作焊接中的除锈剂.
⑤实验室盛Na2CO3、Na2SiO3等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞.
⑥用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂.
⑦在NH4Cl或AlCl3溶液中加入金属镁会产生氢气.
⑧长期使用硫铵,土壤酸性增强;
草木灰与铵态氮肥不能混合施用.
⑨比较NH4Cl和Na2S等溶液中离子浓度的大小或某些盐溶液的酸碱性.
A.①④⑦B.②⑤⑧C.③⑥⑨D.全有关.
2.NH4Cl溶于重水中,反应生成的一水合氨和水合氢离子均正确的是( )
A.NH2D·
H2O和D3O+B.NH3·
D2O和HD2O+
C.NH3·
HDO和D3O+D.NH2D·
H2O和H2DO+
3.下列离子方程式中,属于水解反应的是()
A.HCOOH+H2O
HCOO-+H3O+ B.CO2+H2O
HCO3-+H+
C.CO32-+H2O
HCO3-+OH- D.HS-+H2O
S2-+H3O+
4.下列水解离子方程式正确的是( )
①Na2CO3:
CO32-+2H2O
H2CO3+2OH-
②NH4Cl:
NH4++H2O
NH3·
H2O+OH-
③NaF:
F-+H2O===HF+OH-
④CuSO4:
Cu2++2H2O
Cu(OH)2+2H+
⑤NaHCO3:
HCO3-+H2O
H3O++CO32-
⑥Na2SO3:
SO32-+H2O
HSO3-+OH-
A.①②③B.④⑤⑥C.④⑥D.②④⑥
5.常温下pH为4的FeCl3溶液和pH为10的K2CO3溶液中,由水电离的c(H+)分别为a1和a2,则它们的大小关系是( )
A.a1>a2B.a1<a2C.a1=a2D.无法判断
6.为使Na2S溶液中c(Na+)/c(S2-)的值减小,可加入的物质是( )
A.盐酸B.适量的NaOH溶液
C.适量的KOH溶液D.适量的CH3COONa溶液
7.向三份0.1mol·
L-1CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为( )
A.减小、增大、减小B.增大、减小、减小
C.减小、增大、增大D.增大、减小、增大
8.25℃时,1mol/L的NH4Cl、CH3COONH4、NH4HSO4三种溶液中,测得c(NH
)分别为a、b、c(单位为mol/L),下列判断正确的是( )
A.a=b=cB.a>b>cC.a>c>bD.c>a>b
9.下列有关pH变化的判断中,正确的是()
A.随着温度的升高,碳酸钠溶液的pH减小
B.随着温度的升高,纯水的pH增大
C.新制氯水经光照一段时间后,pH减小
D.氢氧化钠溶液久置于空气中,pH增大
10.物质的量浓度相同时,下列既能跟NaOH溶液反应,又能跟盐酸反应的溶液中,pH最大的是A.Na2CO3溶液B.(NH4)2S溶液
C.NaHCO3溶液D.NaHSO4溶液
11.相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则下列关于同温、同体积、同浓度的HCN和HClO溶液的说法中正确的是( )
A.酸的强弱:
HCN>
HClO
B.pH:
HClO>
HCN
C.与NaOH恰好完全反应时,消耗NaOH的物质的量:
D.酸根离子浓度:
c(CN-)<
c(ClO-)
12.将物质的量浓度相同的NaHCO3和NaHSO3两种溶液(前者呈碱性,后者呈酸性)比较时,下列关系中正确的是( )
A.[
]=[
]B.[
]
C.[Na+]相等D.水的电离度相等
13.四种水溶液①HCl,②FeCl3,③KOH,④Na2CO3其pH值依次为4、4、10、10,而溶液中水的电离度依次为α1、α2、α3、α4,则它们的关系正确的是
A.α1=α2=α3=α4B.α1>α3>α2>α4C.α4=α2>α3=α1D.α1=α3>α2=α4
14、在纯碱溶液中滴入酚酞,溶液变红色,若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是___________________________________________________________,
其原因是___________________________________________________________________
________________________________________________________________________。
15、溶液蒸干、灼烧后产物的判断
⑴AlCl3溶液蒸干后灼烧产物是______,结合化学方程式解释原因:
__________________
______________________________________________________________________________
⑵Al2(SO4)3溶液蒸干后产物是__________,结合化学方程式解释原因:
________________
__________________________________