高中化学实验检测题文档格式.docx
《高中化学实验检测题文档格式.docx》由会员分享,可在线阅读,更多相关《高中化学实验检测题文档格式.docx(16页珍藏版)》请在冰豆网上搜索。
小伍
小义
实验操作
硝酸
液体内铁丝变红
产生白色沉淀
____________
含有_________元素
白色沉淀是______
“蓝色水”中溶质的化学式是_________
试写出上面三位同学所设计实验中所发生的反应的化学方程式①
②③
[作出评价]由此可见,如果到游泳场中游泳后,应该及时去冲冼。
从这三位同学的实验过程中,你认为进行科学探究须具备__________________________________________精神。
4.已知多种金属或它们的化合物在灼烧时,会使火焰呈现特殊的颜色,化学上叫焰色反应;
已知:
钾—紫色,钠—黄色,钙—砖红色,钡—黄绿色,铜—绿色。
现将A、B两种化合物的溶液混合后进行下图所示实验(反应均恰好完全):
试回答:
⑴E的化学式
⑵A、B、C、D化学式分别为、、、
5.用下图提供的装置与试剂,组装一套用CO还原CuO的实验装置,并回答问题。
⑴实验时气体按图示从左向右移动,则这套装置的连接顺序是(填接口处字母):
CO→□→□→□
⑵B中发生反应的化学方程式为
。
⑶实验后怎样处理气球中的尾气
,发生反应的化学方程式为
⑷贮存在装置C中的CO是先在贮气瓶中注满水,然后用排水法通入收集的。
收集时,应从接口
(填“d”或“e”)处进气;
使用CO气体进行实验时,可将水重新注入装置C中而将CO气体排出,此时水应从接口
(填“d”或“e”)流入。
6.实验室常用石蕊试纸检验物质的酸碱性;
酸性物质使蓝色的石蕊试纸变红,碱性物质使红色的石蕊试纸变蓝。
某学生想要通过碳酸氢铵分解产生的氨气来探究氨水具有碱性,而氨气不具有碱性,按下图所示进行实验:
请按要求回答下列问题:
①向A烧杯中加浓硫酸的作用是
,B管的作用是
。
②若氨气不具有碱性,则C瓶中石蕊试纸(填:
变蓝色、不变色下同)
,氨水具有碱性,则D瓶中石蕊试纸
③E烧杯中稀硫酸的作用是
7.2005年10月5日,瑞典皇家科学院将本年度诺贝尔化学奖授予法国化学家伊夫·
肖万、美国化学家罗伯特·
格拉布和理查德·
施罗克,以表彰他们在烯烃复分解反应研究领域作出的贡献。
烯烃复分解反应是有机化学中最重要也是最有用的反应之一,烯烃复分解反应已被广泛应用在化学工业,尤其是制药业和塑料工业从中受益无穷。
早在1970年,法国化学家伊夫·
肖万就已经详细地从理论上解释了烯烃复分解反应是如何进行的,并且列举了促进这种反应的催化剂的物质成分。
1990年,肖万的理论第一次被理查德·
施罗克应用在实践中并制造出效果优良的催化剂,两年后,罗伯特·
格拉布又发展了施罗克的成果,制造出在空气中更稳定的催化剂。
在颁奖仪式上,评委会主席佩尔·
阿尔伯格将烯烃复分解反应描述为“交换舞伴的舞蹈”。
他亲自走出讲台,邀请身边的皇家科学院教授和两位女工作人员一起在会场中央为大家表演烯烃复分解反应的含义。
最初两位男士是一对舞伴,两位女士是一对舞伴,在“加催化剂”的喊声中,他们交叉换位,转换为两对男女舞伴,在场记者随即发出了笑声。
(1)催化剂在化工生产过程中有着重要作用,有的反应如果没有催化剂就不能进行,大多数化工生产都有催化剂的参与。
CuSO4溶液对过氧化氢的分解具有催化作用。
有同学猜想其他盐溶液也能在这个反应中起同样的作用,于是他们做了以下的探究。
①请你帮助他们完成实验报告:
实验过程
在一支试管中加入5ml5%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管。
FeCl3溶液可以催化分解H2O2
②已知FeCl3在水中可解离出Fe3+和Cl-,同学们提出以下猜想:
甲同学的猜想是:
真正催化分解H2O2的是FeCl3溶液中的H2O;
乙同学的猜想是:
真正催化分解H2O2的是FeCl3溶液中的Fe3+;
丙同学的猜想是:
真正催化分解H2O2的是FeCl3溶液中的Cl-。
你认为最不可能的是同学的猜想,理由是。
③同学们对余下的两个猜想,用实验进行了探究。
请你仔细分析后填表:
结论
向盛有5ml5%的H2O2溶液的试管中加入少量
的HCl,并把带火星的木条伸入试管。
无明显现象
的,并把带火星的木条伸入试管。
(2)复分解反应是我们学过的化学基本反应类型之一。
①下列化学反应中,属于复分解反应的是()
②科学家将复分解反应描述为“交换舞伴的舞蹈”,并表演了其含义。
我们也可以用符号表达式来表示复分解反应,请补全下式:
AB+CD→。
③你想过复分解反应为什么能够发生吗?
这是因为在这些反应物中含有一些“特殊”的阴、阳离子,它们能相互结合。
如反应BaCl2+Na2SO4=BaSO4↓+2NaCl中,实际参加反应的离子是Ba2+和SO42-,而Cl-、Na+则是“旁观者”,并没有参加反应。
请你分析反应Ba(OH)2+2HNO3=Ba(NO3)2+2H2O中实际参加反应的离子是。
④请根据你的想象,在下图右边的容器中画出体现NaOH溶液和稀HCl反应产物的示意图。
(3)从三位科学家取得成功的事例中,你对科学的发明、发现或创造有什么认识?
8.某校化学兴趣小组对一种工业废水溶液按下列步骤进行实验(假设能发生的反应均恰好完全反应):
根据以上事实,用化学式回答:
(1)当废水溶液中仅含有一种溶质时,该溶质是__________;
(2)当废水溶液中含有多种溶质时,除
(1)中溶质外,还可能存在的盐是_________、_________、__________,以及其它可能存在的溶质是_________、________。
9.
(1)根据初中化学知识,硫酸铜溶液与氢氧化钠溶液反应可得到蓝色沉淀,进一步将沉淀加热可生成黑色物质,请写出有关反应的化学方程式:
①_______________________________,②________________________________。
(2)小明做了这个实验。
他在试管中倒入2mLCuSO4溶液,再加入一定量NaOH溶液,结果得到的沉淀并不是蓝色的,而是浅绿色的;
将此浊液加热直至沸腾,观察不到有分解变黑生成CuO的迹象。
这是为什么呢?
小明通过查找资料得知,该浅绿色沉淀物可能是溶解度极小的碱式硫酸铜,其化学式为Cu4(OH)6SO4
①请帮小明写出生成浅绿色沉淀的有关反应的化学方程式:
________________________
②请帮小明设计一个实验,证明该浅绿色沉淀中含有硫酸根。
_______________________
________________________________________________________________________。
10.某课外小组查阅到:
“过氧化钠(Na2O2)是种淡黄色粉末,它能和二氧化碳发生反应.同时放出大量热量”。
于是他们设计了以下三个探究实验:
【实验l】用嘴通过玻璃管对着包有过氧化钠粉末的棉花吹气,发现棉花剧烈燃烧,燃烧后的灰烬溶于水,加入盐酸会产生能使澄清石灰水变浑浊的气体。
据此推断过氧化钠和二氧化碳两种物质反应的化学方程式为。
【实验2】按图甲所示完成装置连接(装置气密性良好)。
A中装入稀盐酸和大理石,则B装置的作用是;
反应一段时间后(此时样品仍呈淡黄色),将带火星的木条伸入E中收集到的气体,发现木条马上熄灭。
于是他们对此展开争论:
甲认为可能是二氧化碳过量,E中收集到的气体中含有大量二氧化碳;
乙认为是二氧化碳被干燥后根本不能和过氧化钠反应,E中收集到的气体全部是二氧化碳。
则观点是正确的,为了证实这个观点,此时可以采取的简便验证方法是 。
【实验3】在证实上述观点后,他们又设计了一个实验,装置如图乙。
将一团包有过氧化钠粉末的棉花塞在漏斗管中,下方点燃一支短蜡烛(蜡烛火焰与棉花不接触),则棉花会燃烧起来吗?
并简要说明理由。
11.某学生为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已略去),实验在常温、101kPa下进行,实验步骤如下:
①按图连接好装置;
②用托盘天平准确称取氢氧化钠样品2g,放入A中试管内,
向B中集气瓶内倒入饱和CO2水溶液至瓶颈处;
③向分液漏斗中倒入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞。
反应结束后,量筒中收集到CO2水溶液220mL。
请回答下列问题:
(1)判断氢氧化钠发生变质的实验现象是________________
(2)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是_______。
(3)B中集气瓶盛装的饱和CO2水溶液不能用水代替,其理由是_________________。
(4)判断实验步骤③中滴入的稀硫酸已过量的标志是_________________________。
(5)氢氧化钠样品中碳酸钠的质量分数为_____________(在常温、101kPa下CO2的密度为1.8g/L;
CO2的体积等于排出的CO2水溶液的体积)。
(6)用上述装置不能测定已部分变质的氢氧化钠样品中氢氧化钠的质量分数,理由是
12.某同学研究在化学反应前后物质质量变化关系问题时,设计了如右图所示的两个试验。
(1)为了探究化学反应前后物质质量变化关系,请你提出二点假设:
①
②
(2)实验验证:
①将实验1装置放在托盘天平上称量,纪录数据后取下。
挤压胶头滴管,观察到的现象是(醋酸跟草木灰反应原理为:
K2CO3+2CH3COOH=2CH3COOK+CO2↑+H2O)
实验完毕,再进行称量,记录数据。
②将实验2装置放在托盘天平上称量,纪录数据后取下。
将两种溶液混合,观察到的现象是,实验完毕,再进行称量,纪录数据。
比较两次实验数据得出结论。
(3)实验结论:
(4)实验分析:
用分子、原子的观点对结论进行解释
13.某校化学兴趣小组的同学在甲实验室中进行了氧气分别与碳、硫、铁反应的实验后,为了解该实验产生的气体对空气成分造成的影响,接着设计了如下实验装置进行实验(图中多孔球泡的作用是:
增大气体与溶液的接触面积,使反应充分进行)。
(1)实验在没有受污染的乙实验室中进行,取出适量甲实验室中空气样品的方法是
(2)将取得的空气样品按上图所示的装置进行实验测定:
装置A的作用是,其中发生反应的化学方程式为。
装置B中的现象是;
装置C的作用是。
(3)若通入空气样品100mL,实验结束后,量筒中液体的体积为99mL(导管内液体忽略不计),说明装置中吸收了1mL气体。
若这些气体大量排放到空气中,因产生,会对环境造成不利影响。
(4)请写出你在做化学实验时,减少实验对环境污染的一种做法。
14.在学校的元旦联欢会上,某同学表演了“水能生火”的魔术。
他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来。
小明很感兴趣,于是,他和同学们进行探究。
【提出问题】过氧化钠与水反应生成了什么物质?
为什么脱脂棉会燃烧?
【猜想】①可能有一种气体和另一种物质生成
②反应过程中可能有能量变化
【设计装置】如右图所示
【实验探究】
实验一:
探究反应后生成的气体是什么?
(1)打开右图装置中分液漏斗的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃。
说明生成的气体是。
(2)实验中,还观察到伸入烧杯中的导管口有气泡冒出,请解释产生该现象的原因:
实验二:
继续探究反应后生成的另一种物质是什么?
(1)小张猜想另一种物质是Na2CO3,小明认为不可能。
小明的依据是______________
为了证实小明的看法,请你设计一个证明Na2CO3不存在的实验。
(2)小明取反应后所得的溶液于试管中,滴入无色酚酞试液,发现酚酞试液变红色,说明反应后所得的溶液呈性。
【表达】由实验探究的结果,写出过氧化钠和水反应的化学方程式
15.某化学兴趣小组在做Fe和CuSO4溶液反应实验时,发现生成Cu的同时有气泡产生。
为了进一步研究做了如下实验:
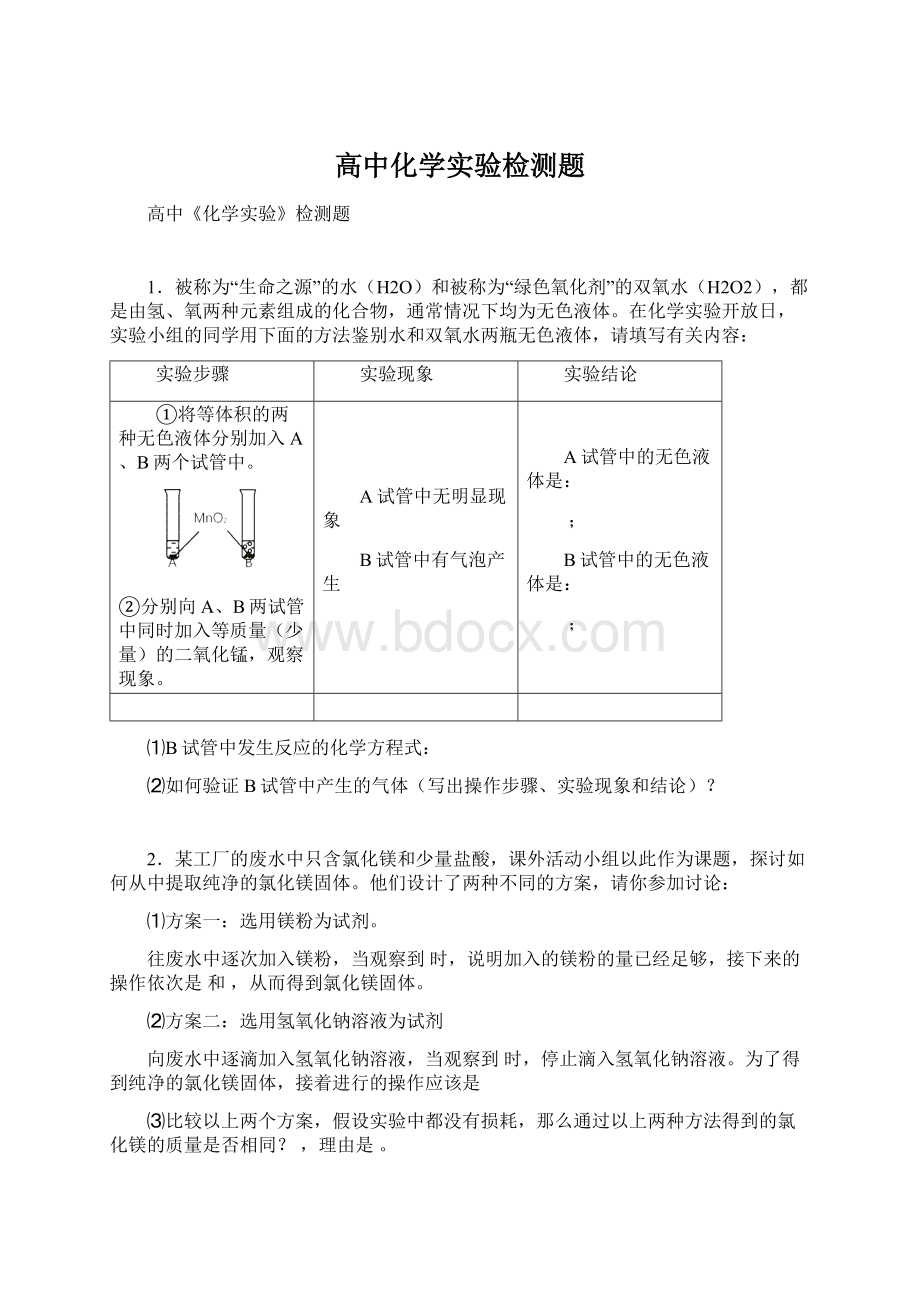
①取8.5gFe粉放入一定量的CuSO4溶液中,反应完成后,滤出固体,洗涤、干燥后称量,固体质量为9.2g。
0.0642
0.0842
0.10
0.042
0.02
012345
氢
气
的
质量
g
时间min
②将9.2g固体与一定质量分数的稀盐酸充分反应,消耗盐酸50.0g,根据实验绘制反应产生氢气的质量与反应时间的关系图(见右图)。
求:
(1)稀盐酸的质量分数,与稀盐酸反应的Fe的质量。
(2)与CuSO4反应的Fe的质量。
(3)与CuSO4反应的Fe的质量及与盐酸反应的Fe的质量之和__________8.5g(选填“>”、“<”、“=”)。
对此结果作出你的解释。
16.小明对妈妈杀鱼时从鱼肚内取出的鳔(见图)产生了兴趣。
他拟定“探究鳔内气体体积和成分”作为研究性学习的课题。
小明通过查阅有关资料获知:
这种鱼鳔内氧气约占四分之一
其余主要为二氧化碳和氮气。
探究分两步进行。
(1)测量鳔内气体的体积。
小明设计了两种方法。
A:
用医用注射器抽取鳔内气体,测量其体积。
B:
在水下刺破鳔,用排水集气法收集鳔内气体并测量其体积(如图)。
你认为其中测量结果不准确的一种方法是,理由是。
与理由有关的化学方程式是。
(2)探究鳔内气体的成分。
现有两集气瓶的鳔内气体,请你帮助小明设计实验进行验证。
实验目的
实验方法
验证鳔内含O2
验证鳔内含CO2
17.三农问题是政府和社会关注的问题,化肥是土地的营养品。
某农资商店出售一种化肥,其有效成分为氯化铵,现欲测定该种化肥中氮元素的质量分数,设计实验步骤如下(杂质中不含氮元素,且杂质均不与盐酸或氢氧化钠溶液反应):
①配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
②每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③加入30.00mL1.00mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④……………………;
⑤重复②③④步操作1-2次;
⑥记录整理实验所得数据,计算该化肥中氮元素的质量分数。
(1)写出步骤④中的实验内容,写出实验步骤④中的离子方程式:
(2)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的是()
A.玻璃棒B.托盘天平C.烧杯D.漏斗
(3)步骤⑤的实验目的是。
(4)配制本实验所需的1.00mol/L的盐酸和1.00mol/L的NaOH溶液从节约化学药品的角度出发,最好应选用的容量瓶规格分别为(填字母选项)。
A.50mL,50mLB.150mL,100mLC.100mL,150mLD.250mL,500mL
(5)若以Vx(mL)表示实验所测定消耗盐酸数据的平均值,该化肥样品中氮元素的质量分数计算表达式为。
(不需要化简)
18.⑴高中教材中有这样一个实验:
在两支试管中分别加入3mL稀盐酸,将两个分别装有0.3gNaHCO3、0.3gNa2CO3粉末的小气球分别套在两支试管口。
将气球内的NaHCO3、Na2CO3同时倒入试管中,观察到现象如下:
①试管中(填产生沉淀或气体及反应速率等相关现象)
______________________________________________________
②两试管中气球大小(包含试管)体积之比约为(填最简单整数比)(盐酸均足量)_________;
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高。
由此他得出:
不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。
类似如中和热,甲同学写出了下列热化学方程式(其中“aq”代表水合或无限稀释的含义):
HCO3-(aq)+H+(aq)=H2O(l)+CO2(g);
△H>
CO32-(aq)+2H+(aq)=H2O(l)+CO2(g);
△H<
甲下结论的方法是否正确____________(填正确或不正确)
⑵为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
序号
试剂1
试剂2
混合前温度
混合后最高或最低温度
50mL水
2.5gNaHCO3固体
20℃
18.5℃
3.2gNa2CO3固体
23.0℃
35mL稀盐酸
含2.5gNaHCO3的饱和溶液15mL
18.8℃
含3.2gNa2CO3的饱和溶液15ml水
20.6℃
50mL稀盐酸
2.5gNaHCO3固体
17.4℃
23.5℃
请你帮助填写相关内容:
①该研究报告的题目是《________________________________________________》;
②该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为_________和__________;
通过上述实验可得出多条结论,如:
a:
NaHCO3的溶解是_______(吸热或放热)过程;
b:
Na2CO3的饱和溶液和盐酸的反应是____________(吸热或放热)反应;
c:
NaHCO3固体与稀盐酸反应的反应热约是______的热效应之和。
参考答案及评分标准
1.H2O;
H2O2(写化学式或名称都给分)
(1)2H2O2
2H2O+O2↑
(2)用带火星的木条放在试管口,若木条复燃,则证明产生的气体是氧气
2.
(1)加入镁粉不再产生气泡过滤蒸发结晶
(2)白色沉淀不再增加过滤后取滤渣加适量盐酸溶解,然后蒸发结晶
(3)不同因为在方案一中镁与盐酸反应会生成部分氯化镁,所以方案一比方案二中得到的氯化镁多一些
(4)MgO(或Mg(OH)2或MgCO3等)MgO+2HCl=MgCl2+H2O
3.产生兰色沉淀铜硫酸钡硫酸铜实事求是、不怕困难
4.①CO2②BaCl2、Na2CO3、BaCO3、NaCl
5.bca(cba)CuO+CO=Cu+CO2燃烧掉2CO+O2=2CO2ed
6.放热使NH4HCO3分解除去CO2和H2O不变色变蓝色吸收氨气,防止氨气污染空气
7.
(1)①试管中有大量的气泡产生,带火星的木条复燃②甲因过氧化氢溶液中自身有水,可见水不是催化剂③
起催化作用的不是Cl-
Fe(NO3)3溶液
(或Fe2(SO4)3溶液)
试管中有大量气泡产生,带火星的木条复燃
起催化作用的是Fe3+
(2)①D②AD+CB③OH-、H+④见右图
(3)科学理论只有同工业结合,创造出改变人类生活、提高生命质量的发明和创造后,才能是有利于人类的科学理论(或科学探究要有合作精神等等)
8.
(1)FeCl3;
(2)Fe(NO3)3;
NaCl;
NaNO3;
HNO3;
HCl
9.
(1)CuSO4+2NaOH==Na2SO4+Cu(OH)2↓;
Cu(OH)2
CuO+H2O
(2)4CuSO4+6NaOH==Cu4(OH)6SO4↓+3Na2SO4;
过滤洗涤后,用稀盐酸溶解后加入BaCl2溶液,产生白色沉淀
10.2Na2O2+2CO2==2Na2CO3+O2;
除去CO2气体中的HCl气体;
乙;
去掉C装置做对比实验(或将干燥的CO2气体通入包有Na2O2粉末的棉花,其他合理答案均可);
会,石蜡燃烧后生成CO2和水蒸气,放出的热量使气体沿漏斗管上升
11.
(1)试管中产生气泡;
(2)检查装置的气密性;
(3)CO2能溶于水;
(4)试管中不再产生气泡;
(5)47.7%;
(6)不能确定该样品中水的质量
12.
(1)实验1反应前后质量会发生变化(或增大、减小)(不变化也正确)实验2反应前后质量不会发生变化(发生变化也正确)
(2)①有气泡产生,石灰水变浑浊②有蓝色沉淀生成
(3)反应前后,各物质的总质量没有发生变化
(4)在化学反应前后,元素的种类、原子的个数都没有发生变化(或原子是化学变化中的最小粒子)
13.
(1)用注射器抽取(或用集气瓶装满水后在室内将水倒出,擦干,瓶口向上,盖上玻璃片、使用气囊收集等)
(2)吸收气体样品中的二氧化碳和二氧化硫;
2NaOH+CO2=Na2CO3+H2O;
2NaOH+SO2=Na2SO3+H2O水沿着导管进人C中(或水位下降);
测量二氧化碳和二氧化硫被吸收后剩余气体的粗略体积(3)A;
酸雨和温室效应(4)控制