安徽自主招生化学模拟试题电解原理Word文档下载推荐.docx
《安徽自主招生化学模拟试题电解原理Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《安徽自主招生化学模拟试题电解原理Word文档下载推荐.docx(15页珍藏版)》请在冰豆网上搜索。
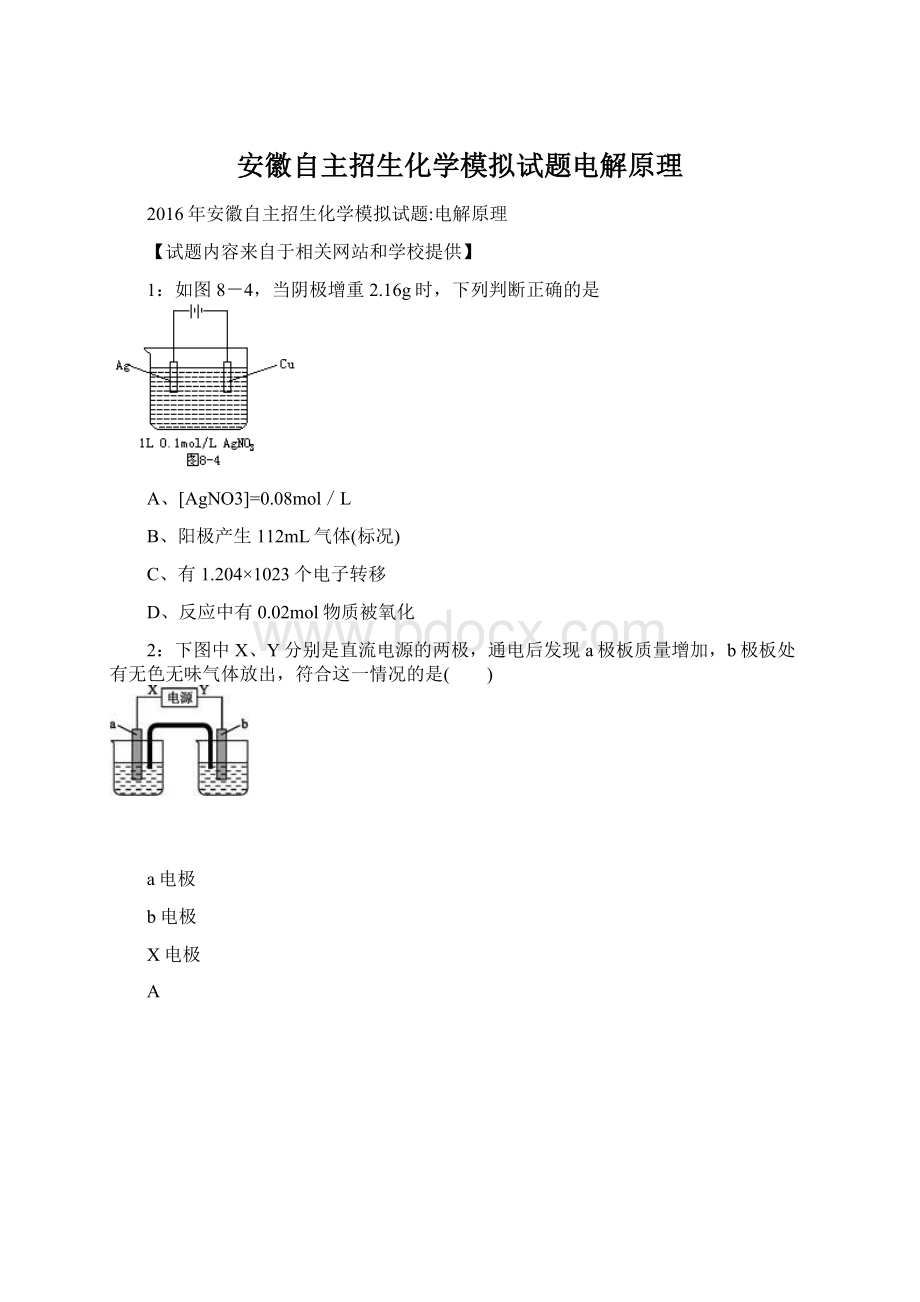
A、电解饱和食盐水时,阳极的电极反应式为:
2Cl--2e-= Cl2↑
B、氢氧燃料电池的负极反应式:
O2+2H2O+4e-="
="
4OH-
C、粗铜精炼时,与电源正极相连的是纯铜
D、钢铁发生电化腐蚀的正极反应式:
Fe-2e-="
Fe2+
5:
下图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,上层溶液为盐溶液,呈中性。
请根据图示判断下列有关说法不正确的是(
)
A、甲池是原电池、乙池是电解池
B、通入乙醇的惰性电极的电极反应式为:
C2H5OH+16OH--12e-=2CO32-+11H2O
C、反应一段时间后,两池溶液的pH均未变化
D、假如乙池中加入NaI溶液,则在乙池反应过程中,可以观察到C电极周围的溶液呈现棕黄色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色
6:
塑料电镀是近几十年来发展起来的表面处理新技术,广泛用于电子、家用电器、汽车、建筑等工业。
它先是在塑料、陶瓷等非金属表面采用化学沉积的方法沉积出一层金属层,再用电解的方法镀上铜层,电解液为CuSO4水溶液。
(1)请写出电解时,阴极上可能发生的反应:
①______________________________________;
②___________________________________。
(2)设通过268mA的电流60min后,阴极上沉积出铜0.2879g,阴极上还可能放出的气体是;
该气体在标准状况下的体积是。
7:
锂的化合物用途广泛。
Li3N是非常有前途的储氢材料;
LiFePO4、Li2FeSiO4等可以作为电池的正级材料。
回答下列问题:
(1)将锂在纯氮气中燃烧可制得Li3N,其反应的化学方程为
。
(2)氮化锂在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:
Li3N+2H2
LiNH2+2LiH,氧化产物为
(填化学式)。
在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的
%(精确到0.1)。
(3)将Li2CO3、FeC2O4·
2H2O和SiO2粉末均匀混合,在800℃的氩气中烧结6小时制得Li2FeSiO4,写出反应的化学方程式
,制备Li2FeSiO4的过程必须在惰性气体氛围中进行,其原因是
(4)将一定浓度磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出LiFePO4沉淀,阳极的电极反应式为
(5)磷酸亚铁锂电池充放电过程中,发生LiFePO4与Li
FePO4之间的转化,电池放电时负极发生的反应为LiXC6-Xe—
XLi++6C,写出电池放电时的电极反应的化学方程式
8:
(11分)甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是________________________________________________。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式__________________________________________。
②甲池中碳极上电极反应式是____________________,乙池中碳极上电极反应属于____________(填“氧化反应”或“还原反应”)。
③若乙池转移0.02mole-后停止实验,该池中溶液体积是200mL,则溶液混匀后的pH=________。
9:
熔融盐燃料电池具有较高的发电效率,因而受到重视。
某燃料电池以熔融的K2CO3(其不含O2-和HCO
)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。
该燃料电池负极电极反应式为:
2C4H10+26CO
-52e-=34CO2+10H2O。
试回答下列问题:
(1)该燃料电池的化学反应方程式为________________________________________________;
(2)正极电极反应式为_________________________________________。
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。
为此,必须在通入的空气中加入一种物质,加入的物质是________,它来自________________________________。
(4)某学生想用该燃料电池和如图所示装置来电解饱和食盐水:
①写出该电解池反应的离子方程式_______________________________________。
②将湿润的淀粉KI试纸放在该装置附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。
若反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸。
该反应的化学方程式为___________________________________________________________。
③若电解后得到200mL3.25mol/LNaOH溶液,则消耗C4H10的体积在标准状况下为________mL。
10:
课题式研究性学习是培养学生创造性思维的良好方法,某研究性学习小组将下列装置如图链接,C、D、E、F、X、Y都是惰性电极。
将电源接通后,向乙中滴入酚酞试液,在F极附件先显红色。
(1)电源A极的名称是
(2)甲装置中电解反应的总化学方程式:
(3)如果收集乙装置中产生的气体,相同状况下两种气体的体积比是
(4)欲用丙装置给铜镀银,G应该是
(填“铜”或“银”),电镀液的溶质是
(5)装置丁中的现象是
11:
(12分)D、A、B、C为四种原子序数依次增大的短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;
B、D同主族。
已知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质。
(1)C元素在周期表中的位置
周期
族。
(2)A、B元素形成的常见化合物水溶液显
性,原因是(用离子方程式表示)
用石墨做电极电解该化合物的水溶液,则阴极反应式为
,
(3)A、D元素可以形成化合物A2D2,写出A2D2与CO2反应的化学方程式
(用元素符号表示)。
该反应中还原剂是
(4)B元素的单质在不同的条件下可以与O2发生一系列反应:
①B(s)+O2(g)=BO2(g);
△H=-296.8kJ/mol②2BO2(g)+O2(g)
2BO3(g);
△H=-196.6kJ/mol
则1molBO3(g)若完全分解成B(s),反应过程中的热效应为
12:
(18分)废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法回收WC和制备CoxOy,的工艺流程简图如下:
(1)电解时废旧刀具作阳极,不锈钢作阴极,盐酸的作用是______。
(2)通人氨气的目的是调节溶液的pH,除去铁元素。
由表中的数据可知,理论上可选择pH最大范围是____________。
(3)实验测得NH4HCO3溶液显碱性,制备CoCO3时,选用的加料方式是_______(填代号),原因是_______。
a。
将滤液与NH4HCO3溶液同时加入到反应容器中
b。
将滤液缓慢加入到盛有NH4HCO3溶液的反应容器中
c。
将NH4HCO3溶液缓慢加入到盛有滤液的反应容器中
写出生成CoCO3的离子方程式______________________________________。
(4)实验中获得的若洗涤不充分,在焙烧时会产生污染性气体,该污染性气体的成分为_______________(填化学式)。
(5)实验室用下列装置制取
,并测定其化学式。
①装置A制得的中含有少量Cl2,则装置B中所盛放的试剂为______(填代号)。
NaHCO3溶液
b。
NaOH溶液
c。
KMnO4溶液
d。
饱和NaCI溶液
②在CoCO3完全转化为
后,若称得E管增重4。
40g,D管内残留物质的质量是8。
30g,则生成物
的化学式为____________。
③若缺少装置F,则导致
的值______(填“偏大”、“偏小”或“无影响”)。
13:
某同学设计了一个甲醇燃料电池,并用该电池电解200mL—定浓度NaCl与CuSO4混合溶液,其装置如图:
(1)写出甲中通入甲醇这一极的电极反应式
(2)理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式
,原混合溶液中NaCl的物质的量浓度为
mol/L,CuSO4的物质的量浓度为
mol/L。
(假设溶液体积不变)
(3)电解至t3时,消耗水的质量为
g。
14:
(7分)在25℃时,用石墨电极电解1000mL一定浓度的CuSO4溶液。
5min后电解完全,在一个石墨电极上只有1.28gCu生成。
(1)电解总离子方程式反应式为
(2)得到的溶液的pH是
(lg2=0.3)反应速率v(Cu2+):
v(O2)=
(3)在原CuSO4溶液中,如要生成Cu(OH)2沉淀,应调整溶液的PH为
(KspCu(OH)2=2×
10-20)
15:
铁是地壳中含量第二的金属元素,其单质、合金及化合物在生产生活中的应用广泛。
(―)工业废水中含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的危害,必须进行处理。
常用的处理方法是电解法,该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(1)用Fe作电极的目的是
(2)阴极附近溶液pH升高的原因是_
(用电极反应式解释);
溶液中同时生成的沉淀还有
(二)氮化铁磁粉是一种磁记录材料,利用氨气在400℃以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。
制备高纯铁粉涉及的主要生产流程如下:
已知①某赤铁矿石含60.0%Fe2O3、3.6%FeO,还含有Al2O3、MnO2、CuO等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:
(3)步骤②中加双氧水的目的是
,pH控制在3.4的作用是
,已知25℃时,Ksp[Cu(OH)2]=2.0
10-20,该温度下反应:
Cu2++2H2O
Cu(OH)2+2H+的平衡常数K=
(4)如何判断步骤③中沉淀是否洗涤干净?
(5)制备氮化铁磁粉的反应:
Fe+NH3
FexNy+H2(未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为
答案部分
1、D
此装置为电镀池:
阳极:
Ag-e=Ag+;
阴极(Cu):
Ag++e=Ag,所以阴极增重的2.16g为
个,所以C错误。
2、A
试题分析:
由a极板质量增加,知溶液中阳离子在a极板析出,则a为阴极,X为负极;
因B中a极板不析出金属,C中X为正极可否定,又由b极板有无色无味气体放出,否定D。
考点:
电解原理
3、D
左侧变蓝,说明左侧是阳极,I-在阳极放电,被氧化生成I2,因而右侧是阴极,只能是水电离的H+放电被还原生成H2,其电极反应为2H2O+
2e-=H2↑+2OH-,A项正确;
阴离子交换膜允许阴离子通过,B项正确;
电解KI的过程发生如下两个反应:
①2I-+2H2O
I2+2OH-+H2↑
②3I2+6OH-=IO3—+5I-+3H2O
①×
3+②即得总方程式,C项正确;
如果将阴离子交换膜换成阳离子交换膜,阴极产生的OH-将不能到达阳极区,I2与OH-无法反应生成IO3—,因而D项错。
4、A
A、电解饱和食盐水时,由于阴离子的放电能力:
Cl->
OH-,所以在阳极的电极反应式为:
2Cl-
-2e-= Cl2↑。
正确。
B、氢氧燃料电池的正极反应式:
4OH-。
错误。
C、粗铜精炼时,与电源正极相连的是粗铜,与电源的负极相连的是纯铜。
D、钢铁发生电化腐蚀的负极反应式:
Fe-2e-=Fe2+。
考查电化学反应原理及应用的知识。
5、C
A、根据图示可知甲池的燃料电池是原电池、乙池是电解池,正确;
B、通入乙醇的惰性电极是负极,在负极发生的电极反应式为:
C2H5OH+16OH--12e-=2CO32-+11H2O,正确;
C、反应一段时间后,甲池由于消耗NaOH。
所以溶液的pH会减小,错误;
D、假如乙池中加入NaI溶液,则在乙池反应过程中,可以观察到C电极是阳极,在阳极溶液中中的I-失去电子变为I2,所以C电极周围的溶液呈现棕黄色,由于I2容易在有机溶剂中溶解,反应完毕后,用玻璃棒搅拌溶液,则下层四氯化碳溶液呈现紫红色,上层接近无色,正确。
考查原电池、电解池的反应原理、反应现象及溶液的酸碱性的变化的知识。
6、
(1)①Cu2++2e-="
===Cu
"
②2H++2e-====H2↑
(2)H2
1.12×
10-2L
(1)得电子能力Cu2+>
H+,故阴极上可能发生的反应为:
①Cu2++2e-====Cu
②2H++2e-====H2↑
(2)n(e-)=
=1.0×
10-2mol
由
(1)知生成n(Cu)+n(H2)=n(e-)/2=5.0×
10-3mol
n(H2)=5.0×
10-3mol-
=5.0×
10-4mol,
V(H2)=5.0×
10-4mol×
22.4L·
mol-1=1.12×
10-2L。
7、
(1)6Li+N2
2Li3N
(2)LiNH2
11.4
(3)Li2CO3+FeC2O4•2H2O+SiO2
Li2FeSiO4+CO↑+CO2↑+2H2O
防止二价铁被氧化
(4)Fe+H2PO4-+Li+-2e-=LiFePO4+2H+
(5)Li1-xFePO4+LixC6=6C+LiFePO4
(1)锂与氮气在点燃条件下与氮气发生反应生成Li3N,该反应的化学方程式为:
6Li+N2
2Li3N。
(2)反应Li3N+2H2
LiNH2+2LiH中,锂元素、N元素化合价不变,氢气化合价由0变成+1价的LiNH2,化合价升高被氧化,所以氧化产物为LiNH2;
该反应中,反应掉2mol氢气,同时消耗1mol氮化锂,所以储存氢气最多可达Li3N质量的:
4/35×
100%≈11.4%。
(3)将Li2CO3、FeC2O4•2H2O和SiO2粉末均匀混合,在800℃的氩气中烧结6小时制得Li2FeSiO4,根据质量守恒、化合价升降相等可以判断,反应产物还会有一氧化碳、二氧化碳和水生成,该反应的化学方程式为:
Li2CO3+FeC2O4•2H2O+SiO2
Li2FeSiO4+CO↑+CO2↑+2H2O;
亚铁离子容易被氧化,所以该反应需要在惰性气体氛围中进行。
(4)电解池中阳极发生氧化反应,铁为阳极,所以阳极铁失去电子,与H2PO4-、Li+反应生成LiFePO4沉淀,发生的电极反应Fe+H2PO4-+Li+-2e-=LiFePO4+2H+
(5)磷酸亚铁锂电池充放电过程中,发生LiFePO4与Li1-xFePO4之间的转化,其中LiFePO4→Li1-xFePO4的转化化合价降低,发生还原反应,而电池放电时负极发生的反应为LixC6-xe-═xLi++6C,该反应为氧化反应,所以反应转化应该为:
LiFePO4→Li1-xFePO4,所以电池放电时反应的化学方程式为:
Li1-xFePO4+LixC6=6C+LiFePO4。
8、
(1)①碳;
铁;
②4OH--4e-===2H2O+O2↑;
(2)①2Cl-+2H2O通电Cl2↑+H2↑+2OH-;
②2H2O+O2+4e-===4OH- 氧化反应;
③13。
由图可知甲池是原电池,乙池是电解池;
(1)①对于甲池来说,Fe为负极,失去电子,Cu2+在碳棒上得到电子,变为单质Cu附着在上边。
所以若两池中均为CuSO4溶液,反应一段时间后碳棒上会有红色的铜单质产生;
对于乙池来说,C为阳极,Fe为阴极。
所以Cu2+在铁棒上得到电子,变为单质Cu附着在上边。
因此反应一段时间后铁棒上会有红色的铜单质产生;
②在乙池中OH-的放电能力比SO42-强,所以是OH-在阳极放电。
该电极反应式是4OH--4e-===2H2O+O2↑;
(2)若两池中均为饱和NaCl溶液,①在乙池中阳离子的放电能力是H+>
Na+,所以在阴极上H+放电;
阴离子的放电能力是Cl->
OH-,所以是Cl-在阳极上放电。
总反应的离子方程式是2Cl-+2H2O通电Cl2↑+H2↑+2OH-;
②对于甲池中来说,碳极为正极,由于是中性环境,所以发生的是吸氧腐蚀,在C棒上电极反应式是2H2O+O2+4e-===4OH-;
②乙池中碳极是阳极,所以在C棒上发生的反应是氧化反应,反应式是2Cl--2e-=Cl2↑;
③若乙池转移0.02mole-后停止实验根据反应方程式可知产生OH-的物质的量为0.02mol,由于V=0.2L,所以c(OH-)=0.1mol/L;
根据水的离子积常数可得c(H+)=10-14÷
10-1=10-13mol/L所以溶液混匀后的pH=13。
考查原电池、电解池的反应原理及应用的知识。
9、
(1)2C4H10+13O2===8CO2+10H2O
(2)13O2+26CO2+52e-===26CO
(3)CO2负极产物(其他合理答案均可)
(4)①2Cl-+2H2O
Cl2↑+H2↑+2OH-
②5Cl2+I2+6H2O===10HCl+2HIO3
③560
在燃料电池中,熔融碳酸钾环境下的电极反应式为13O2+26CO2+52e-===26CO
在该燃料电池中,二氧化碳被消耗,故应加入二氧化碳来稳定电解质的组成。
在燃料电池中,燃料作负极;
电解饱和食盐水生成氢氧化钠、氯气、氢气;
氯气可以把碘单质氧化,据反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸,由此可知5Cl2+I2+6H2O===10HCl+2HIO3;
氢氧化钠物质的量为0.2乘以3.25等于0.65mol,据得失电子总数相等可知,需要消耗0.025mol丁烷,故丁烷的体积为560mL
考查燃料电池以及物质的量计算的相关知识点。
10、
(1)正极;
(2:
2CuSO4+2H2O
2Cu+2H2SO4+O2↑,
(3)1:
1(4)银,AgNO3(5)Y极附近红褐色变深。
(1)向乙中滴入酚酞试液,在F极附近显红色,说明该极上氢离子放电,所以该电极是阴极,所以E电极是阳极,D电极是阴极,C电极是阳极,G电极是阳极,H电极是阴极,X电极是阳极,Y是阴极,A是电源的正极,B是原电池的负极,
(2)电解硫酸铜溶液时的阳极是氢氧根离子放电,阴极是铜离子放电,所以电解反应为:
(3)电解饱和食盐水的电解原理是:
2NaCl+2H2O
2NaOH+H2↑+Cl2↑,产生的氢气和氯气体积比1:
1,
(4)丙装置给铜镀银,银作阳极,镀件作阴极,含有银离子的硝酸银作电解质即可。
(5)根据异性电荷相吸的原理,氢氧化铁胶体中含有的带正电荷的粒子会向阴极即Y极移动,所以Y极附近红褐色变深,
电解原理的分析和应用
11、
(1)第三周期第ⅦA族;
(2)碱性;
S2-+H2O
HS-+OH-;
2H++2e-=H2↑;
(3)2Na