化学必修一第一章题目汇总2Word文档格式.docx
《化学必修一第一章题目汇总2Word文档格式.docx》由会员分享,可在线阅读,更多相关《化学必修一第一章题目汇总2Word文档格式.docx(84页珍藏版)》请在冰豆网上搜索。
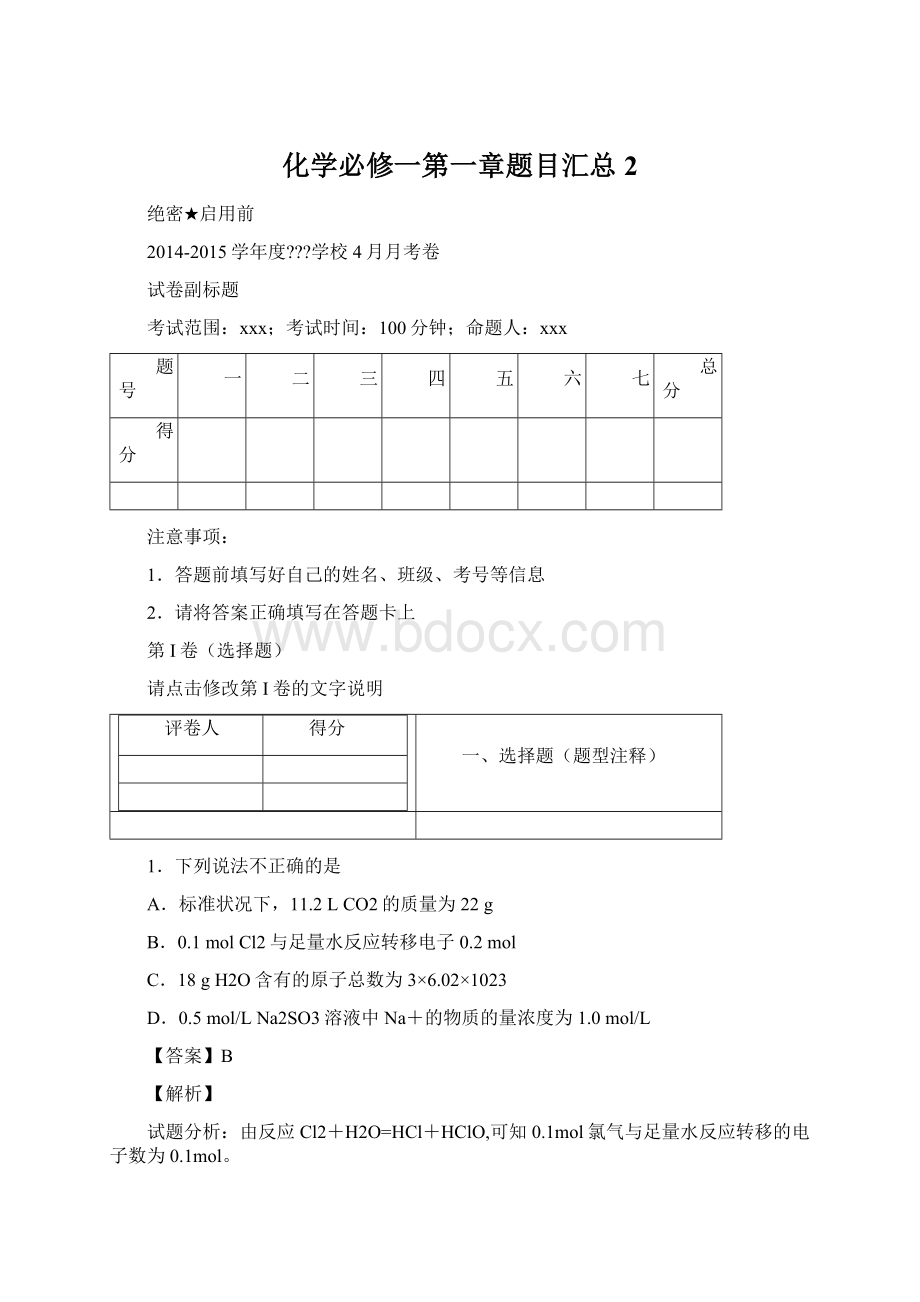
1023
D.0.5mol/LNa2SO3溶液中Na+的物质的量浓度为1.0mol/L
【答案】B
【解析】
试题分析:
由反应Cl2+H2O=HCl+HClO,可知0.1mol氯气与足量水反应转移的电子数为0.1mol。
考点:
物质的量的计算。
2.硫酸钾和硫酸铝的混合溶液中,Al3+的浓度为0.4mol/L,
的浓度为0.7mol/L,则K+的物质的量浓度为
A.0.1mo/LB.0.15mol/LC.0.2mol/LD.0.3mol/L
【答案】C
由溶液中的电荷守恒,阴离子所带负电荷与阳离子所带正电荷相同,得关系式:
0.4×
3+c(K+)=0.7×
2,c(K+)=0.2mol/L.
物质的量浓度的计算。
3.下列关于SO2的叙述中,正确的是
A.SO2的摩尔质量是64g
B.1molSO2中含氧原子数约为6.02×
C.常温常压下,1molSO2的体积为22.4L
D.常温常压下,64gSO2的物质的量为1mol
【答案】D
A项摩尔质量应该带单位“mol/L”;
B项1molSO2中含氧原子2mol,约为2×
1023;
C项1molSO2在标准状况下的体积为22.4L。
物质的量。
4.等质量的下列物质中,所含分子数最少的是
A.H2B.HClC.NH3D.CH4
结合各物质的摩尔质量,等质量的四种物质,摩尔质量最大的物质的量最小,所以HCl的物质的量最小,含有的分子数也最少。
5.从化学试剂商店买来的浓硝酸试剂瓶上所贴的危险化学品标志是
浓硝酸不属于自燃或易燃液体,没有毒性,而具有强氧化性,所以B项正确。
化学药品的警告标志。
6.下列说法正确的是
A.加入氯化钡溶液有白色沉淀生成,再加稀盐酸,沉淀不消失,一定有硫酸根离子
B.Na2O2与CO2反应,Na2O2是氧化剂、CO2是还原剂
C.向新制的FeSO4溶液中滴入适量的NaOH溶液,放置片刻,整个反应过程的颜色变化是:
浅绿色溶液→白色沉淀→灰绿色沉淀→红褐色沉淀
D.称取等质量的两份铝粉,分别加入过量的稀盐酸和过量的NaOH溶液,则放出氢气的体积(同温同压下)不相等
A、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,溶液中可能含有Ag+离子或硫酸根离子,故A错误;
B、过氧化钠和二氧化碳的反应方程式为:
2Na2O2+2CO2=2Na2CO3+O2,该反应中的过氧化钠中氧元素由-1价变为0价和-2价,所以过氧化钠既是氧化剂又是还原剂,二氧化碳既不是氧化剂又不是还原剂,故B错误;
C、FeSO4与NaOH发生复分解反应,生成氢氧化亚铁沉淀,氢氧化亚铁在水中能与氧气发生反应,生成红褐色的氢氧化铁,反应的方程式为:
4Fe(OH)2+O2+2H2O═4Fe(OH)3,故C正确;
D、铝与过量的盐酸或氢氧化钠溶液反应,生成氢气的量与铝的质量成正比,铝的质量相等,则生成氢气的量相等,故D正确。
考查离子检验、钠铁铝及其化合物的性质
点评:
本题考查了离子检验、钠铁铝及其化合物的性质,难度不大。
易错点是误选B,过氧化钠和二氧化碳的反应,可以写出方程式根据化合价的变化分析。
7.NA为阿伏加德罗常数,下列说法正确的是
A.1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA
B.标准状况下,22.4LNH3中含有电子数为8NA
C.1molCl2与足量Fe反应转移电子数为3NA
D.1mol·
L-1的AlCl3溶液中,Cl-的数目为3NA
【答案】A
A、1molNa2O中含有的阴、阳离子总数是3NA,1molNa2O2中含有的阴、阳离子总数也是3NA,故1molNa2O和Na2O2混合物中含有的阴、阳离子总数也是3NA,故A正确;
B、标准状况下,22.4LNH3为1mol,含有电子数为10NA,故B不正确;
C、1molCl2与足量Fe反应转移电子数为2NA,故C不正确;
D、未指明溶液的体积,故不能确定Cl-的数目,故D不正确。
考查阿伏伽德罗常数的应用
本题考查了阿伏伽德罗常数的应用,难度中等。
易错点是要注意Na2O2中的阴离子为过氧根离子,为原子团,1molNa2O2中含有的阴离子为1mol,而不是2mol。
8.仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置(图1、图2)就能实现相应实验目的是
A、采用溶解过滤的方法,用到烧杯、玻璃棒、漏斗等仪器,而非分液漏斗,故A错误;
B、还缺少的仪器有量筒、胶头滴管等,故B错误;
C、采用蒸发结晶的方法,用到蒸发皿、玻璃棒和酒精灯,故C正确;
D、因为CO2和HCl均可与氢氧化钠溶液反应而被吸收,故不能用氢氧化钠溶液来除杂,故D错误。
考查基本的实验操作
本题考查了基本的实验操作,难度不大。
注意在平时的学习中熟悉并积累常见实验操作的仪器及实验要点,实验步骤。
9.某学生的实验报告所列出的下列数据中合理的是
A.用10mL量筒量取8.16mL稀盐酸
B.用托盘天平称取25.20gNaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL碱式滴定管进行中和滴定时,用去某浓度的碱溶液21.70mL
A、量筒的精确度为0.1mL,用量筒量取液体,不能保留两位小数,只能保留一位小数,用10mL量筒不能量取8.16mL稀盐酸,故A不合理;
B、托盘天平的精确度为0.1g,无法称取25.20gNaCl,故B不合理;
C、广泛pH试纸测得溶液的pH值应是整数,故C不合理;
D、碱式滴定管读数可以精确到小数点后两位,用碱式滴定管可以量取碱液21.70mL,故D合理。
考点:
考查中学化学仪器常用仪器的读数
点评:
本题考查了中学化学仪器常用仪器在使用中读数的问题,难度不大。
注意不同仪器的精度不同。
10.“灼烧”时热源选用的是酒精灯而不是酒精喷灯,理由是_____________________;
“冷却”放在_______________中(填仪器名称)。
【答案】42.酒精喷灯温度太高容易使硫酸铜分解;
干燥器
酒精喷灯温度太高容易使硫酸铜分解,所以灼烧时用酒精灯,冷却在干燥器中进行。
考查化学实验基本操作。
11.在硫酸铝、硫酸钾和明矾的混合溶液中,c(SO42-)=0.4mol/L,当加入等体积0.4mol/LKOH溶液时,生成的沉淀恰好完全溶解。
则反应后溶液中K+的浓度约为
A.0.225mol/LB.0.25mol/LC.0.45mol/LD.0.9mol/L
硫酸铝、硫酸钾和明矾的混合溶液实际为硫酸铝、硫酸钾的混合溶液,加入等体积0.4mol/LKOH溶液时,生成的沉淀恰好完全溶解,发生反应Al3++4OH-=AlO2-+2H2O,根据方程式可知,n(Al3+)=1/4n(OH-),所以原溶液中c(Al3+)=1/4c(OH-)=1/4×
0.4mol/L=0.1mol/L,根据溶液呈电中性可知,原混合溶液中3c(Al3+)+c(K+)=2c(SO42-),所以c(K+)=2c(SO42-)-3c(Al3+)=2×
0.4mol/L-3×
0.1mol/L=0.9mol/L,混合后的体积为原来的2倍,钾离子来源于原混合溶液及氢氧化钾溶液,反应后溶液中K+离子的浓度为1/2×
(0.9mol/L)=0.45mol/L,选C。
考查离子方程式的有关计算。
12.下列仪器中,不属于定量仪器的是
A.容量瓶B.温度计C.烧杯D.秒表
定量仪器就是能给出一个确切的数值的测量仪器,而烧杯只是用来取一定量的液体,无需知道具体体积,选C。
考查常见的定量仪器。
13.下列有关阿伏加德罗常数的叙述正确的是
A.7.8克过氧化钠投入足量的水中,转移电子数为0.2mol
B.标准状况下,0.5×
1023个Br2分子所占体积约是11.2L
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.1L0.5mol·
L-1氯化钡溶液中所含Cl-的个数为0.5NA
过氧化钠与水反应关系式为2Na2O2~2e—,故7.8克过氧化钠投入足量的水中,转移电子数为0.1NA,故A项错误;
标准状况下溴为液体,故不可应用标准状况下的气体摩尔体积,故B项错误;
CO2和O2均含有2个氧原子,故由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA,C项正确;
1L0.5mol·
L-1氯化钡溶液中所含Cl-的个数为NA,故D项错误;
本题选C。
阿伏加德罗常数考查。
14.同温同压下,两种气体的体积如果不相同,其主要原因是
A.气体的分子大小不同B.气体分子间的平均距离不同
C.气体的物质的量不同D.气体的性质不同
气体体积大小主要受两个因素影响:
①气体分子数目、②气体分子间的平均距离,同温、同压下,气体分子间的平均距离几乎相等,故同温同压下,两种气体的体积如果不相同,其主要原因是气体分子数目不相同,即气体的物质的量不同,故C项正确;
气体体积大小因素判断。
15.近日来,全国安全事故频发,折射出人们对化学品与安全知识的极度缺乏,下列有关化学品与安全的说法或操作错误的是
A、运液氯可用钢瓶装,车上应贴
标志,装运浓硫酸可用铝槽罐车应贴
标志
B、冬天严禁在窗门紧闭的室内用煤饼炉取暖,因为生成的CO、SO2等容易引起中毒
C、用铝锅煮菜一般在起锅之前才放盐,既减少加碘盐的损耗,又能增加铝锅的使用寿命
D、严禁在写作业时将铅笔放入口中啃咬,否则会引起铅中毒
A项氯气有毒,故运液氯可用钢瓶装,车上应贴
标志,浓硫酸属于有强氧化性、腐蚀性,属于腐蚀品,故装运浓硫酸可用铝槽罐车应贴
标志,则A项正确;
冬天窗门紧闭的室内用煤饼炉取暖,煤炭燃烧会产生大量的CO2、CO、SO2,其中CO、SO2为有毒气体,会使人中毒,故冬天严禁在窗门紧闭的室内用煤饼炉取暖,则B项正确;
盐水会使铝发生吸氧腐蚀而被氧化,食盐中的碘元素一般为碘酸钾,碘酸钾受热分解,故用锅煮菜应在起锅之前加盐,不应过早,C项正确;
铅笔中的笔芯为石墨,构成为C元素,故写作业时将铅笔放入口中啃咬不会引起铅中毒,故D项错误。
化学与生产生活。
16.下列实验操作能达到实验目的的是
编号
实验目的
实验操作
A.
测定溶液的pH值
用广泛pH试纸测得溶液的pH为2.3
B.
鉴别苯与二甲苯
分别取样,滴加溴水,充分振荡
C.
排除碱式滴定管尖嘴部分的气泡
将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出
D.
准确测定体积25mL浓度约为0.15mol·
L-1HCl溶液的浓度
用25.00mL碱式滴定管和0.1000mol·
L-1NaOH溶液滴定
广泛pH试纸测得溶液的pH只能是整数,不会测定2.3,故A项错误;
苯、二甲苯均不会是溴水褪色,故不可用溴水鉴别苯、二甲苯,应用酸性高锰酸钾溶液鉴别,B项错误;
向碱式滴定管中加入适量水,将碱式滴定管胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出则会使碱式滴定管尖嘴部分的气泡排出,故C项正确;
酸碱中和滴定用25.00mL碱式滴定管和0.1000mol·
L-1NaOH溶液测定体积25mL浓度约为0.15mol·
L-1HCl溶液的浓度,但选用碱式滴定管应用50ml的,不应用25.00ml,故D项错误;
实验基本操作。
17.0.8g某物质含有3.01×
1022个分子,该物质的相对分子质量约为
A.8B.16C.64D.160
0.8g某物质含有3.01×
1022个分子,则物质的量为(3.01×
1022)/(6.02×
1022)=0.5摩尔,所以相对分子质量为0.8/0.5=16,选B。
物质的量的相关计算。
18.用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.1molN2所含有的原子数为NA
B.1mol·
L-1NaCl溶液中含有的钠离子数目为NA
C.标准状况下,22.4LCO所含的原子数为NA
D.24gO2和24gO3所含的氧原子数都是1.5NA
A、1摩尔氮气中含有2摩尔原子,所以不选A;
B、溶液的体积没有说明,不能计算微粒数,所以不选B;
C、标准状况下,22.4升一氧化碳为1摩尔,含有2摩尔原子,所以不选C;
D、氧气和臭氧中都只含有氧原子,质量相等时含有相等的氧原子,氧原子为24/16=1.5摩尔,所以选D。
阿伏伽德罗常数。
19.下列实验能达到预期目的的是
A.用酒精萃取碘水中的碘B.通过灼热CuO以除去O2中混有的H2
C.用分液法分离花生油和水D.海盐经过溶解、过滤、蒸发制纯净的NaCl
A、酒精能溶于水,所以不能做为萃取碘的溶剂,所以不选A;
B、氧化铜和氢气反应生成水和铜,铜和氧气再反应生成氧化铜,所以气体通过灼热的氧化铜的结果是氢气和氧气变成水,所以不选B;
C、花生油和水不互溶,所以可以用分液的方法分离,选C;
D、海盐经过溶解、过滤、蒸发后得到的是粗盐,不是纯净的氯化钠,所以不选D。
实验方案的设计和评价。
20.氧气与甲烷的混合气体中,若氧气与甲烷的质量比为4:
1(极易爆炸),则其体积比为
A.2:
1B.1:
1C.1:
4D.1:
2
氧气和甲烷的的物质的量比例为4/32:
1/16=2:
1,选A。
阿伏伽德罗定律。
21.下列有关实验操作说法正确的是
A.用分液漏斗分离汽油和植物油
B.向试管中滴加液体时,胶头滴管紧贴试管内壁
C.加热试管内物质时,试管底部与酒精灯灯芯接触
D.过滤时,漏斗下端紧贴烧杯内壁
A、汽油和植物油能互溶,所以不能用分液方法分离,应用蒸馏法,不选A;
B、胶头滴管使用时不能伸入试管内,也不能接触试管内壁,不选B;
C、加热时用外焰,所以不选C;
D、过滤式漏斗下端紧贴烧杯内壁,使液体顺利流下,所以选D。
22.用NA表示阿伏加德罗常数,下列叙述正确的是
A.常温常压下,1.42gNa2SO4含有的Na+离子数为0.02NA
B.标准状况下,22.4LCCl4含有的分子数为NA
C.常温常压下,NA个Ar分子占有的体积为22.4L
D.物质的量浓度为2mol/L的MgCl2溶液中,含有Cl-个数为4NA
A、1.42克硫酸钠的物质的量为1.42/142=0.01摩尔,含有0.02摩尔钠离子,所以选A;
B、四氯化碳不是气体,所以不能计算其物质的量,所以不选B;
C、常温常压下,气体摩尔体积不是22.4L/mol,所以1摩尔氩气的体积不是22.4升,所以不选C;
D、没有说明溶液的体积,不能计算其物质的量,所以不选D。
23.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,11.2LO2和O3组成的混合气体含有原子数为NA
B.常温常压下,1.7gNH3含有的电子数目为NA
C.0.1mol/LNa2SO4溶液中含有Na+的个数为0.2NA
D.常温常压下,22.4LCO2与足量Na2O2反应转移电子数为NA
标准状况下,11.2LO2和O3组成的混合气体的物质的量为0.5mol,无法确定该混合气体中氧气和臭氧的比例,也无法计算原子数,A项错误;
1.7gNH3的物质的量为0.1mol,氨气是10电子分子,1.7gNH3含有的电子数目为NA,B项正确;
没有体积,无法计算离子数,C项错误;
常温常压下,22.4L气体的物质的量无法计算,D项错误;
选B。
考查阿伏伽德罗常数及计算。
24.实现下列操作的正确方法依次是
①分离植物油和水②去除KNO3溶液中少量的NaCl杂质③以海水为原料制取粗盐
A.蒸发、萃取、分液B.萃取、过滤、结晶
C.过滤、蒸发、萃取D.分液、结晶、蒸发
①植物油和水互不相溶,用分液的方法分离,②KNO3的溶解度随温度的变化较大,而NaCl的溶解度随温度的变化较小,采用结晶的方法分离,③海水为原料制取粗盐则采用蒸发的方法,选D。
考查物质的分离。
25.下列包装标识贴错了的是
选项
A
B
C
D
物质
浓硫酸
酒精
石灰石
黑火药
标识
A中试管中的液体倒在手上或桌面上会腐蚀桌面,表示该药品是腐蚀品,浓硫酸具有腐蚀性,正确;
B.正方形中有一堆火焰,表示该药品是自燃性的药品,酒精具有可燃性,正确;
C.正方形中的一个骷髅头,表示该药品是剧毒,石灰石无毒,错误;
D中是爆炸品标志,爆炸品是指容易发生爆炸的,如烟花爆竹、硝酸钾等,正确;
选D。
考查安全警示标志。
26.下列装置所示的实验,能达到实验目的的是
A.用装置A分离乙酸和乙酸乙酯B.用装置B收集NO气体
C.用装罝C在实验室中制取氨气D.用装置D除去Cl2中的HC1
乙酸与乙酸乙酯互溶,不能用分液方法分离,A项错误;
NO难溶于水,能用排水集气法收集,B项正确;
氯化铵受热分解,离开热源又重新生成氯化铵,无法产生氨气,C项错误;
氯气和HCl都和NaOH溶液反应,不能用于除去氯气中的HCl,用饱和食盐水除去氯气中的氯化氢,D项正确;
27.用NA表示阿伏加德罗常数的值。
下列判断正确的是
A.标准状况下,4.48L苯中含有的分子数目为0.2NA
B.1.5molL-1MgCl2溶液中含有的Cl-离子数目为3NA
C.常溫常压下,32gO2和O3的混合气体中含有的氧原子数目为2NA
D.5.6g金属Fe与足量Cl2反应转移的电子数为3NA
在标准状况下,苯是液体,无法计算分子数目,A项错误;
没有溶液体积,无法计算溶液中离子的物质的量,B项错误;
O2和O3都是由氧原子形成的单质,氧原子数目为(32/16)NA=2NA,C项正确;
铁与氯气反应生成氯化铁,铁失3个电子生成Fe3+,5.6g金属Fe的物质的量为5.6/56=0.1mol,5.6g金属Fe与足量Cl2反应转移的电子数为0.3NA,D项错误;
选C。
28.下列实验不能达到实验目的的是
A.用CaCl2溶液可区别Na2C03和NaHCO3溶液
B.用CC14萃取碘水中的碘
C.用饱和NaHCO3溶液除去C02中的HCI
D.检验未知溶液是否含S042-,可先加氯化钡,再加稀盐酸
A.CaCl2溶液与Na2CO3溶液产生白色沉淀,CaCl2溶液和NaHCO3溶液不反应,能区别,不选;
B.碘易溶于CCl4,不溶于水,能用CC14萃取碘水中的碘,不选;
C.NaHCO3+HCl=NaCl+CO2+H2O,能用饱和NaHCO3溶液除去C02中的HCl,不选;
D.检验未知溶液是否含S042-,先加稀盐酸,无现象,排除SO32-等离子的干扰,再加氯化钡溶液,产生白色沉淀,选;
考查物质的分离,离子的检验等知识。
29.某稀硫酸和稀硝酸的混合溶液中c(SO42-)+c(NO3-)=2.5mol•L-1.取200mL该混合酸,则能溶解铜的最大质量为
A.12.8gB.19.2gC.32.0gD.38.4g
200mL的混酸溶液中,n(SO42-)+n(NO3-)=0.5mol,Cu与混酸反应的离子方程式是3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,当消耗Cu的质量最大时,则溶液中的氢离子与硝酸根离子的物质的量之比应恰好是4:
1,设硫酸的物质的量是x,硝酸的物质的量是y,则x+y=0.5mol,氢离子的物质的量是2x+y,所以有(2x+y):
y=4:
1,解得x=0.3mol,y=0.2mol,则氢离子的物质的量是0.8mol,所以消耗Cu的物质的量是0.3mol,其质量是19.2g,答案选B。
考查Cu与混酸反应的计算
30.NA表示阿伏加德罗常数,下列叙述正确的是
A.1L1mol·
L-1的NaClO溶液中含有ClO-的数目为NA。
B.标准状况下,0.1molCl2溶于水,转移电子的数目为0.1NA。
C.2.3gNa与O2完全反应生成3.6g产物时失电子数是0.1×
D.标准状况下,11.2LCH3CH2OH中含有的分子数为0.5NA
A、次氯酸是弱酸,所以次氯酸根离子发生水解,使次氯酸根离子的数目小于NA,错误;
B、0.1mol氯气溶于水是可逆反应,所以0.1mol的氯气不会完全与水反应生成氯化氢和次氯酸,则转移的电子数小于0.1NA,错误;
C、2.3g钠的物质的量是0.1mol,与氧气的产物中Na元素的化合价只有+1价,所以0.1mol钠完全反应转移的电子数是0.1NA,即是0.1×
1023,正确;
D、标准状况下,乙醇为液体,所以11.2L乙醇的物质的量不是0.5mol,则含有的分子数不是0.5NA,错误,答案选C。
考查阿伏伽德罗常数与微粒数的关系判断
31.设NA为阿伏加德罗常数的值,下列说法正确的是
A.在常温常压下,2.8gN2和CO的混合气体所含电子数为1.4NA
B.标准状况下,22.4LCCl4含有的分子数目为NA
C.1L0.1mol·
L-1NaHCO3溶液中含有0.1NA个HCO3-
D.在电解精炼粗铜的过程中,当转移电子数为NA时,阳极溶解32g
A.N2和CO的相对分子质量都是28,分子中含有