届高考化学二轮复习专题九化学工艺流程综合型研究Word下载.docx
《届高考化学二轮复习专题九化学工艺流程综合型研究Word下载.docx》由会员分享,可在线阅读,更多相关《届高考化学二轮复习专题九化学工艺流程综合型研究Word下载.docx(13页珍藏版)》请在冰豆网上搜索。
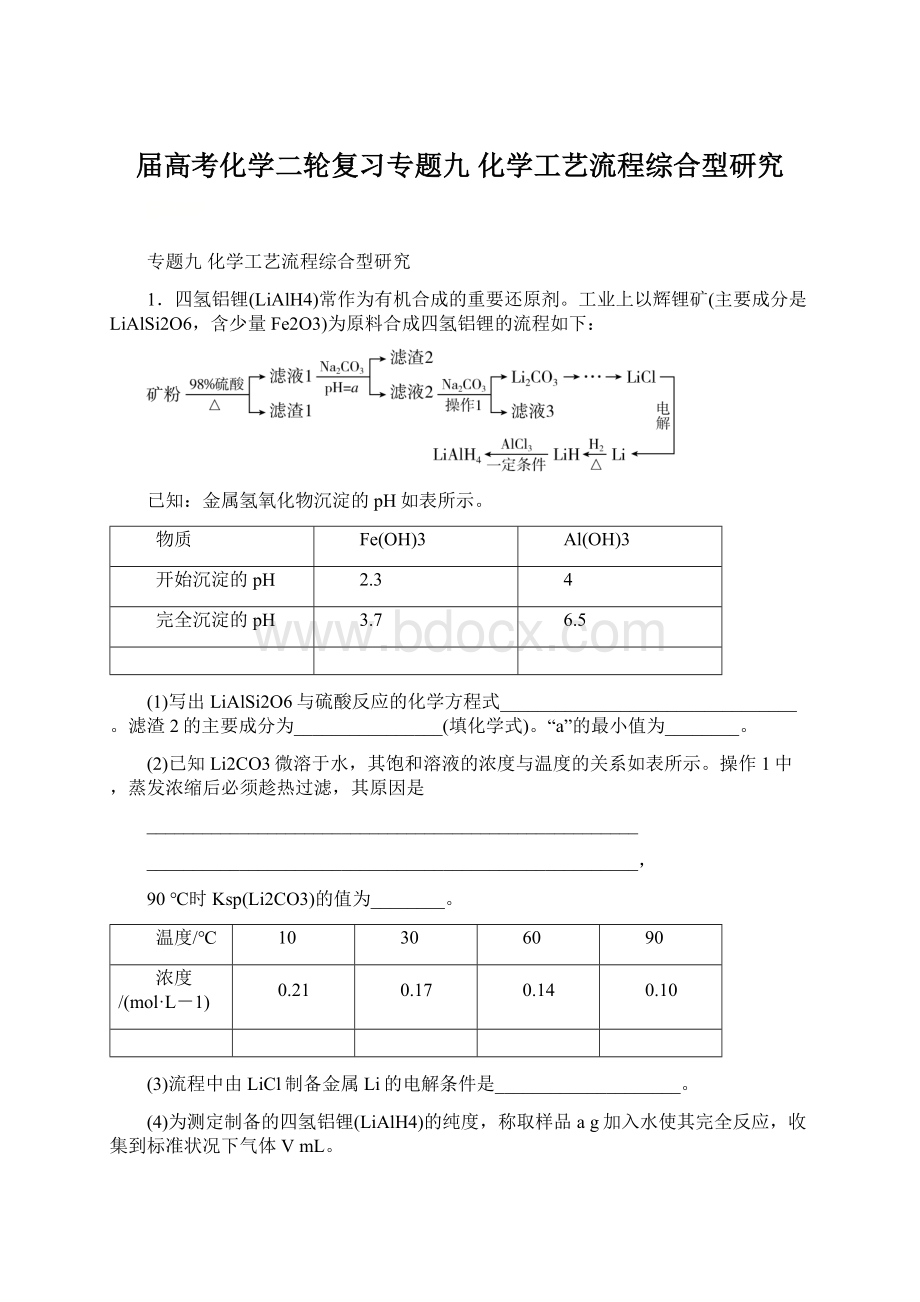
0.17
0.14
0.10
(3)流程中由LiCl制备金属Li的电解条件是____________________。
(4)为测定制备的四氢铝锂(LiAlH4)的纯度,称取样品ag加入水使其完全反应,收集到标准状况下气体VmL。
①LiAlH4溶解时发生反应的化学方程式为______________________
__________________________________________________________。
②样品的纯度为________(列出数学表达式即可。
)
答案
(1)2LiAlSi2O6+4H2SO4===Li2SO4+Al2(SO4)3+4H2SiO3 Fe(OH)3、Al(OH)3 6.5
(2)Li2CO3溶解度随温度升高而降低,蒸发浓缩后趁热过滤,能减少Li2CO3的溶解损失 4.0×
10-3
(3)Pt等惰性电极、熔融的LiCl
(4)①LiAlH4+4H2O===LiOH+Al(OH)3↓+4H2↑ ②
%
解析
(1)由流程梳理可知,LiAlSi2O6与H2SO4反应得到Li2SO4、Al2(SO4)3和不溶于水的H2SiO3,发生的反应为:
2LiAlSi2O6+4H2SO4===Li2SO4+Al2(SO4)3+4H2SiO3;
滤液1中含有Li2SO4、Al2(SO4)3和Fe2(SO4)3,加入碳酸钠调pH,是为了使Al2(SO4)3和Fe2(SO4)3分别生成Al(OH)3、Fe(OH)3除去,故滤渣2的主要成分是Fe(OH)3、Al(OH)3;
由表中数据知,a的最小值为6.5。
(2)由碳酸锂饱和溶液的浓度与温度的关系可知,Li2CO3溶解度随温度升高而降低,为减少Li2CO3的溶解损失,蒸发浓缩后应趁热过滤。
90℃时,溶液中c(Li2CO3)=0.1mol·
L-1,则c(Li+)=0.2mol·
L-1,c(CO
)=0.1mol·
L-1,故Ksp(Li2CO3)=0.22×
0.1=4.0×
10-3。
(3)根据电解熔融的氯化钠制取Na可知,由LiCl制取Li的电解条件是用Pt等惰性材料作电极电解熔融的LiCl。
(4)①由四氢铝锂是重要的还原剂,知四氢铝锂与水反应得到的气体为氢气,同时得到LiOH和Al(OH)3,反应的化学方程式为LiAlH4+4H2O===LiOH+Al(OH)3↓+4H2↑。
②氢气的体积为VmL,物质的量为
mol,由LiAlH4~4H2,得n(LiAlH4)=
mol,m(LiAlH4)=
g,样品的纯度为
×
100%=
%。
2.(2019·
江苏)实验室以工业废渣(主要含CaSO4·
2H2O,还含少量SiO2、Al2O3、Fe2O3)为原料制取轻质CaCO3和(NH4)2SO4晶体,其实验流程如下:
(1)室温下,反应CaSO4(s)+CO
(aq)
CaCO3(s)+SO
(aq)达到平衡,则溶液中
=__________________[Ksp(CaSO4)=4.8×
10-5,Ksp(CaCO3)=3×
10-9]。
(2)将氨水和NH4HCO3溶液混合,可制得(NH4)2CO3溶液,其离子方程式为___________;
浸取废渣时,向(NH4)2CO3溶液中加入适量浓氨水的目的是________________________。
(3)废渣浸取在如图所示的装置中进行。
控制反应温度在60~70℃,搅拌,反应3小时。
温度过高将会导致CaSO4的转化率下降,其原因是____________________________;
保持温度、反应时间、反应物和溶剂的量不变,实验中提高CaSO4转化率的操作有__________________。
(4)滤渣水洗后,经多步处理得到制备轻质CaCO3所需的CaCl2溶液。
设计以水洗后的滤渣为原料,制取CaCl2溶液的实验方案:
___________________________________________________________
[已知pH=5时Fe(OH)3和Al(OH)3沉淀完全;
pH=8.5时Al(OH)3开始溶解。
实验中必须使用的试剂:
盐酸和Ca(OH)2]。
答案
(1)1.6×
104
(2)HCO
+NH3·
H2O===NH
+CO
+H2O 增加溶液中CO
的浓度,促进CaSO4的转化
(3)温度过高,(NH4)2CO3分解 加快搅拌速率
(4)在搅拌下向足量稀盐酸中分批加入滤渣,待观察不到气泡产生后,过滤,向滤液中分批加入少量Ca(OH)2,用pH试纸测量溶液pH,当pH介于5~8.5时,过滤
解析
(1)溶液中
=
=1.6×
104。
(2)(NH4)2CO3溶液中CO
水解,CO
+H2O
HCO
+OH-,加入适量浓氨水,溶液中OH-浓度增大,抑制CO
水解,从而增加溶液中CO
的浓度,促进CaSO4转化为CaCO3。
(3)(NH4)2CO3受热易分解,生成NH3、CO2、H2O;
加快搅拌速率可使反应物反应更充分,提高CaSO4的转化率。
(4)滤渣的主要成分有CaCO3、SiO2、Al2O3、Fe2O3。
用盐酸将其溶解后,过滤除去SiO2。
用Ca(OH)2调节滤液的pH到5~8.5,使Fe3+和Al3+完全沉淀,过滤除去Fe(OH)3和Al(OH)3。
3.一种利用泥磷(P4,含有少量CaO、Fe2O3、Al2O3、CaCl2和微量重金属盐等)为原料制备高纯次磷酸(H3PO2)的工艺流程如下:
次磷酸(H3PO2)是一元中强酸,还原性较强,主要用于化学镀银、镍、铜等。
(1)“滤渣Ⅱ”的主要成分为____________(填化学式)。
(2)工业级NaH2PO2中影响次磷酸质量指标较大的主要杂质为Cl-、SO
及重金属离子等,除Cl-时加入的Ag2SO4溶液不宜过量太多,其主要原因是_____________________________________________。
(3)从工业级NaH2PO2溶液中可获得NaH2PO2·
H2O,其具体操作步骤为________、________、过滤、洗涤和干燥。
洗涤该产品常用乙醇,其原因是_________________________________________________。
(4)NaH2PO2是________(填“正盐”或“酸式盐”),尾气中的PH3被NaClO溶液吸收可生成NaH2PO2,则该反应中氧化产物与还原产物的物质的量之比为________。
(5)工业上,可以用惰性电极电解NaH2PO2溶液制取磷酸,请写出其阳极电极反应式__________________________________________。
答案
(1)CaCO3和Al(OH)3
(2)过量的Ag+会氧化H2PO
,降低次磷酸纯度
(3)蒸发浓缩 冷却结晶 洗去可溶性杂质,减少产品NaH2PO2·
H2O的溶解损失,乙醇易挥发,利于干燥
(4)正盐 1∶2
(5)H2PO
-4e-+2H2O===H3PO4+3H+
解析
(1)根据流程梳理可知滤渣Ⅱ的主要成分为CaCO3和Al(OH)3。
(2)根据次磷酸还原性较强,可用于化学镀银知,过量的Ag+可将H2PO
氧化,从而降低次磷酸的纯度。
(3)从工业级NaH2PO2溶液中获得NaH2PO2·
H2O应进行的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,在洗涤的过程中使用乙醇洗涤,可洗去可溶性杂质,减少NaH2PO2·
H2O的溶解损失,且在干燥步骤中更容易干燥。
(4)由于H3PO2是一元中强酸,所以NaH2PO2是正盐;
PH3→NaH2PO2,P的化合价升高4,NaH2PO2为氧化产物,NaClO→NaCl,Cl的化合价降低2,NaCl为还原产物,根据得失电子守恒,可知n(NaH2PO2)∶n(NaCl)=1∶2。
(5)阳极发生氧化反应,NaH2PO2
H3PO4,故阳极的电极反应式为H2PO
-4e-+2H2O===H3PO4+3H+。
4.三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。
工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·
2H2O),再高温煅烧草酸镍制取Ni2O3。
已知草酸的钙、镁、镍盐均难溶于水。
工艺流程图如图所示:
(1)“操作Ⅰ”为“酸浸”,为了提高酸浸的效率,可以采取的措施为
________________________________________________________________________(写出两条)。
(2)加入H2O2发生的主要反应的离子方程式为__________________。
(3)加入碳酸钠溶液调pH至4.0~5.0,其目的是_________________。
(4)将草酸镍(NiC2O4·
2H2O)在热空气中干燥脱水,再采用高温煅烧,可制得Ni2O3,同时获得混合气体,该混合气体的主要成分为水蒸气和________。
(5)工业上还可用电解法制取Ni2O3,用NaOH溶液调NiCl2溶液的pH至7.5,加入适量Na2SO4后利用惰性电极电解。
电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。
ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为________________。
amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为________mol。
(6)以Al和NiO(OH)为电极,NaOH溶液为电解液组成原电池,放电时NiO(OH)转化为Ni(OH)2,
则放电时负极的电极反应式为_______________。
答案
(1)粉碎含镍废料、适当增大稀硫酸浓度、适当升温、搅拌等
(2)2Fe2++H2O2+2H+===2Fe3++2H2O
(3)促进Fe3+水解沉淀完全
(4)CO、CO2
(5)ClO-+2Ni(OH)2===Cl-+Ni2O3+2H2O 1.25a
(6)Al+4OH--3e-===AlO
+2H2O
解析
(1)根据化学反应速率的影响因素知,为提高酸浸的效率,可以采取的措施有粉碎含镍废料、适当增大稀硫酸浓度、适当升温、搅拌等。
(2)加入H2O2的目的是将Fe2+氧化为Fe3+,离子方程式为:
2Fe2++H2O2+2H+===2Fe3++2H2O。
(3)加入Na2CO3后过滤得到含铁滤渣,因此加入Na2CO3调pH至4.0~5.0的作用是促进Fe3+水解,将Fe3+转化为Fe(OH)3。
(4)草酸镍脱水后高温煅烧可制得Ni2O3,Ni元素的化合价升高,则碳元素的化合价降低,有CO生成,配平化学方程式为:
2NiC2O4
Ni2O3+3CO↑+CO2↑,故该混合气体的主要成分为水蒸气和CO、CO2。
(5)ClO-将Ni(OH)2氧化为Ni2O3,本身被还原为Cl-,由Ni(OH)2→
Ni2O3失e-,ClO-→Cl-得2e-,根据得失电子守恒,Ni(OH)2、ClO-的系数分别为2、1,可得ClO-+2Ni(OH)2―→Cl-+Ni2O3,再根据电荷守恒和原子守恒,配平离子方程式为:
ClO-+2Ni(OH)2===Cl-+Ni2O3+2H2O。
amol二价镍全部转化为三价镍时,消耗0.5amolClO-,根据电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-及Cl2+2OH-===Cl-+ClO-+H2O,知电解产生的n(Cl2)=0.5amol÷
80%=0.625amol,根据阳极反应:
2Cl--2e-===Cl2↑,知产生0.625amol氯气时,转移电子的物质的量为0.625amol×
2=1.25amol。
(6)根据放电时NiO(OH)转化为Ni(OH)2,知NiO(OH)为正极,Al为负极,由于电解质溶液为NaOH溶液,故放电时负极上Al转化为AlO
,电极反应式为:
Al+4OH--3e-===AlO
+2H2O。
5.镉(Cd)可用于制作某些发光电子组件。
一种以镉废渣(含CdO及少量ZnO、CuO、MnO、FeO杂质)为原料制备镉的工艺流程如下:
(1)“滤渣1”的主要成分为Cu(OH)2和________(填化学式)。
(2)“氧化”时KMnO4的还原产物是MnO2,该步骤中除铁、除锰的离子方程式分别为
(3)“置换”中镉置换率与
的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。
①实际生产中
的值最佳为1.3,不宜超过该值的原因是
②若需置换出112kgCd,且使镉置换率达到98%,实际加入的Zn应为________kg。
(4)“置换”后滤液溶质主要成分是________(填化学式)。
(5)“熔炼”时,将海绵镉(含Cd和Zn)与NaOH混合反应,反应的化学方程式是________________________________。
当反应釜内无明显气泡产生时停止加热,利用Cd与Na2ZnO2的________不同,将Cd从反应釜下口放出,以达到分离的目的。
答案
(1)CaSO4
(2)3Fe2++MnO
+7H2O===3Fe(OH)3↓+MnO2↓+5H+、3Mn2++2MnO
+2H2O===5MnO2↓+4H+
(3)①锌粉用量过多增加成本;
海绵镉的纯度降低;
熔炼中NaOH用量过多增加成本
②86.2
(4)ZnSO4
(5)Zn+2NaOH
Na2ZnO2+H2↑ 密度
解析
(1)硫酸溶解镉废渣时,金属氧化物转化为硫酸盐,然后加石灰乳调pH=5,Cu2+转化为Cu(OH)2沉淀,Ca2+与SO
形成CaSO4沉淀,故“滤渣1”的主要成分为Cu(OH)2和CaSO4。
(2)“氧化”时除铁、除锰,Fe2+转化为Fe(OH)3,Mn2+转化为MnO2,除铁时由Fe2+→Fe(OH)3失e-、MnO
→MnO2得3e-,根据得失电子守恒,Fe2+、MnO
的系数分别为3、1,可得3Fe2++MnO
―→3Fe(OH)3↓+MnO2↓,再根据电荷守恒和原子守恒。
配平离子方程式为:
3Fe2++MnO
+7H2O===3Fe(OH)3↓+MnO2↓+5H+。
除锰时由Mn2+→MnO2失2e-、MnO
→MnO2得3e-,根据得失电子守恒,Mn2+、MnO
的系数分别为3、2,可得3Mn2++2MnO
―→5MnO2↓,再根据电荷守恒和原子守恒,配平离子方程式为:
3Mn2++2MnO
+2H2O===5MnO2↓+4H+。
(3)①“置换”时发生反应:
Zn+Cd2+===Zn2++Cd,过量的锌和Cd熔炼时加NaOH分离,若
的值过大,则锌粉用量过多增加成本,海绵镉的纯度降低,熔炼时NaOH用量过多也增加成本。
②若需置换出112kgCd,且使镉置换率达到98%,则Cd2+的质量为112kg÷
98%,根据Zn+Cd2+===Zn2++Cd,知Zn的理论用量m(Zn)=m(Cd2+)×
=112kg÷
98%×
=65÷
98%kg,由题图知,镉置换率为98%时,
=1.3,故实际加入的Zn的质量为65÷
98%kg×
1.3≈86.2kg。
(4)根据置换反应:
Zn+CdSO4===ZnSO4+Cd知,“置换”后滤液溶质主要成分是ZnSO4。
(5)“熔炼”时,Zn与NaOH反应生成Na2ZnO2,化学方程式为:
Zn+2NaOH
Na2ZnO2+H2↑。
根据分离时Cd从反应釜下口放出,知Cd与Na2ZnO2的密度不同。
6.钒是人体必需的微量元素,对治疗糖尿病和癌症及保护心血管等具有潜在的药理学作用。
工业上用含三价钒(V2O3)为主的某石煤(含有Al2O3、CaO等杂质)为原料,用钙化法焙烧制备V2O5,其流程如下:
+5价钒在溶液中的主要存在形式与溶液pH的关系如表。
pH
4~6
6~8
8~10
10~12
主要离子
VO
V2O
(1)焙烧:
向石煤中加生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式是__________________________________。
(2)酸浸:
Ca(VO3)2难溶于水,可溶于盐酸。
若焙砂酸浸时溶液的pH=4,Ca(VO3)2溶于盐酸的离子方程式是_______________________。
(3)转沉:
将浸出液中的钒转化为NH4VO3固体,其流程如下。
①浸出液中加入石灰乳的作用是______________________________
____________________。
②向(NH4)3VO4溶液中加入NH4Cl溶液,控制溶液的pH=7.5。
当pH>
8时,NH4VO3的产量明显降低,原因是__________________________。
(4)实验室以V2O5为原料还可以合成用于制备VO2的氧钒(Ⅳ)碱式碳酸铵晶体,过程如下:
V2O5
VOCl2溶液
(NH4)5[(VO)6(CO3)4(OH)9]·
10H2O
①步骤ⅱ可在如图装置(气密性良好)中进行。
VO2+能被O2氧化。
药品填装完成后的实验操作是____________________(填“活塞a”“活塞b”的操作顺序),装置B中的试剂是____________。
②测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品中钒的含量。
称量4.246g样品于锥形瓶中,用20mL蒸馏水与30mL硫酸混合溶解后,加0.02mol·
L-1的KMnO4溶液至稍过量,充分反应后继续加1%NaNO2溶液至稍过量,再用尿素除去过量的NaNO2,最后用0.08mol·
L-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为30.00mL(滴定反应:
+Fe2++2H+===VO2++Fe3++H2O)。
NaNO2溶液的作用是____________________,粗产品中钒的质量分数为________(精确到小数点后两位)。
答案
(1)CaO+O2+V2O3
Ca(VO3)2
(2)Ca(VO3)2+4H+===2VO
+Ca2++2H2O
(3)①调节溶液的pH,并提供Ca2+,形成Ca3(VO4)2沉淀
②当pH>
8时,钒的主要存在形式不是VO
(4)①打开活塞a数分钟后,再打开活塞b 饱和NaHCO3溶液
②除去过量的KMnO4 2.88%
解析
(1)V2O3转化为Ca(VO3)2,V元素化合价升高,被氧化,则焙烧时有氧气参加反应,1molV2O3转化为Ca(VO3)2失4mol电子,1molO2被还原得4mol电子,故V2O3、O2的化学计量数相等,根据得失电子守恒、原子守恒配平化学方程式为CaO+O2+V2O3
Ca(VO3)2。
(2)焙砂酸浸时pH=4,根据提供信息知,Ca(VO3)2转化为VO
,故Ca(VO3)2溶于盐酸的离子方程式为Ca(VO3)2+4H+===2VO
+Ca2++2H2O。
(3)①根据图示,加入石灰乳得到Ca3(VO4)2沉淀;
根据提供信息,Ca3(VO4)2沉淀存在的pH为10~12,故加入石灰乳的作用是调节溶液的pH,并提供Ca2+,形成Ca3(VO4)2沉淀。
②根据提供信息,pH>
,因此NH4VO3的产量明显降低。
(4)①根据提供信息,VO2+能被O2氧化,知要先利用A中产生的CO2气体排除装置中空气,故药品填装完成后的实验操作为:
打开活塞a数分钟后,再打开活塞b。
由于盐酸易挥发,A装置制得的CO2中含有HCl气体,故装置B用于除去CO2中混有的HCl气体,应选择饱和NaHCO3溶液。
②加入KMnO4溶液至稍过量,而(NH4)2Fe(SO4)2标准溶液能被酸性高锰酸钾溶液氧化,故NaNO2的作用是除去过量的KMnO4。
根据滴定原理知,n(VO
)=n(Fe2+)=n[(NH4)2Fe(SO4)2]=0.08mol·
L-1×
0.03L=2.4×
10-3mol,则粗产品中钒的质量为51g·
mol-1×
2.4×
10-3mol=0.1224g,钒的质量分数为
100%≈2.88%。