河北临城县临城中学高中化学第六章 化学反应与能量知识点及练习题及答案Word文档格式.docx
《河北临城县临城中学高中化学第六章 化学反应与能量知识点及练习题及答案Word文档格式.docx》由会员分享,可在线阅读,更多相关《河北临城县临城中学高中化学第六章 化学反应与能量知识点及练习题及答案Word文档格式.docx(26页珍藏版)》请在冰豆网上搜索。
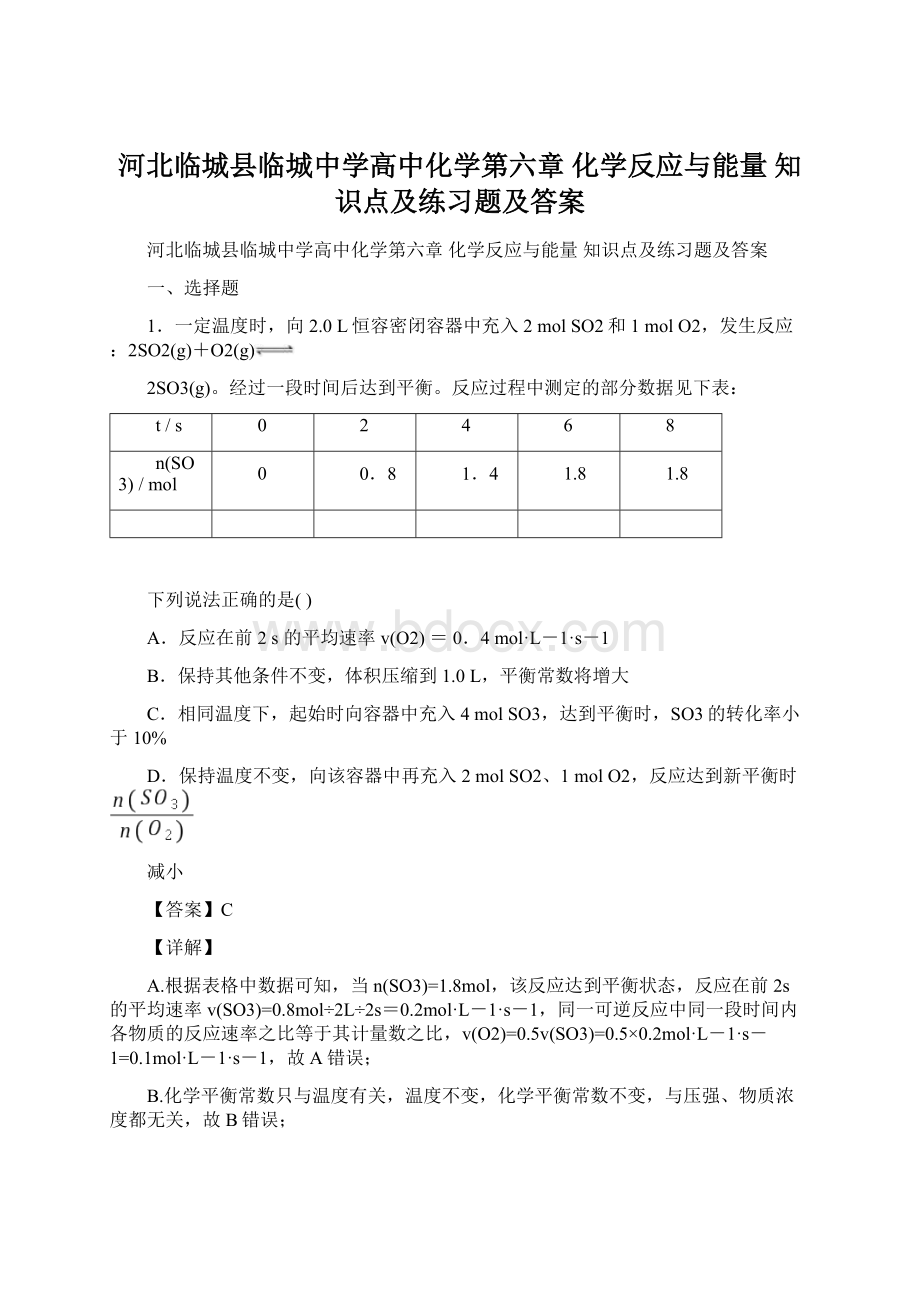
2mol×
100%=90%。
若起始时向容器中充入2molSO3时,将建立等效平衡,SO3的转化率等于10%,相同温度下,起始时充入4molSO3,相当于对原平衡加压,SO3的转化率减小,应小于10%,故C正确;
D.保持温度不变,向该容器中再充入2molSO2、1molO2,相当于缩小容器的体积,增大了压强,平衡正向移动,三氧化硫的物质的量增加,氧气的物质的量减少,所以
增大,故D错误。
故选C。
2.反应3A(g)+B(g)═2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为:
①vA═1mol/(L•min)
,②vC═0.5mol/(L•min),
③vB═0.5mol/(L•min),三种情况下该反应速率大小的关系正确的是( )
A.②>③>①B.①>②>③C.③>①>②D.②>①>③
都转化为A表示的反应速率来比较反应速率的快慢。
①vA=1mol/(L•min);
②vC=0.5mol/(L•min),由3A(g)+B(g)═2C(g),则转化为A表示的反应速率vA=0.5mol/(L•min)×
=0.75mol/(L•min);
③vB=0.5mol/(L•min),由3A(g)+B(g)═2C(g),则转化为A表示的反应速率vA=0.5mol/(L•min)×
3=1.5mol/(L•min);
显然③>①>②,故选C。
3.在恒温下的密闭容器中,有可逆反应
,下列不能说明该反应已达到平衡状态的是()
A.正反应生成NO2的速率和逆反应生成O2的速率
B.混合气体的颜色不再改变
C.反应容器中的压强不随时间的变化而变化
D.混合气体的平均摩尔质量保持不变
【答案】A
A.正反应生成NO2的速率和逆反应生成O2的速率之比等于2:
1时,反应达到平衡状态,符合题意,A正确;
B.NO为无色,NO2为红棕色,当混合气体的颜色不再改变,说明NO2的浓度不变,即反应达到平衡状态,不符合题意,B错误;
C.反应前后气体的化学计量数之和不相等,随着反应的进行,容器中的压强不断变化,当容器中的压强不再改变时,说明反应已达到平衡状态,不符合题意,C错误;
D.反应前后气体的化学计量数之和不相等,气体的质量始终不变,随着反应的进行,气体的物质的量不断变化,当气体的物质的量不再改变时,混合气体的平均摩尔质量不再变,说明反应已达到平衡状态,不符合题意,D错误;
答案选A。
【点睛】
混合气体的平均摩尔质量=
。
4.完全燃烧一定质量的无水乙醇,放出的热量为Q,已知为了完全吸收生成的二氧化碳,消耗掉8mol•L-1的氢氧化钠溶液50mL,则1mol无水乙醇的燃烧放出的热量不可能是
A.10QB.10Q~5QC.大于10QD.5Q
n(NaOH)=0.05L×
8mol/L=0.4mol,则由CO2~2NaOH~Na2CO3,可知n(CO2)=0.2mol,则n(C2H6O)=0.5×
n(CO2)=0.1mol,放出的热量为Q,所以1mol乙醇完全燃烧放出的热量为10Q,由CO2~NaOH~NaHCO3可知,n(CO2)=0.4mol,则n(C2H6O)=0.5×
n(CO2)=0.2mol,放出的热量为Q,所以1mol乙醇完全燃烧放出的热量为5Q,若二氧化碳和氢氧化钠反应生成碳酸氢钠和碳酸钠的混合物,则乙醇燃烧放出的热量介于5Q~10Q之间,所以选项C不符合;
故答案选C。
5.下列有关反应速率的说法正确的是()
A.用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以加快反应速率
B.100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.SO2的催化氧化反应是一个放热的反应,所以升高温度,反应速率变慢
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢
【答案】D
A.稀硫酸改为98%的硫酸,铁在浓硫酸中钝化而不能产生氢气,A错误;
B.100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,氯化钠不反应,但稀释了盐酸,氢离子浓度下降,故反应速率下降,B错误;
C.所以升高温度,反应速率加快,C错误;
D.有气体参加的反应,减小压强反应速率变慢,D正确;
答案选D。
6.航天飞船可用肼(N2H4)做动力源,已知液态肼与液态H2O2反应时放出大量的热量,下列说法错误的是
A.1mol肼(N2H4)分子中含有4molN-H键
B.该反应中的热量变化如图所示
C.该反应的反应物总键能小于生成物总键能
D.该反应的化学方程式为:
N2H4(l)+2H2O2(l)=N2(g)+4H2O(g),其产物对环境无污染
【答案】B
A.肼结构式为
,1个肼分子中含有4个N-H键,则1mol肼中含有4molN-H键,故A正确;
B.如果反应物总能量大于生成物总能量,则该反应为放热反应,否则为吸热反应,液态肼和液态过氧化氢反应时放出大量热量,则该反应为放热反应,图中为吸热反应,不符合,故B错误;
C.液态肼和液态过氧化氢反应时放出大量热量,则该反应为放热反应,断键吸收能量、成键放出能量,该反应为放热反应,则反应的反应物总键能小于生成物总键能,故C正确;
D.氮气和水都无毒,所以其产物无污染,故D正确;
故答案为B。
7.原电池是化学电源的雏形。
关于如图所示原电池的说法正确的是
A.能将电能转化为化学能
B.电子从锌片经导线流向铜片
C.锌片为正极,发生氧化反应
D.铜片上发生的反应为Cu2++2e-=Cu
【分析】
Zn、Cu和稀硫酸构成原电池中,锌为负极,发生失去电子的氧化反应,电极反应式为Zn-2e-═Zn2+,铜为正极,发生得到电子的还原反应,电极反应式为2H++2e-=H2↑,电池工作时,电子从负极锌沿导线流向正极铜,内电路中阳离子移向正极Cu,阴离子移向负极Zn,据此解答。
Zn、Cu和稀硫酸构成原电池中,锌为负极,发生失去电子的氧化反应,铜为正极,发生得到电子的还原反应,电极反应式为2H++2e−=H2↑,电池工作时,电子从负极锌沿导线流向正极铜,
A.原电池是将化学能转化为电能的装置,故A错误;
B.Zn、Cu和稀硫酸构成原电池中,锌为负极,铜为正极,电池工作时,电子从负极锌沿导线流向正极铜,故B正确;
C.Zn、Cu和稀硫酸构成原电池中,锌为负极,铜为正极,负极上发生失去电子的氧化反应,故C错误;
D.原电池中,铜为正极,电极反应式为2H++2e−=H2↑,故D错误;
故答案选:
B。
8.如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是()
M
N
P
A
锌
铜
稀硫酸溶液
B
铁
稀盐酸溶液
C
银
硝酸银溶液
D
硝酸铁溶液
A.AB.BC.CD.D
电流计指针偏转,M棒变粗,N棒变细,说明M、N与池中液体构成了原电池。
N棒变细,作负极,M棒变粗,说明溶液中的金属阳离子在M极上得到电子,生成金属单质,M变粗,M做原电池的正极。
A.如果是锌、铜、稀硫酸构成原电池,则电池总反应式为Zn+2H+=Zn2++H2↑,Zn作负极,M极变细,故A错误;
B.如果是铁、铜、稀盐酸构成原电池,电池总反应式为Fe+2H+=Fe2++H2↑,则铁是负极,铜棒M是不会变粗的,故B错误;
C.如果是银、锌、硝酸银溶液构成原电池,电池总反应式为Zn+2Ag+=Zn2++2Ag,则锌是负极,N棒变细,析出的银附在银上,M棒变粗,故C正确;
D.如果是锌、铁、硝酸铁溶液构成原电池,电池总反应式为Zn+2Fe3+=2Fe2++Zn2+,Zn作负极,M极变细,故D错误;
答案选C。
9.Mg-H2O2电池可用于驱动无人驾驶的潜航器。
该电池以海水为电解质溶液,示意图如图。
该电池工作时,下列说法正确的是( )
A.Mg电极是该电池的正极B.H2O2在石墨电极上发生氧化反应
C.石墨电极附近溶液的碱性增强D.溶液中Cl-向正极移动
镁、过氧化氢和海水形成原电池,镁做负极发生氧化反应,过氧化氢在正极上发生还原反应,过氧化氢做氧化剂被还原为OH-,溶液pH增大,原电池中阴离子移向负极。
A.组成的原电池的负极被氧化,镁为负极,不是正极,故A错误;
B.双氧水作为氧化剂,在石墨上被还原变为氢氧根离子,发生还原反应,故B错误;
C.双氧水作为氧化剂,在石墨上被还原变为氢氧根离子,电极反应为,H2O2+2e-=2OH-,故溶液pH值增大,故C正确;
D.溶液中Cl-移动方向与同外电路电子移动方向一致,应向负极方向移动,故D错误;
10.某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液。
下列说法正确的是
A.电子由Zn电极流出,经KOH溶液流向正极
B.正极反应式为2Fe
+
=Fe2O3+5H2O
C.该电池放电过程中电解质溶液浓度不变
D.电池工作时OH-向负极迁移
【解析】
A.电子由电源的负极经导线流向正极,所以电子从锌极经导线流向K2FeO4极,A错误;
B.KOH溶液为电解溶质溶液,则正极电极反应式为:
2Fe
+8H2O+6e-=Fe(OH)3+10OH-,B错误;
C.该电池放电过程中电解质溶液浓度减小,C错误;
D.电池工作时阴离子向负极移动,所以OH-向负极迁移,D正确;
11.反应:
2X(g)+Y(g)
2Z(g)在不同温度和压强下的产物Z的物质的量和反应时间t的关系如图所示,下列判断正确的是()
A.P1>
P2T1>
T2ΔH<
B.P1>
P2T1<
C.P1<
T2ΔH>
D.P1<
根据温度对反应速率的影响可知,压强均为P2时,温度越高,反应速率越大,则达到平衡用的时间越少,曲线的斜率越大,故有:
T1>T2;
根据压强对反应速率的影响可知,温度均为T2时,压强越大,反应速率越大,则达到平衡用的时间越少,曲线的斜率越大,先拐先平压强大,故有:
P1>P2,
比较T1P2与T2P2两曲线,温度越高Z物质的量越少说明升温平衡逆向进行,正反应为放热反应,△H<0;
故答案为A。
图象问题解题步骤:
(1)看懂图象:
①看面(即弄清纵坐标与横坐标的意义);
②看线(即弄清线的走向和变化趋势);
③看点(即弄清起点、拐点、交点、终点的意义);
④看是否要作辅助线(如等温线、等压线);
⑤看定量图象中有关量的多少;
(2)联想规律:
联想外界条件的改变对化学反应速率和化学平衡的影响规律。
12.一定温度下的恒容密闭容器中,反应A2(g)+B2(g)
2AB(g)达到平衡的标志是
A.速率之比ν(A2):
ν(B2):
ν(AB)=1:
1:
B.浓度之比c(A2):
c(B2):
c(AB)=1:
C.单位时间内生成2nmolAB,同时消耗nmolA2
D.各物质的浓度不再改变
A.它们的速率之比虽然等于化学计量数之比,但并不能表示正反应速率和逆反应速率相等,所以A不正确;
B.平衡状态下的各组分的浓度之比通常不等于化学计量数之比,只有它们的浓度不持不变状态才是平衡状态,所以B不正确;
C.单位时间内生成2nmolAB,同时消耗nmolA2,只描述了正反应速率,不能表示正反应速率与逆反应速率相等,所以C不正确;
D.各物质的浓度不再改变,说明各组分的百分含量保持不变了,所以是平衡状态。
一个可逆反应是否处于化学平衡状态可从两方面判断;
一是看正反应速率是否等于逆反应速率,两个速率必须能代表正、逆两个方向,然后它们的数值之比还得等于化学计量数之比,具备这两点才能确定正反应速率等于逆反应速率;
二是判断物理量是否为变量,变量不变达平衡。
13.人们利用原电池原理,制作了多种电池,如电子计算机所用纽扣电池就是其中一种。
它的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应是:
Zn+2OH--2e-═ZnO+H2OAg2O+H2O+2e-═2Ag+2OH-下列判断正确的是
A.锌为正极,Ag2O为负极B.原电池工作时,负极区溶液pH增大
C.锌为负极,Ag2O为正极D.原电池工作时,溶液中K+向负极移动
A.根据电极反应式,锌失电子发生氧化反应,所以锌为负极,故A错误;
B.负极反应Zn+2OH--2e-═ZnO+H2O,消耗氢氧根离子,溶液pH减小,故B错误;
C.锌失电子发生氧化反应,所以锌为负极,故C正确;
D.溶液中K+向正极移动,故D错误。
14.某同学为探究FeCl3与KI反应是否存在反应限度,设计了如下实验方案(FeCl3溶液、KI溶液浓度均为0.1mo1・L-1),最合理的方案是
A.方案1B.方案2C.方案3D.方案4
KI溶液和FeCl3溶液发生氧化还原反应生成Fe2+和I2,反应的离子方程式为2Fe3++2I-═2Fe2++I2,反应后的溶液中加入CCl4,如有机层呈紫红色,则说明生成碘;
向含Fe3+的溶液中滴加几滴KSCN溶液呈血红色,这是Fe3+的特殊反应,所以可滴加KSCN溶液,溶液显血红色,发生Fe3++3SCN-═Fe(SCN)3,就说明Fe3+没有反应完,故D正确。
15.工业废弃物的资源化回收再利用,可以更大限度的发挥原材料的价值。
下图是工业生产纳米磁性氧化铁的流程:
下列说法不正确的是
A.用Na2CO3溶液浸泡是为了除去废铁屑表面的铁锈
B.若生产中不通入N2,暴露在空气中生产,将不能得到高纯度产品
C.加适量的H2O2是为了将部分Fe2+氧化为Fe3+,涉及反应:
H2O2+2Fe2++2H+=2Fe3++2H2O
D.溶液A中Fe2+和Fe3+的浓度比为1:
A.Na2CO3溶液水解显碱性,浸泡废铁屑可以使表面的油脂水解除去,但不能除去表面的铁锈,故A错误;
B.废铁屑被硫酸溶解生成硫酸亚铁,生成的亚铁离子被双氧水部分氧化生成铁离子,形成亚铁离子和铁离子的混合溶液,若生产中不通入N2,暴露在空气中生产,亚铁离子会被空气中的氧气氧化生成铁离子,将不能得到高纯度四氧化三铁产品,其中会混入氧化铁杂质,故B正确;
C.根据B的分析,加适量的H2O2是为了将部分Fe2+氧化为Fe3+,涉及反应:
H2O2+2Fe2++2H+=2Fe3++2H2O,故C正确;
D.根据最终产品为四氧化三铁,其中Fe2+和Fe3+的数目比为1:
2,因此溶液A中Fe2+和Fe3+的浓度比为1:
2,故D正确;
故选A。
16.将一定量纯净的氨基甲酸铵固体置于密闭真空容器中(容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到平衡:
NH2COONH4(s)
2NH3(g)+CO2(g)。
可以判断该反应已经达到平衡的是
A.2v(NH3)=v(CO2)B.容器中总压强不变
C.容器中混合气体的平均相对分子质量不变D.容器中氨气的体积分数不变
A.当v(NH3)正=v(NH3)逆或v(NH3)正=2v(CO2)逆时,即该反应正反应和逆反应速率相等,已经达到平衡,2v(NH3)=v(CO2)不能表明正反应和逆反应速率相等,故A错误;
B.随着NH2COONH4(s)
2NH3(g)+CO2(g)不断进行,容器中总压强会有变化,当总压强不变时,则能表明气体总的物质的量、各成为的物质的量不再变化,该反应已经达到平衡,故B正确;
C.容器中混合气体的平均相对分子质量始终不变,因为混合气体是氨气和二氧化碳按物质的量之比为2:
1混合而成,故C错误;
D.容器中混合气体是氨气和二氧化碳按物质的量之比为2:
1混合而成,氨气的体积分数始终为66.67%,故D错误;
答案选B。
17.某化学反应2X(g)
Y(g)+Z(g)在4种不同条件下进行,Y、Z起始浓度为0,反应物X的浓度(mol·
L
-1)随反应时间(min)的变化情况如下表:
实验
序号
时间
浓度
温度
10
20
30
40
50
60
1
800℃
1.0
0.80
0.67
0.57
0.50
0.60
3
c
0.92
0.75
0.63
820℃
0.40
0.25
0.20
下列说法不正确的是()
A.c>1.0
B.实验2可能使用了催化剂
C.实验3比实验2先达到化学平衡状态
D.前10分钟,实验4的平均化学反应速率比实验
1的大
A.实验3达到平衡X的浓度大于实验1,温度相同,达到平衡说明X起始浓度C大于1.0mol/L,故A正确;
B.实验2和实验1达到相同的平衡状态,但实验2所需时间短说明可能使用了催化剂,催化剂改变反应速率不改变化学平衡,故B正确;
C.依据图表数据分析,实验3在40min时X浓度不变达到平衡,实验2在20min时达到平衡,实验2达到平衡快,故C错误;
D.实验4和实验1在10分钟都未达到平衡,依据化学反应速率概念计算,实验1X的反应速率=
=0.02mol/L•min,实验4X的反应速率=
=0.06mol/L•min,所以实验4反应速率大于实验1,故D正确;
解答时应注意如下几点:
(1)反应达到平衡的过程是(以起始生成物浓度为0为例):
①开始:
反应物浓度最大,生成物浓度为0,正反应速率最大,逆反应速率为0;
②过程中:
反应物浓度不断减小,生成物浓度不断增大,正反应速率不断减小,逆反应速率不断增大;
③平衡时:
反应物浓度和生成物浓度都达到平衡,保持不变,正逆反应速率也保持不变;
(2)化学平衡研究的对象是可逆反应,因此不可能完全转化;
达到化学平衡时,正逆反应速率相等,但不为零。
18.根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是( )
A.H2O分解为H2与O2时放出热量
B.生成1molH2O时吸收热量245kJ
C.甲、乙、丙中物质所具有的总能量大小关系为乙>
甲>
丙
D.氢气和氧气的总能量小于水的能量
由图中信息可知,1molH2断裂共价键变为2molH要吸收436kJ的能量,0.5molO2断裂共价键变为1molO要吸收249kJ的能量,2molH和1molO结合成1molH2O要放出930kJ的能量。
因此,可以算出1molH2和0.5molO2反应生成1molH2O要放出245kJ的能量,反过来,水分解为H2与O2时吸收热量。
综上所述,C正确,本题选C。
19.在一定条件下,向某容器中充入N2和H2合成NH3,以下叙述错误的是()
A.开始反应时,正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,最后减小为零
C.随着反应的进行,逆反应速率逐渐增大,最后保持恒定
D.随着反应的进行,正反应速率逐渐减小,最后与逆反应速率相等且都保持恒定
A.由于发生是从正反应方向开始的,所以开始反应时,正反应速率最大,逆反应速率为零,正确;
B.随着反应的进行,反应物的浓度逐渐减小,生成物的浓度逐渐增大,因此正反应速率逐渐减小,逆反应的速率逐渐增大,最后当正反应与逆反应的速率相等时反应达到了平衡,但是不可能减小为零。
错误;
C.随着反应的进行,逆反应速率逐渐增大,当增大到与正反应速率相等时,反应就达到了平衡状态而最后保持恒定,正确;
D.随着反应的进行,正反应速率逐渐减小,当达到平衡时,正反应速率与逆反应速率相等且都保持恒定,正确。
20.反应Ⅰ:
CaSO4(s)+4CO(g)
CaS(s)+4CO2(g)ΔH1=-175.6kJ·
mol-1反应Ⅱ:
CaSO4(s)+CO(g)
CaO(s)+SO2(g)+CO2(g)ΔH2=+218.4kJ·
mol-1假设某温度下,反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是()
A.
B.
C.
D.
反应Ⅰ为放热反应,反应Ⅱ为吸热反应,因为B、C两图中反应Ⅰ的生成物总能量高于反应物总能量,而反应Ⅱ的生成物总能量低于反应物总能量,则B、C错误。
由题意知:
反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则反应Ⅰ的活化能较大,则A错误、D正确,故选D。
二、实验题
21.硫酸是中学最常见的三大强酸之一,某研究性学习小组探究外界条件对铁与硫酸反应速率的影响。
[实验设计]控制用同种铁块,初始使用硫酸体积均为1000mL,恒定实验温度在298K或313K(其余实验条件见表),设计如下对比试验。
(1)请完成以下实验设计表(表中不要留空格)。
编号
实验目的
T/K
Fe/g
c(H2SO4)/mol·
L-1
①
为以下实验作参考
298
②
探究温度对反应速率的影响
_____
_________
③
18.4
[解释与结论]
(2)实验①、②表明___________
请再提出一种加快该反应速率的方法___________
(