人胰岛素的制备文档格式.docx
《人胰岛素的制备文档格式.docx》由会员分享,可在线阅读,更多相关《人胰岛素的制备文档格式.docx(12页珍藏版)》请在冰豆网上搜索。
前端引物:
5’-ggttccggatctggttctggttctctggtcccccgcggtagtcaccaccaccaccaccaccgttttgtgaaccaacacctgtgcggc-3’
后端引物:
5’-agtgtcgacttagttgcagtagttctccagctggta-3’
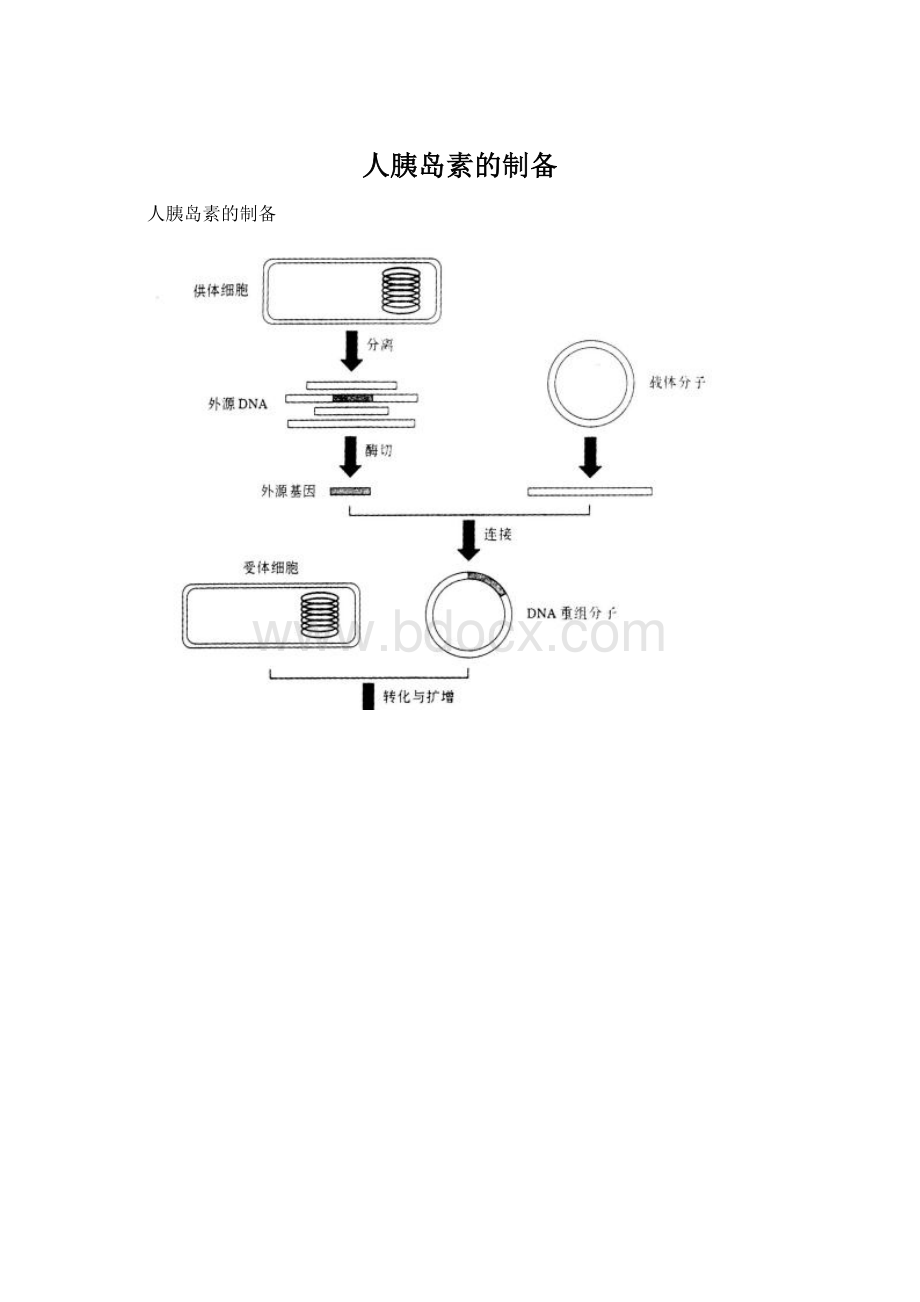
二、组建重组质粒
采用pQE--30质粒作为载体,用双酶切法进行基因重组。
1.双酶切法
用两种酶限制性切核酸酸消化载体DNA和外源DNA片段,使载体和外源目的基因的两端分别形成不同黏性末端,将它们混合,在连接酶的作用下相同的黏性末端可退火连接成重组DNA分子,从而实现DNA的定向连接。
2.重组过程
pQE--30用HindⅢ和BamHⅠ酶切,琼脂糖凝胶电泳分离、回收纯化酶切片段。
外源DNA片段同样也用HindⅢ和BamHⅠ酶切并回收纯化酶切片段。
双酶切后的载体外源DNA片段混合退火,因为HindⅢ和BamHⅠ的黏性末端不匹配,避免了载体和外源DNA片段的自身连接,外源DNA片段只能定向地连接到载体的HindⅢ和BamHⅠ位点之间。
当然也不可避免发生载体的HindⅢ和BamHⅠ的黏性末端之间的两个碱基互补形成开环,转到大肠杆菌中被修复,但这样的重组子占少数,是低效转化。
三、构建基因工程菌
(一)重组人胰岛素的大肠杆菌工程菌的构建
A链和B链同时表达法
将人胰岛素的A链和B链编码序列拼接在一起,然后组装在大肠杆菌-半乳糖苷酶基因的下游。
重组子表达出的融合蛋白经CNBr处理后,分离纯化A-B链多肽,然后再根据两条链连接处的氨基酸残基性质,采用相应的裂解方法获得A链和B链肽段,最终通过体外化学折叠制备具有活性的重组人胰岛素。
重组DNA的转化
1,CaCl2法制备大肠杆菌感受态细胞:
取100ml菌体培养至OD600=0.5,离心收集菌体,用10ml冰冷的10mMCaCl2溶液悬浮菌体,离心,收集菌体,用1ml冰冷的75mMCaCl2溶液悬浮菌体,冰浴放置12-24小时,备用。
2,大肠杆菌感受态细胞的质粒转化:
取100ml感受态细胞,加入相当于50ng载体的重组,DNA连接液,混匀。
冰浴放置半小时。
在42℃保温2分钟(热脉冲),快速将转化细胞转移至冰浴中放置1–2分钟。
加入1ml新鲜培养基,于37℃培养1小时(扩增)。
涂在合适的固体培养基平板上进行筛选。
经典的CaCl2转化方法:
a将培养液转入离心管中,冰上放置10分钟,然后于4℃下3000g离心10分钟。
b弃去上清,用预冷的0.05mol/L的CaCl2溶液10ml轻轻悬浮细胞,冰上放置15-30分钟后,4℃下3000g离心10分钟。
c弃去上清,加入4ml预冷含15%甘油的0.05mol/L的CaCl2溶液,轻轻悬浮细胞,冰上放置几分钟,即成感受态细胞悬液。
d感受态细胞分装成200μl的小份,贮存于-70℃。
e从-70℃冰箱中取200μl感受态细胞悬液,室温下使其解冻,解冻后立即置冰上。
f加入pBS质粒DNA溶液(含量不超过50ng,体积不超过10μl),轻轻摇匀,冰上放置30分钟后。
g42℃水浴中热击90秒或37℃水浴5分钟,热击后迅速置于冰上冷却3-5分钟。
h向管中加入1mlLB液体培养基(不含Amp),混匀后37℃振荡培养1小时,使细菌恢复正常生长状态,并表达质粒编码的抗生素抗性基因(Ampr)。
i将上述菌液摇匀后取100μl涂布于含Amp的筛选平板上,正面向上放置半小时,待菌液完全被培养基吸收后倒置培养皿,37℃培养16-24小时。
(二)重组子的筛选和鉴定(载体遗传标记检测)
1.初筛选
随机挑取转化单菌落,在LB/AK培养基(含100pg/ml氨苄青霉素和50ug/ml卡那霉素)中进行培养,用O.5mmol/LIPTG诱导表达。
表达情况用16.5%SDS.PAGE进行分析。
2.重组菌的后续鉴定
直接电泳检测法
将初筛选获得的重组菌扩大培养后,提取其质粒DNA,通过PCR对其进行扩增,利用有插入片段的重组载体的分子量比野生型载体分子量大,用电泳法检测质粒是否为重组质粒。
目的蛋白表达检验
所得菌体经溶菌酶/超声破碎细胞后得到的包涵体进行SDS—PAGE分析,所需基因工程菌表达的外源蛋(His)6·
Arg-Arg-人胰岛素原以包涵体形式存在,其分子大小约为13kb,经电泳与胰岛素原marker对比,如条带显示有所需目的蛋白,则所得菌既可做工程菌使用,经扩大培养后,斜面保存以便后续使用。
3.工程菌的保藏
15%甘油保存菌种,菌液=20:
80,,充分混匀后,-70度保藏。
四、培养工程菌
优化发酵条件
采用比浊法测定不同时间培养基中菌量,
绘制基因工程菌的生长曲线,在摇瓶培
养的水平下,采用优化的发酵培养基发酵基因工菌,培养4小时候即进入对数生长期,而且对数生长期可延长至17小时。
1,正交优化实验:
采用正交法,选取摇瓶培养条件中七个主要因素进行两水平正交优化,该七个因素为:
种子活化方式,摇床转速(通风量),IPTG诱导温度,接种量,IPTG添加量,诱导时间,补料方式。
分别用A、B、C、D、E、F、G表示.以每升培养基收获湿菌体的量及发酵液的A600为目标量,考察条件优化的效果,进行八次实验,对实验结果进行分析,优化出最佳实验条件。
2,其他条件优化:
在优化发酵条件的基础上,进一步就各种金属元素对苗体生长发重
组蛋白诱导的影响作了分析。
3,放大培养(比较不同发酵工艺产量):
在优化摇瓶水平发酵试验的基础上,放大至1L培养基中比较两种
发酵工艺。
在不同转速,通气量,pH条件下,比较选择产量最高的发酵工艺。
五、产物分离纯化
由于基因工程药物是从转化细胞、而不是从正常细胞生产的,所以对产品的纯度要求也要高于传统产品。
基因工程药物的分离纯化一般不应超过4-5个步骤,包括细胞破碎、固液分离、浓缩与初步纯化、高度纯化直至得到纯品以及成品加工。
发酵液进行细胞分离,分别得到胞产物和胞外产物。
胞外产物直接进行透析浓缩然后进行再复性及酶转化,再对产物进行高度纯化,最后制剂即可。
胞产物用溶酶菌或超声波将细胞破碎,细胞破碎后用高速离心法进行固液分离。
分离后用变性剂或者离子去污剂得到包含体,再用变性剂(尿素)使其变形,接着用二次复性法将其复性。
对复性后的产物进行透析浓缩,然后进行再复性及酶转化,再对产物进行高度纯化,最后制剂即可。
重组蛋白分离纯化的特点
重组蛋白质分离纯化的特点为:
(1)大多数重组蛋白质产品是生物活性物质,在分离纯化过程中,有机溶剂、溶液pH值、离子强度的变化均可使蛋白质变性失活a
(2)重组蛋白质产品在物料中含量很低,凰物料组成非常复杂。
例如,利用基因工襁菌发酵生产蛋白藤,物料中含有大量缀成复杂的培养基、荣体生产代物等,疆拣蛋鑫囊含量嚣豢不瑟蛋鑫凄慈爨鹃1%。
舂些嚣拣鬣囊矮存在予缀懿武或在胞形成包含体,为获敬蛋白质,还需避行细脆破碎,结鬈物料中含有大量的细胞碎片和胞产物。
(3)含蛋白质产晶的物料不稳定,蛋白质产品易受料液中蛋自水解酶降解。
(4)很多熏组蛋白质产品作为医药、食品被人炎利用,因而要求蛋国艨产器必绥是裹癀缝铯瓣,产蘸无萤、兹致热源等。
与传统麓生物大分子分离方式楣镄,蘩缀蛋臼的分离纯纯恣憝秘用其携理稻化学性质的差异,即以分子的大小、形状、溶解度、等电点、祭疏水性以及与其它分子的亲和性等性质建立起来的。
二次复性法:
0.5g包涵体溶解于一定量的缓冲液B(50mmol/LGly—NaOH,8mol/L尿素,B_巯基乙醇,pH9.5)中,使之充分混悬,静置1小时以上。
混悬液分步逐滴加入到缓冲液C(50mmol/LGly-NaOH,半胱氨酸一胱氨酸,pH9.5)中,4℃静置复性过夜。
上样于已用50mmol/LGly—NaOH(pH9.5)平衡的DEAE-SepharoseFF柱,用0.1mol/L的氯化钠梯度洗脱,通过SDS-PAGE确定RRhPI位置,用DEAE-SepharoseFF做离子交换层析,收集含RRhPI的洗脱峰2,层析图谱见(图6)。
电泳检测显示(图11)峰2主要为RRhPI,及少量高分子杂质,收集峰2做再复性。
峰1为pH高于9.5及一些疏水性蛋白质形成的穿透峰,绝大部分pH低于RRhPI的蛋白质和核酸类杂质则牢固地结合在柱子上,在较高盐浓度及2mol/LNaCl的条件下被洗脱下来,形成其他峰3和峰4。
胰岛素原(RRhPI)的再复性及酶切转化:
1,复性
将初步复性及纯化后的RRhPI通过透析浓缩,先后转换到缓冲液B和D(50mmol/LG1y-NaOH,氧化型谷胱甘肽(GSSG)一还原型谷胱甘(GSH)pH9.5)中,使蛋白浓度为0.1~O.6mg/ml,4℃静置过夜。
2,酶切
复性后的RRhPI复性液调节pH后加入一定量的胰蛋白酶(trypsin)
和羧肽酶B(carboxypeptidaseB)在37。
C进行协同酶切一段时间,然
后滴加2mol/LZnCI:
至ZnCl:
浓度为0.1mol/L终止反应并沉淀生成的
hI,用双蒸水洗涤沉淀得较纯B9重组人胰岛素约79mg/L培养基。
重组胰岛素粗品的纯化:
胰岛素粗品用0.2mol/LNaAc·
HAc,pH4.0溶解。
溶解后的样品通过
Superdex75进行纯化(图10),得1、2、3峰,收集峰3,透析后冻干即
为胰岛素产品所得胰岛素产品用SDS-PAGE分析为单带,电泳检测见图。
六、除菌过滤
传统过滤只能滤去空气中的尘埃、液体中的异物微粒,很难去除微生物活体(细菌、病毒及热原体);
薄膜过滤是微孔筛分,大于孔径的微粒均被截留,微生物粒子大小为0.5-2微米,只要选用0.45微米的微孔滤膜即可将微生物截留去除,用0.22微米的微孔滤膜则可能将病毒、热原体去除。
。
注射用药液除用传统过滤器去除药液中的异物外,现已采用微孔滤膜将澄清的药液再次除菌、除热原,其滤膜孔径最好在0.22微米以下。
制药空气的过滤亦因GMP的不同级别要求而采用相应的器材、过滤器。
要指出的是,制药无菌空气的供应仅采用传统滤材、滤器往往不能达到要求,其终端必须选用微孔薄膜,孔径必须在0。
45微米以下。
注射用无菌药液的处理:
按GMP要求,注射用药液应当无菌无热原,本品药液配制好后,经过粗砂棒、细砂棒(适当使用滑石粉或碳粉)过滤成澄明液后,再经过0.45微米多层微孔滤芯除菌,终端通过0.22微米单层超微孔滤膜后上机灌装。
目前,用于过滤器常用的主要过滤材料大致有以下几种:
混合纤维素酯
常用来制成圆形的单片平板滤膜,用于液体和气体的精过滤;
聚丙烯(PP)
做成折叠式,常用于筒式过滤器,有较大的孔径,其具有亲水性,属粗过滤材料;
聚偏二氟乙烯(PVDF)
属精过滤材料,耐热和耐化学稳定,蒸汽灭菌承受性良好,可制成亲水性滤膜,较广泛应用于制药工业无菌制剂用水及注射用水的过滤;
聚醚砜(PES)
做成折叠式,常用于筒式过滤器,耐温耐水解性能好,亲水性材料,用于精度较高的溶液的精过滤;
尼龙
做成折叠式,常用于筒式过滤器,亲水性材料,常用作液体的精过滤;
聚四氟乙烯(PTFE)
做成折叠式,常用于筒式过滤器,疏水性材料,其是使用相当广泛的一种材料,耐热耐化学稳定,常用于水、无机溶剂及空气的精过滤。
除菌过滤器的特点
(1)除菌过滤器一般采用十字悬挂式,水平进出。
多芯过滤器可设计成落地式。
(2)有些使用场合根据实际需要分成预过滤器、精过滤器两种。
(3)空气流向:
从外向穿过滤芯。
(4)进入除菌过滤器的压缩空气必须先经过至少三级的精密过滤器及干燥机。
除油、除水、除尘,油雾浓度应≤0.01PPM,否则将影响除菌滤芯的寿命,达不到预期的除菌效果。
(5)定期杀菌,根据实际使用情况每周或每月1~2次,每次30分钟,采用经过1μ过滤精度的洁净饱和蒸汽杀菌。
蒸汽温度<140℃,蒸汽压力<0.3MPa。
阀门缓慢开关。
(6)作为罐体、设备的呼吸器使用时,其作用主要在于连通大气防止设备部负压和隔离开空气中的污染源,过滤方面的功能不大,因此在过滤上基本无要求。
对胰岛素进行除菌过滤后采用胰岛素冻干粉等冻干技术冻干,既得胰岛素结晶。
经包装等工序后的成品。
如下图:
七、半成品检定
重组人胰岛素半成品检测(检测提取纯化后重组人胰岛素样品):
(一)杂质检定
1,有关物质:
取本品适量,用0.01mol/L盐酸溶液制成每1ml中含3.5mg的溶液,作为供试品溶液。
取供试品溶液20l注入液相色谱仪,记录色谱图,按面积归一化法计算,含A21脱酰胺人胰岛素不得过1.5%,其他有关物质总量不得过2.0%。
2,高分子蛋白质:
取本品适量,用0.01mol/L盐酸溶液制成每1ml中含4mg的溶液,作为供试品溶液。
按照分子排阻色谱法试验。
以色谱用亲水改性硅胶为填充剂(5~10m);
冰醋酸-乙腈-0.1%精氨酸溶液(15:
20:
65)为流动相,流速为每分钟0.5ml,检测波长为276nm。
取重组人胰岛素单体-二聚体对照品,用0.01mol/L盐酸溶液制成每1ml中含4mg的溶液;
取100l注入液相色谱仪,重组人胰岛素单体与二聚体的分离度应符合要求。
取供试品溶液100l,注入液相色谱仪,记录色谱图,除去保留时间大于人胰岛素主峰的其它峰面积,保留时间小于人胰岛素主峰的所有峰面积之和不得过1.0%。
3,锌:
对照品溶液的制备精密量取锌标准溶液(1000μg/ml)5ml,置100ml量瓶中,加0.01mol/L盐酸溶液至刻度,摇匀。
供试品溶液的制备精密称取本品适量,用0.01mol/L盐酸溶液制成每1ml中含锌约0.4~0.8μg的溶液,摇匀。
测定法精密量取对照品溶液,用0.01mol/L盐酸溶液分别稀释成每1ml锌含量为0.20μg、0.40μg、0.60μg、0.80μg、1.00μg的溶液。
将上述各溶液与供试品溶液,照原子吸收分光光度法,在213.9nm的波长处测定,按干燥品计,含锌量不得过1.0%。
4,炽灼残渣:
取本品约0.2g,依法检查,遗留残渣不得过2.0%。
(二)效价测定:
按照高效液相色谱法测定
取本品适量,精密称定,用0.01mol/L盐酸溶液定量稀释至每1ml中约含10单位的溶液(临用新配)。
精密量取20l注入液相色谱仪,记录色谱图;
另取重组人胰岛素对照品适量,同法测定。
按外标法以人胰岛素峰面积(包括A21脱酰胺峰面积)计算,即得。
(三)胰岛素生物测定法
本法系比较胰岛素标准品(S)与供试品(T)引起小鼠血糖下降的作用,以测定供试品的效价。
标准品溶液的制备:
精密称取胰岛素标准品适量,按标示效价,加入每100ml中含有苯酚0.2g并用盐酸调节pH值为2.5的0.9%氯化钠溶液,使溶解成每1ml中含20单位的容易忘,4~8℃贮存,以不超过5天为宜。
标准品稀释液的制备试验当日,精密量取标准品溶液适量,按高低剂量组(ds2,ds1})加0.9氯化钠溶液(pH2.5)制成两种浓度的稀释液,高低剂量的比值(r)不得大于1:
0.5。
高浓度稀释液一般可制成每1ml中含0.06^'
0.12单位,调节剂量使低剂量能引起血糖明显下降,高剂量不致差别。
供试品溶液与稀释液的制备按供试品的标示量或估计效价(AT),照标准品溶液与其稀释液的制备法制成高、低两种浓度的稀释液,其比值(r)应与标准品相等,供试品与标准品高低剂量所致的反应平均值应相近。
测定法取健康合格、同一来源、同一性别、出生日期相近的成年小鼠,体重相差不得超过3g,按体重随机等分成4组,每组不少于10只,逐只编号,各组小鼠分别自皮下注人一种浓度的标准品或供试品稀释液,每鼠0.2^0.3ml,但各鼠的注射体积(ml)应相等。
注射后40分钟,按给药顺序分别自眼静脉丛采血,用适宜的方法,如葡萄糖氧化酶一过氧化酶法测定血糖值。
第一次给药后间隔至少3小时,按双交叉设计,对每组的各鼠进行第二次给药,并测定给药后40分钟的血糖值。
照生物检定统计法(附录XlV)中量反应平行线测定双交叉设计法计算效价及实验误差。
本法的可信限率(FL%)不得大于25%
(四)注射液检测
1,渗透压摩尔浓度:
除另有规定外,静脉输液及椎管注射用注射液按各品种项下的规定,照渗透压摩尔浓度测定法检查,应符合规定。
2,可见异物:
除另有规定外,照可见异物检查法检查,应符合规定。
3,不溶性微粒:
除另有规定外,溶液型静脉用注射液、注射用无菌粉末及注射用浓溶液照不溶性微粒检查法检查,均应符合规定。
3,无菌:
按照无菌检查法检查,应符合规定。
4,细菌毒素或热原:
除另有规定外,静脉用注射剂按各品种项下的规定,照细菌毒素检查法或热原检查法检查,应符合规定。
热原(pyrogen)
1.热原的定义:
注射后能引起人体特殊致热反应的物质。
2.热原的组成:
热原是微生物的代产物,是微生物的一种毒素,大多数细菌都能产生热原,革兰氏阴性杆菌致热力最强。
热原由磷脂、脂多糖和蛋白质所组成的复合物,其中脂多糖是致热活性中心。
脂多糖组成因菌种的不同而异,热原的分子量106左右。
3.热原的危害:
含热原的注射剂输入人体后,约半小时人体就发冷、寒战、体温升高、全身痛、出汗、恶心呕吐等,严重时高烧40度、昏迷、虚脱、甚至死亡。
八、成品检定
重组人胰岛素成品检测(即检测重组人胰岛素注射液样品):
本品为重组人胰岛素的无菌水溶液。
其效价应为标示量的90.0%~110.%。
本品可加入适量的苯酚或间甲酚作抑菌剂。
【鉴别】
(1)取本品,按照重组人胰岛素项下的鉴别项试验,显相同的结果。
(2)在苯酚或间甲酚检查项下记录的色谱图中,供试品溶液中苯酚峰或间甲酚峰的保留时间应与苯酚或间甲酚对照品的保留时间一致。
【检查】
1,有关物质取本品,每1ml中加9.6mol/L盐酸溶液3µ
l酸化,混匀后作为供试品溶液;
取供试品溶液适量(约相当于人胰岛素2单位),按照重组人胰岛素项下的方法检查,扣除苯酚峰和间甲酚峰,按面积归一化法计算,A21脱酰胺人胰岛素不得过2.0%,其他有关物质总量不得过6.0%。
2,高分子蛋白质取本品,每1ml加9.6mol/L盐酸溶液3µ
L酸化,混匀后作为供试品溶液;
取供试品溶液100µ
L,按照重组人胰岛素项下方法检查,除去保留时间大于人胰岛素主峰的其它峰面积,保留时间小于人胰岛素主峰的所有峰面积之和不得过2.0%。
3,锌:
取本品适量,用0.01mol/L盐酸溶液制成每1ml含锌约0.4~0.8μg的溶液作为供试品溶液,按照重组人胰岛素项下的方法检查,每100单位中含锌量应为10~40µ
g。
4,苯酚或间甲酚:
取苯酚或间甲酚(纯度≥99.5%),精密称定,用0.01mol/L盐酸溶液定量稀释制成每1ml中约含苯酚或间甲酚0.25mg的溶液,作为苯酚或间甲酚对照品溶液;
精密量取本品适量,用0.01mol/L盐酸溶液定量稀释成每1ml约含苯酚或间甲酚0.25mg的溶液,作为供试品溶液。
按照重组人胰岛素效价测定项下方法检查,检测波长为270nm。
取重组人胰岛素对照品适量,用苯酚或间甲酚对照品溶液制成每1ml中含重组人胰岛素1mg的溶液,取20µ
l注入液相色谱仪,苯酚峰、间甲酚峰与人胰岛素主峰的分离度应符合要求。
精密量取苯酚或间甲酚对照品溶液及供试品溶液各20µ
L,分别注入液相色谱仪,记录色谱图,按外标法以峰面积计算。
每1ml含苯酚或间甲酚应为2.00~2.75mg。
九、包装
生物制品包装规程
1.同一车间有数条包装生产线同时进行包装时,各包装线之间应有隔离设施。
外观相似的制品不得在相邻的包装线上包装。
每条包装线均应标明正在包装的药品名称、批号。
2.药品的包装和外包装标签的容、格式应符合国家药品监督管理部门的有关规定。
3.包装制品应在25℃以下进行。
有专门规定者应按各论执行。
4.瓶签要求贴牢,直接印字的制品要求字迹清楚,不易脱落或模糊,瓶签容不得用粘贴、剪贴的方式进行修改或补充。
5.制品包装全部完成后,在未收到产品合格证前,应在待检区封存。
收到合格证后,方可填写入库单,交送成品库。
6.每个最小包装盒均应附有药品说明书。
7.药品说明书应符合《中华人民国药品管理法》及国家药品监督管理部门对药品说明书的规定,并根据国家药品监督管理部门批准的容编写。
小组成员:
迪、曾宇、屠言贝、钰英、寒光、温馨、丹、王亮杰、郭正兵、周明毅
查资料:
全体ppt制作:
迪文稿:
钰英