最新中考化学复习专题工艺流程图+ 化学推断题练习Word格式文档下载.docx
《最新中考化学复习专题工艺流程图+ 化学推断题练习Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《最新中考化学复习专题工艺流程图+ 化学推断题练习Word格式文档下载.docx(14页珍藏版)》请在冰豆网上搜索。
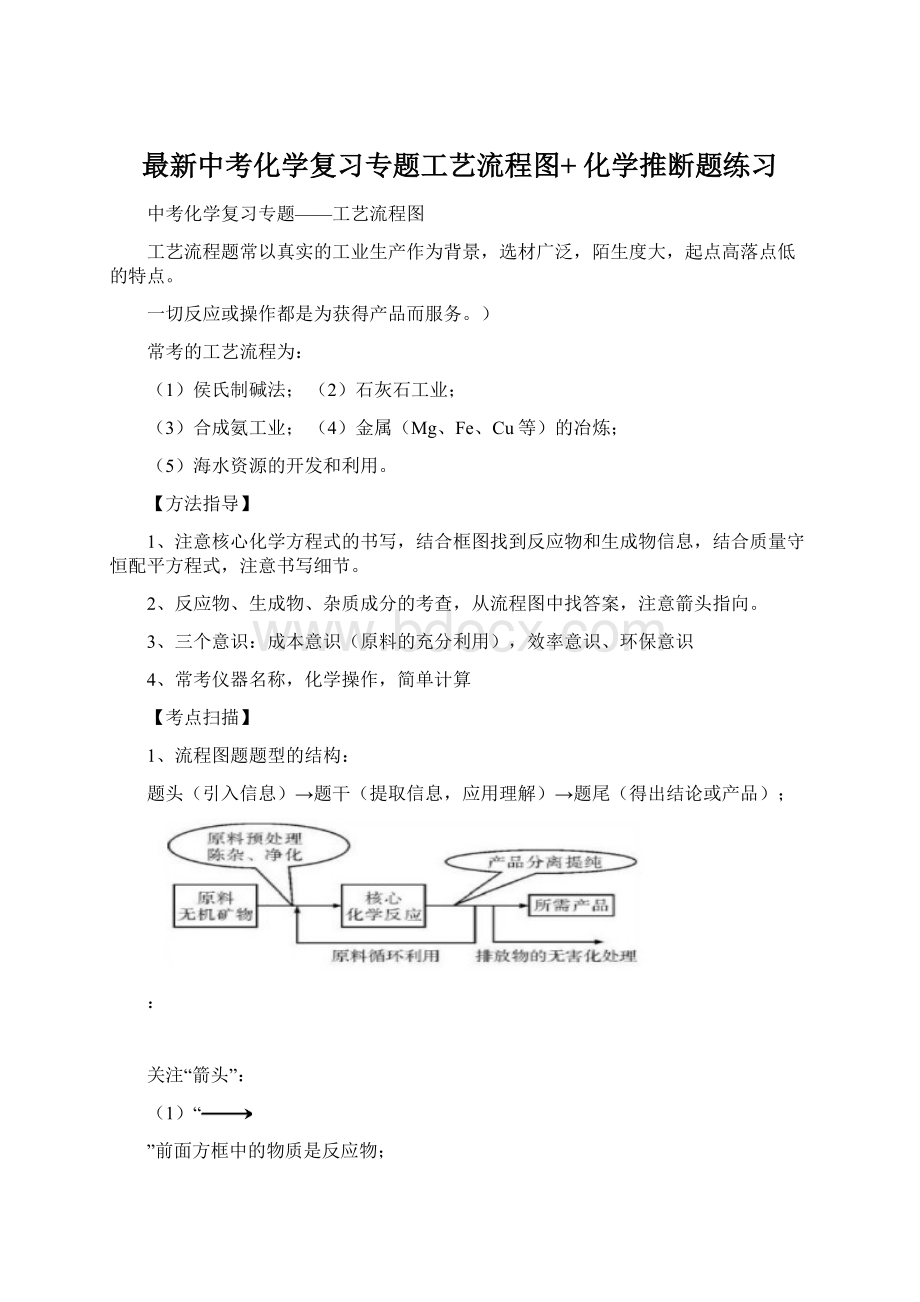
”后面方框中的物质是生成物;
(3)表示一种物质可以向“
”所指方向一步转化为另一种物质。
(4)“
”上面或下面可以注明反应的条件或操作
小结:
1.明确原料及产品;
2.拆分流程,可以方便弄清每一步反应的反应物和生成物;
3.可循环的物质:
过程中既作为前面某步的反应物,在后面某步中又生成了该物质。
【本课小结:
解此类题的注意事项】
1、从绿色化学方面作答:
对综合生产效益有何影响?
如原料成本,原料来源是否广泛、是否可再生,能源成本,对设备的要求,环境保护。
2、常见文字叙述套路
(1)分离可溶物与不溶物:
过滤
(2)从溶液中得到晶体:
蒸发浓缩-冷却结晶-过滤-(洗涤)。
[含结晶水的一般降温结晶]
(3)在写某一步骤是为了除杂是,应该注明“是为了除去某某杂质”。
3、控制反应条件的方法•①pH的控制:
控制溶液的酸碱性使其中某些金属离子形成氢氧化物沉淀•②加热的目的:
加快反应速率•③降温反应的目的:
防止某物质在高温时会溶解•④趁热过滤:
防止某物质降温时会析出•⑤冰水洗涤:
洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗。
⑥搅拌目的:
加快反应速率或加快溶解速率。
例1:
我国制碱工业先驱侯德榜发明了“侯氏制碱法”.其模拟流程如下:
(1)反应①的化学方程式:
_____________,反应②的基本反应类型为:
_____________;
(2)操作a的名称是:
_____________,实验室进行此操作时所需的三个玻璃仪器是:
__________________________;
(3)写出NH4Cl的一种用途:
_____________。
例2:
济宁是山东省重要的煤炭能源基地,矿区废水中Fe2+、Cu2+、Zn2+等严重影响着当地水质,某污水处理厂采用下面工艺(见图)净化这种酸性废水并回收Fe2+、Cu2+、Zn2+三种离子,请读识流程图并回答:
(1)矿区废水经氧化池后在进入沉淀池Ⅰ,目的是________________________________;
(2)利用氢氧化钠调节沉淀池Ⅰ、沉淀池Ⅱ和沉淀池Ⅲ的pH,目的是___________________;
(3)出水前,中和池中加入硫酸的作用________________________________;
(4)若矿区废水中主要含有硫酸盐,请写出沉淀池Ⅲ中发生反应的化学方程式:
__________
______________________________________。
例3:
人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属。
硅钢可用于制造变压器的铁芯,某化学兴趣小组的同学为了验证硅钢(主要含有Fe、C、Si),设计了如图的实验流程(有些反应的部分反应物和生成物已省略)。
查阅资料发现:
常温下,单质硅(Si)不能与盐酸反应,但能与氢氧化钠溶液反应Si+2NaOH+H2O═Na2SiO3+2H2↑。
根据以上信息,回答下列问题:
(1)固体A的成分为__________________,E的化学式为__________________;
(2)滤液B中的金属阳离子为_________;
(3)在过滤操作时,若发现滤液浑浊,应__________________;
(4)步骤⑤中发生的是化合反应,尝试写出其化学方程式__________________。
例4:
我市著名的纸面石膏板企业,用热电厂燃烧煤产生的炉渣来生产石膏板.原理是:
发电过程中产生的烟气中含有大量的SO2,热电厂用“碱-石灰-石膏(CaSO4•2H2O)”的方法使烟气脱硫从而生成石膏。
(1)工业烟气没经处理直接排放到空气中易形成_______________,会污染、破坏环境;
(2)写出吸收塔内发生反应的化学方程式________________________________;
工业上用分离液态空气法制氧气,是利用空气中各成分的___________不同进行分离的;
(3)生产流程中生成的_______________________可循环利用,节约成本.
例5:
工业上以粗盐(含少量MgCl2、CaCl2杂质)为原料,利用电解饱和食盐水的方法制备NaOH,其简要工艺流程如下:
(1)步骤①中发生反应的基本反应类型是______________________;
(2)步骤③中加入适量稀盐酸的目的是_____________________________;
(3)验证步骤②中CaCl2已完全转化为CaCO3的方法是________________________________;
(4)写出步骤④中反应的化学方程式________________________________。
二、中考化学推断题
2.某固体可能含有NaOH、NaCl、Na2CO3、CaCl2、MgCl2五种物质中的一种或几种,为确定其成分,相关实验及现象如下(微溶性物质按可溶处理):
综合分析上述实验,回答下列问题。
(1)原固体中只有一种物质没有确定其是否存在,该物质是________;
(2)形成沉淀c的化学反应方程式是______;
(3)无色溶液A中一定含有的溶质是________。
【答案】氯化钠Na2CO3+CaCl2=CaCO3↓+2NaCl碳酸钠
【解析】
【分析】
氢氧化钠和氯化镁会生成氢氧化镁沉淀,碳酸钠和氯化钙会生成碳酸钙沉淀,碳酸盐沉淀和稀盐酸反应会生成二氧化碳气体,碱性液体使酚酞变红色。
样品加入足量的水过滤,得到白色沉淀a和无色溶液A,溶液A中滴入酚酞变红色,说明溶液显碱性,加入过量的氯化钙,反应生成白色沉淀c和无色液体D,所以A中一定含有碳酸钠,可能含有氢氧化钠;
白色沉淀a中加盐酸会生成无色气体,所以沉淀a中一定含有碳酸盐沉淀,所以样品中一定含有碳酸钠、氯化钙,滤液B和氢氧化钠反应会生成白色沉淀,所以B中一定含有镁离子,所以白色沉淀a中一定含有氢氧化镁,样品中一定含有氯化镁,综合分析可知,样品中一定含有碳酸钠、氯化镁、氯化钙、氢氧化钠,题中的现象不能确定氯化钠是否存在。
【详解】
(1)原固体中只有一种物质没有确定其是否存在,该物质是:
氯化钠;
(2)形成沉淀c的化学反应是:
碳酸钠和氯化钙反应生成碳酸钙和氯化钠。
其化学方程式:
Na2CO3+CaCl2=CaCO3↓+2NaCl;
(3)通过推导可知,A中含有碳酸钠。
3.某固体粉末由氢氧化钠、氯化钠、硫酸铜、硝酸钡、氯化铜中的一种或几种组成,为确定其成分,现进行如下图所示的探究。
请回答下列问题:
(1)溶液C的pH_______(“大于”、“小于”或“等于”)7。
(2)固体粉末中一定含有的物质是___________,一定不含有的物质是__________。
(3)沉淀A溶解的化学方程式为_____________。
(4)溶液E中一定含有的阳离子是____________。
【答案】小于硝酸钡、氯化铜、氢氧化钠硫酸铜Cu(OH)2+H2SO4=CuSO4+2H2O铜离子和钠离子
(1)沉淀A中加入过量稀硫酸得到溶液C,说明溶液C的pH小于7;
(2)由溶液C和溶液B混合生成不溶于酸的沉淀,可知沉淀D为硫酸钡,故固体粉末中一定含有硝酸钡;
又因为沉淀A可以完全被酸溶解,说明沉淀A中不含有硫酸钡,故固体粉末中一定没有硫酸铜;
则沉淀A为氯化铜和氢氧化钠生成的氢氧化铜沉淀;
故填:
硝酸钡、氯化铜、氢氧化钠;
硫酸铜;
(3)沉淀A为氢氧化铜,和稀硫酸反应方程式为Cu(OH)2+H2SO4=CuSO4+2H2O
(4)溶液E与硝酸银反应生成白色沉淀,说明溶液E中有氯离子,且由
(2)推知固体中含有硝酸钡、氯化铜、氢氧化钠,可知溶液E的阳离子为铜离子和钠离子。
4.现有A、B、C、D四种失去标签的溶液,分别是Na2SO4溶液、NaOH溶液、MgSO4溶液、CuSO4溶液中的一种。
不使用任何其他试剂,只用这四种试剂相互反应就可以将它们鉴别出来。
(探究过程)
(1)不用做任何实验直接就可以判断出A溶液,则A为_____溶液,你判断的依据是_____。
(2)分别取B、C、D溶液于试管中,向试管中滴加A溶液,C、D无现象,B有现象,则B为_____溶液,发生的反应方程式为_____。
(3)分别取C、D溶液于试管中,向试管中演加B溶液,D无现象,C中的现象为_____,则C为_____溶液。
(反思拓展)
(4)以上能发生的反应都为_____(填基本反应类型),该反应类型的发生要一定的条件。
(5)请任写出一个有水生成的此类反应_____。
(6)判断NaCl和KNO3,能否发生反应?
_____(如果能,请写出反应方程式:
如果不能,填“否”)
【答案】CuSO4硫酸铜溶液是蓝色的NaOH2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;
白色沉淀MgSO4复分解反应HCl+NaOH=NaCl+H2O否
(1)硫酸铜溶于水显蓝色,不用做任何实验直接就可以判断出A溶液,则A为CuSO4溶液;
(2)分别取B、C、D溶液于试管中,向试管中滴加A溶液,C、D无现象,B有现象,则B为NaOH溶液,发生的反应方程式为2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;
。
(3)分别取C、D溶液于试管中,向试管中演加B溶液,D无现象,C中的现象为白色沉淀,则C为MgSO4溶液。
[反思拓展]
(4)以上能发生的反应都为复分解反应该反应类型的发生要一定的条件。
(5)请任写出一个有水生成的此类反应HCl+NaOH=NaCl+H2O;
(6)NaCl和KNO3,在反应产物中没有水、气体或沉淀,则反应不发生;
(1)CuSO4;
硫酸铜溶液是蓝色的;
(2)NaOH;
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;
(3)白色沉淀;
MgSO4;
(4)复分解反应;
(5)HCl+NaOH=NaCl+H2O;
(6)否。
5.A﹣E是初中常见物质,有如图所示的关系,其中A是单质,B是生活中常用的调味品,C是红色固体,E俗称小苏打.图中“﹣”表示相连的物质两两之间可以发生反应,“→”表示由某一物质可制得另一物质.(部分反应物、生成物及反应条件略去).回答下列问题:
(1)写出B物质的化学式:
B______.
(2)分别写出C与D、D与E反应的化学方程式______________________、_____________________。
(3)由C转化为A的原理在工业上常用于____。
【答案】NaClFe2O3+6HCl=2FeCl3+3H2ONaHCO3+HCl=NaCl+H2O+CO2↑炼铁
B是生活中常用的调味品,故B是氯化钠,E俗称小苏打,E是碳酸氢钠,D能与碳酸氢钠反应,能生成氯化钠,故D是稀盐酸,C是红色固体,能生成单质A,且能与稀盐酸反应,故C是氧化铁,A是铁,经检验,推理合理。
(1)由分析可知,B是氯化钠,化学式为:
NaCl。
(2)氧化铁与稀盐酸反应生成氯化铁和水,反应的方程式为:
Fe2O3+6HCl=2FeCl3+3H2O;
稀盐酸与碳酸氢钠反应生成氯化钠、二氧化碳和水,反应方程式为:
NaHCO3+HCl=NaCl+H2O+CO2↑
(3)氧化铁转化为铁工业上长用于炼铁。
6.利用坐标系建立物质间的关系是总结化学知识的一种方法。
A-M是初中化学常见的九种物质,下图是根据这九种物质的类别和其中某种元素的化合价构建的它们之间的转化关系(图中“→”表示一种物质转换成另一种物质),已知A和水反应放出大量的热。
(1)A的俗名是______________;
(2)H、G均可与M溶液反应,分别生成含该金属元素的两种盐溶液。
G与M的反应常用于工业除锈,该反应的化学方程式为__________________;
(3)D是由三种元素组成的化合物,在B溶液中加入一定量D溶液,过滤后取滤液,滴入过量M溶液,无明显现象,则滤液中的溶质是______(写出所有可能情况,填化学式);
(4)A-H八种物质中能与M溶液反应的物质有________种。
【答案】生石灰Fe2O3+6HCl=2FeCl3+3H2O或Fe2O3+3H2SO4=Fe2(SO4)3+3H2ONaOH、NaOH和Ca(OH)27
本题是推断题,首先要理解和熟记物质的鉴别、推断及其方法,以及与之相关的知识。
然后,根据所给的实验、问题情景或图表信息等,结合所学的相关知识和技能,以及自己的知识或生活经验所得,细致地分析题意等,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可。
(1)根据图示可知,A是某元素+2价氧化物,A和水反应放出大量的热,氧化钙和水反应放出大量的热,A可能是氧化钙,俗名是生石灰;
(2)M是一种酸,H是单质,G是氧化物,H、G都与酸反应生成含该金属元素的两种盐溶液,G与M的反应常用于工业除锈。
G是氧化铁,M是盐酸(或硫酸),已知的元素中铁有+2和+3价,对应的盐有亚铁盐和铁盐,因此H是铁,铁锈的主要成分是氧化铁,氧化铁与盐酸(或硫酸)反应生成氯化铁(硫酸铁)和水,反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O或Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(3)氧化钙与水反应生成氢氧化钙,B是氢氧化钙,E是碱,其中金属元素显+1价,氢氧化钙能转化为E,氢氧化钙与碳酸钠反应生成氢氧化钠和碳酸钙,E可能是氢氧化钠,E能转化为D,D是由三种元素组成的化合物,氢氧化钠与二氧化碳反应生成碳酸钠和水,D可能是碳酸钠,在B溶液中加入一定量
D溶液发生的反应是氢氧化钙与碳酸钠反应产生碳酸钙沉淀和氢氧化钠,过滤后取滤液,滴入过量的F(盐酸或硫酸)溶液无明显现象,说明碳酸钠没有剩余,氢氧化钙可能剩余,因此滤液中的溶质可能是NaOH、NaOH和Ca(OH)2;
(4)氢氧化钙能转化为C,氢氧化钠能转化为C,C是盐,则C是碳酸钙。
M是酸,A-H八种物质中能与能与酸发生反应的有A(氧化钙),B(氢氧化钙),C(碳酸钙),D(碳酸钠),E(氢氧化钠),H(铁),G(氧化铁)7种
7.下列框图中的物质均为初中化学常见物质,其中A为大理石主要成分,F是黑色粉末,H是蓝色沉淀,如图是它们之间的转化关系,请回答:
(1)写出下列物质的化学式:
A_____,D_____,F_____.H______
(2)写出G+E→H的化学方程式:
_____.
(3)写出物质B的一种用途:
【答案】
灭火剂
A为大理石主要成分,则A是碳酸钙,A高温生成B和C,则B和C可能是氧化钙和二氧化碳,C和水反应生成D,D和碳酸钠反应生成E,则C是氧化钙,D是氢氧化钙,B是二氧化碳,E是氢氧化钠,H是蓝色沉淀,则H是氢氧化铜,G中含有铜离子,F和稀硫酸反应生成G,则F是氧化铜,G是硫酸铜。
(1)A为大理石主要成分,则A是碳酸钙,化学式为
,A高温生成B和C,则B和C可能是氧化钙和二氧化碳,C和水反应生成D,D和碳酸钠反应生成E,则C是氧化钙,D是氢氧化钙,化学式为
,B是二氧化碳,E是氢氧化钠,H是蓝色沉淀,则H是氢氧化铜,化学式为
,G中含有铜离子,F和稀硫酸反应生成G,则F是氧化铜
(2)E是氢氧化钠,G是硫酸铜,G和E反应生成氢氧化铜蓝色沉淀和硫酸钠,G+E→H的化学方程式为
(3)A高温生成B和C,则B和C可能是氧化钙和二氧化碳,C和水反应生成D,D和碳酸钠反应生成E,则C是氧化钙,D是氢氧化钙,B是二氧化碳,物质B的一种用途灭火剂。
【点睛】
A为大理石主要成分,则A是碳酸钙,H是蓝色沉淀,则H是氢氧化铜,F和稀硫酸反应生成G,则F是氧化铜,G是硫酸铜。
8.A∼E是初中化学常见的五种不同类别的物质,C常用作建筑材料,E常用作食品干燥剂。
他们之间的关系如图所示,“−”表示相连的物质能发生反应,“→”表示一种物质能生成另一种物质(部分反应物、生成物和反应条件已略去).
请回答下列问题:
(1)E的化学式是_____。
(2)D转化为C的化学方程式_____,反应现象是_____。
(3)A与B反应的化学方程式_____,其基本反应类型为_____。
出现白色沉淀
置换反应
A∼E是初中化学常见的五种不同类别的物质,C常用作建筑材料,则C为碳酸钙,属于盐,E常用作食品干燥剂,则E是氧化钙,属于氧化物,E能生成D,D能生成C,则D是氢氧化钙,属于碱,B能和D、C反应,则B是酸,则B是盐酸,A和B反应,则A是金属单质。
(1)E常用作食品干燥剂,则E是氧化钙,故E的化学式是
(2)C常用作建筑材料,则C为碳酸钙,E能生成D,D能生成C,则D是氢氧化钙,D转化为C的反应是氢氧化钙和二氧化碳反应生成碳酸钙和水,化学方程式为
,反应现象是出现白色沉淀。
(3)B能和D、C反应,则B是酸,则B是盐酸,A和B反应,则A是金属单质,A可以是铁,故A与B反应的化学方程式
,反应符合一种单质和一种化合物生成另一种单质和另一种化合物的反应,故基本反应类型为置换反应。
C常用作建筑材料,则C为碳酸钙,E常用作食品干燥剂,则E是氧化钙,E能生成D,D能生成C,则D是氢氧化钙。
9.图中的六个圆A、B、C、D、E、F分别表示六种物质,蓝色溶液A与C反应能生成两种沉淀,B为氧化物,D、E、F分别是碳酸钠溶液、稀硫酸、和氢氧化钠溶液中的一种,E中溶质可用于生产洗涤剂。
用“→”表示一种物质能转化为另一种物质,用两圆相切或“——”表示两种物质可以发生化学反应,六种物质之间的部分反应及转化关系如右图所示。
请利用初中化学知识回答下列问题:
(1)写出A、E的化学式_______、_______;
(2)C与F反应的化学方程式为____________;
(3)试写出一个有B生成的置换反应的化学方程式__________。
【答案】CuSO4Na2CO3Ba(OH)2+H2SO4=BaSO4↓+2H2OH2+CuO
Cu+H2O
试题分析:
E中溶质可用于生产洗涤剂,那么E是碳酸钠;
A是蓝色溶液,说明溶液A中含有铜离子;
根据蓝色溶液A与C反应能生成两种沉淀可知其中一种沉淀是氢氧化铜沉淀,故C中含有氢氧根离子;
根据转化关系,C能与F发生化学反应,故D一定是氢氧化钠,F是硫酸。
碳酸钠能与C反应,C含有氢氧根离子,根据复分解反应发生的条件,故C可能是氢氧化钙或氢氧化钡;
又由于含有铜离子的A与C反应会生成两种沉淀,故C只能是氢氧化钡,那么A是硫酸铜;
B为氧化物,且氢氧化钡能转化为B,故B是水。
考点:
物质的推断
10.图中的A、B、C、D、E、F、G都是初中化学中的常见物质。
其中A是盐,常用做建筑材料,B是人体胃液中所含有的一种酸,C是植物光合作用的一种原料,E是盐,广泛用于玻璃、造纸、纺织和洗涤剂的生产等,F、G是碱。
它们之间存在以下转化关系(图中部分生成物已略去)。
(1)写出物质A、B的化学式:
A_____B_____;
(2)写出
反应的化学方程式:
_____
(3)写出物质G在实验室必需密封保存的原因:
_____。
【答案】CaCO3HClNa2CO3+Ca(OH)2═CaCO3↓+2NaOH吸水潮解,与CO2反应
根据A、B、C、D、E、F、G都是初中化学中的常见物质,A是一种盐,常用作建筑材料,所以A是碳酸钙,B是人体胃液中所含的一种酸,所以B是盐酸,C是植物光合作用的一种原料,碳酸钙和盐酸反应生成无色溶液D和C,C和碱F反应会生成碳酸钙,所以C是二氧化碳,E是盐,广泛用于玻璃、造纸、纺织和洗涤剂的生产等,所以E是碳酸钠,二氧化碳和G反应会生成碳酸钠,所以G是氢氧化钠,二氧化碳和碱F会生成碳酸钙,所以F是氢氧化钙。
(1)A、B、C、D、E、F、G都是初中化学中的常见物质,A是一种盐,常用作建筑材料,所以A是碳酸钙,B是人体胃液中所含的一种酸,所以B是盐酸,故A是
,B是
(2)碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:
(3)物质G在实验室必需密封保存的原因是:
吸水潮解,与
反应。
A是一种盐,常用作建筑材料,所以A是碳酸钙,B是人体胃液中所含的一种酸,则B是盐酸,C是植物光合作用的一种原料,则C是二氧化碳,E是盐,广泛用于玻璃、造纸、纺织和洗涤剂的生产等,则E是碳酸钠。