浙江省杭州市学年八年级下册科学期末复习第三章 空气与生命综合训练带答案Word格式文档下载.docx
《浙江省杭州市学年八年级下册科学期末复习第三章 空气与生命综合训练带答案Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《浙江省杭州市学年八年级下册科学期末复习第三章 空气与生命综合训练带答案Word格式文档下载.docx(19页珍藏版)》请在冰豆网上搜索。
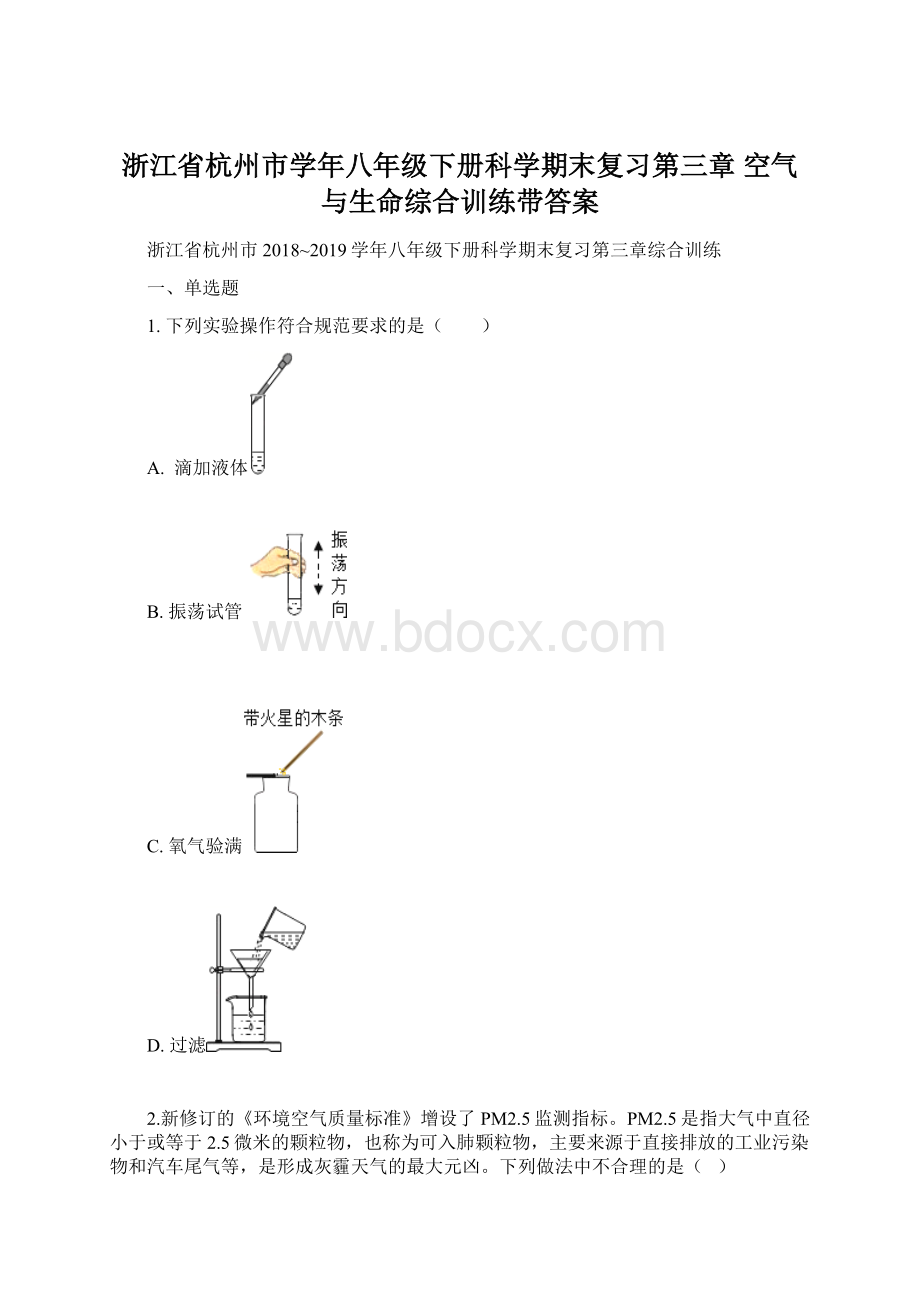
)
磷在氧气中燃烧,可看到产生大量的白烟
硫在氧气中燃烧,可看到产生淡蓝色的火焰
铁丝在氧气中燃烧,可看到火星四射
木炭在氧气中燃烧,可看到发白光
6.在试管甲中放入15g氯酸钾,试管乙中放入15g氯酸钾和一定量的MnO2,分别加热并充分反应。
下图对该实验产生气体的质量与反应时间的关系,合理的是(
7.实验室常用加热高锰酸钾的方法制取氧气。
现对一定量的高锰酸钾固体进行加热,加热过程中涉及到的相关量随反应时间变化的图像正确的是(
8.点燃的蜡烛在如图1所示密闭装置内燃烧一段时间后会自动熄灭,用仪器测出这一过程中瓶内氧气含量的变化如图2所示。
下列判断正确的是(
蜡烛燃烧前装置内只有氧气
装置内物质总质量不断减少
有氧气蜡烛也不一定燃烧
蜡烛熄灭后,瓶内只剩下二氧化碳气体
9.在验证“绿叶在光下制造淀粉”的实验中,要对图甲的叶片进行脱色处理,处理方法如图乙所示,图乙中大烧杯内盛放液体A,小烧杯内盛放液体B,下列说法正确的是(
甲
乙
液体A,B都是清水
液体A,B都是酒精
液体A是清水、液体B是酒精
液体A是酒精、液体B是清水
10.如图是人体在平静状态下呼吸运动的部分示意图。
有关图示运动状态的叙述,错误的是(
膈肌呈舒张状态,膈顶部上升
肋间外肌呈收缩状态,肋骨下降
胸廓的容积缩小,肺也随着回缩
此时肺内的气压大于外界气压
11.下列对质量守恒定律的理解错误的是(
质量守恒定律只适用于化学反应,不适用于物理变化
质量守恒定律研究的内容仅是指“质量”,不能推广到其他物理量
催化剂可以改变其他物质的化学反应速率,有催化剂参加的反应也遵守质量守恒定律
蜡烛燃烧后质量减轻,不符合质量守恒定律
12.在一定条件下,每10个X2分子和30个Y2分子恰好完全反应,生成20个Z分子,则Z分子的化学式为(
XY
XY2
XY3
X2Y3
13.小明旅游时经常使用一种用纸代替金属材料制成的锅煮面,轻便易携带,你觉得煮面时纸锅不会被烧掉的原因是(
面汤隔绝了氧气使纸锅不能燃烧
面汤使纸锅的着火点升高了
纸锅的着火点很高
加热时面汤蒸发吸热使纸锅温度达不到其着火点
14.我们曾经做过以下一组对比实验,该对比实验得出的结论是(
①CO2密度比空气密度大
②CO2能够与水发生化学反应
③CO2不能使干石蕊纸花变色
④CO2不支持燃烧
①②
②③
③④
①④
15.实验室制取CO2有以下步骤:
①连接好装置;
②向试管中小心放入几小块石灰石;
③向试管中小心注入适量稀盐酸;
④检查装置的气密性;
⑤收集产生的气体;
⑥用燃烧的木条检验集气瓶是否收集满CO2,以上操作按由先至后的顺序排列正确的是(
①②③④⑤⑥
①④②③⑤⑥
①③②④⑤⑥
③①②④⑤⑥
16.呼吸运动是人重要的生命活动,下列有关说法错误的是(
呼吸时,呼出的气体成分中二氧化碳多于氧气
氧气从外界进入人体内血液的路线是:
鼻→咽→喉→气管→支气管→肺泡→肺泡周围的毛细血管网
吸气时,膈肌收缩,膈顶部下降,胸腔容积扩大
呼出的气体中不仅含有二氧化碳气体,还含有氧气
17.在一密闭容器内有氧气、二氧化碳、水蒸气和一种未知物W,在一定条件下充分反应,测得反应前后各物质的质量如表所示,则下列说法中错误的是(
)。
根据质量守恒定律,X的值应为0
反应后的生成物是二氧化碳和水
氧元素的化合价在反应前后发生改变
物质W只含碳、氢两种元素
18.如图表示一段时间内某植物叶片吸收二氧化碳与光照强度关系示意图,以下分析正确的是(
ac段表示该植物的光合作用不断地增强
b点表示该植物既不进行光合作用,也不进行呼吸作用
当光照强度>n1时,该植物呼吸作用停止
当光照强度>n2时,表示该植物不再进行光合作用
19.现有32g某可燃物在密闭容器中可完全燃烧后,测得生成88g二氧化碳和72g水,关于该可燃物的说法正确的是(
一定是氧化物
一定含有碳、氢元素,可能含有氧元素
一定含有碳、氢、氧三种元素
只含有碳、氢两种元素
20.分析推理是学习化学常用的一种思维方法,下列各选项分析推理关系成立的是(
用带火星的木条伸入集气瓶中木条不复燃,则集气瓶中一定不含有氧气
水电解产生氢气和氧气,所以水是由氢气和氧气组成的
化合物是由不同种元素组成的纯净物,所以只含一种元素的物质一定不是化合物
甲烷燃烧生成二氧化碳和水,所以甲烷是由碳、氢、氧三种元素组成的
二、填空题
21.现有①氧气;
②二氧化碳;
③氮气;
④稀有气体四种物质,请用上述物质的序号填空:
空气是一种重要的自然资源,空气中的各种成分可以广泛应用于生产和生活中,其中约________占空气体积的78%,是工业上生产硝酸和化肥的重要原料;
人类维持生命不可缺少的气体是________,燃烧也离不开它;
________虽然几乎不与任何物质发生化学反应,但是也有很广泛的用途,如制造电光源等;
________是植物进行光合作用不可缺少的物质。
22.钢丝棉亦为钢纤维、钢羊毛,它是将铁制成0.125--0.189毫米的细丝而组成,钢丝棉在空气中用明火即能点燃,剧烈燃烧时火星四射。
(1)请写出钢丝棉燃烧的化学方程式________
(2)钢丝棉在空气中可以直接点燃,剧烈燃烧,比普通的铁丝易燃,其原因是________
23.图甲为呼吸系统模式图,图乙为人体在平静呼吸时胸廓容积变化示意图,图丙为肺泡与毛细血管之间的气体交换示意图。
请据图回答下列问题:
甲
乙
丙
(1)图甲中的A是人体呼吸系统最重要的器官________,图乙表示人体吸气过程的是________(填“D”或“E”),请结合图甲、图乙叙述人体的吸气过程:
________。
(2)图丙中1代表的物质是________。
24.如图是某一变化过程的微观示意图,请根据图回答下列问题:
(1)请写出上述化学反应的方程式________。
(2)化学变化前后一定不变的是(
)(填序号)。
A.元素种类B.原子种类C.分子数目D.原子数目。
(3)
和
的化学性质不同的原因是________。
25.曲线A表示叶片光合作用每小时合成有机物的质量与温度的关系(光照强度为E时),曲线B表示该叶片呼吸作用每小时分解有机物的质量与温度的关系。
据图回答:
(1)曲线ab段表明________。
(2)菜农在光照强度为E的温室内栽培该种蔬菜,温度最好控制在________左右。
(3)若要提高栽培蔬菜的产量,你认为晚上可采取哪些措施?
26.现有A、B、C、D四种元素,A为地壳中含量最多的元素;
B少量存在于煤中,它燃烧产生的气体是导致酸雨或大气污染的主要气体;
C的原子核内,通常无中子;
D的单质是一种黑色的固体,在空气中完全燃烧只生成二氧化碳气体。
请回答下列问题:
(1)写出元素名称:
A:
________;
B:
C:
D:
(2)写出下列物质的名称:
由两种元素组成生活中不可缺少的呈液态的化合物是________;
由两种元素组成的人体呼吸排出的气体是________。
三、实验探究题
27.研究表明,许多金属氧化物对氯酸钾分解有催化作用,分别用下列金属氧化物作催化剂,氯酸钾开始发生分解反应和反应剧烈时的温度如表所示:
温度/℃
Fe2O3
Al2O3
CuO
MgO
开始反应
470
515
305
49
剧烈反应
490
540
350
545
(1)上述实验中,从温度对反应催化效果来看,最好选用________作催化剂.
(2)加热氢氧化铜固体可制得氧化铜和一种常见液体物质,写出该反应的化学方程式________。
探究:
氧化铜与二氧化锰的催化效果哪一个更好?
用如图装置进行实验,实验均以生成25mL气体为准,可能影响实验的其他因素均以忽略,记录实验数据如下表:
序号
KClO3质量
催化剂质量
待测数据
①
2.45g
﹣
a
②
0.51gMnO2
b
③
0.51gCuO
c
(3)实验①的作用________;
上述实验中的“待测数据”处应填________。
若b________c,(填“>”、“=”或“<”)可知在某温度下氧化铜对氯酸钾分解效果更好。
28.为“证明绿色植物光合作用能产生氧气”,小科设计了如图所示的实验。
回答:
(1)本实验选择水生绿色植物金鱼藻作为实验材料而不选用盆栽的天竺葵,其理由是:
(2)利用上述实验装置与材料,设计“证明光照是绿色植物光合作用的条件”的实验(写出简要的实验思路)。
29.小李学习了有关二氧化碳的知识后,进行了二氧化碳气体在水中的溶解性的探究,其实验步骤及装置如下:
①用大号针筒抽取200毫升二氧化碳气体。
②向试剂瓶中加入200毫升水(恰好加满),塞紧双孔橡皮塞。
③连接大号针筒和试剂瓶,缓慢推动活塞,将二氧化碳注入水中。
(1)试剂瓶中加入的水应是
。
蒸馏水
自来水
(2)推动活塞时应尽量缓慢,其目的是________
(3)当向水中注入CO2气体体积达到120毫升时,红色油柱开始向上移动。
实验表明在该条件下,1体积水中能溶解________体积的二氧化碳。
30.利用图示仪器通过测量氧气体积来测定高锰酸钾样品的纯度(杂质不参加反应)。
实验步骤如下:
(1)检查气密性:
连好发生装置后,将导管口的下端浸入水中,________,如果观察到导管口有气泡冒出,就证明装置不漏气。
(2)组装装置:
连好的装置如图甲,其中有一处明显错误。
在不移动、不调整酒精灯的前提下,需要调节________
(填字母)螺母改正错误。
(3)进行实验:
采用正确的反应装置和如图乙所示的收集装置制取并收集气体。
下列说法正确的是
加热时间过短,会使测量结果不准
反应一段时间,排出反应装置内原有空气再连接乙装置收集气体,会使结果更准确
四、计算题
31.工业上用电解氧化铝的方法制取单质铝的化学通电方程式为:
,电解10t氧化铝最多可生产多少吨铝?
小丽和小明两位同学分别采用了如图两种不同的计算方法。
请你回答下列问题:
(1)你认为他们的解题思路和方法都正确吗?
________
(2)对“34g过氧化氢完全分解产生氧气的质量为多少克?
”一题,你认为也能用上述两种方法解答吗?
试试看,请把能用的解法过程写出来。
(3)你认为在什么情况下,小丽和小明同学的解法都能使用?
32.某化学兴趣小组为测定一种石灰石样品中碳酸钙的质量分数,称取25.0g石灰石样品,
加入200.0g稀盐酸恰好完全反应,剩余物质的总质量为216.2g.
请回答:
(要求写出计算过程,计算结果本领一位小数)
(1)生成二氧化碳的质量.
(2)石灰石样品中碳酸钙的质量分数.
(3)求反应后所得溶液中溶质的质量分数.
33.小强同学前往当地的石灰石矿区进行调查,他取回了若干块矿石样品,对样品中碳酸钙的质量分数进行检测,采用如下办法:
取用8g这种石灰石样品,把40g稀盐酸分4次加入,测量过程所得数据见下表(已知石灰石样品中含的杂质不溶于水,不与盐酸反应).请计算:
加入稀盐酸质量(g)
剩余固体质量(g)
第1次
10
5.5
第2次
M
第3次
1.2
第4次
N
(1)表中m的数值为________,n的数值应该为________;
(2)样品中碳酸钙的质量分数是________;
(3)通过计算,求反应中生成二氧化碳气体的质量.
34.某同学为了测定黄铜屑(由锌、铜形成的合金)样品的组成,取样品100g放入烧杯中,把200g稀硫酸平均分成4等份,分4次加入到烧杯中,每次都在充分反应之后测量出烧杯内混合物的质量,并记录如表:
次数
烧杯内混合物质量/g
149.6
199.2
249.0
299.0
(1)黄铜样品中锌的质量为________
g.
(2)计算所用稀硫酸中溶质的质量分数.
35.解决问题常面临着方法的选择,面对不同的结果我们应继续探索。
为得知15.8g高锰酸钾完全分解能产生多少克氧气,小柯与小妍分别采取了以下方法:
(1)在本实验条件下,氧气的密度为1.4×
l0一3g/mL,则由小柯的测量结果可算出15.8g高锰酸钾分解后所产生的氧气质量为________g(结果保留一位小数)。
(2)老师提醒小柯,其实可以直接用天平测量出反应产生的气体质量,请简述该测量方案:
(3)大家经过讨论,认为小妍的计算方法明显错误,本题不能采用该方法计算氧气质量的理由是________。
高锰酸钾中含氧元素
锰酸钾和二氧化锰中含氧元素
氧气中含氧元素
(4)请在答卷上列式计算15.8g高锰酸钾完全分解所产生的氧气质量。
(注意格式)
(5)若实验操作无误,不考虑实验中的误差,针对小柯的测定结果与你的计算结果,请提出一种合理的猜测:
答案
1.C2.D3.A4.D5.B6.C7.D8.C9.C10.B
11.D12.C13.D14.B15.B16.A17.D18.A19.D20.C
21.③;
①;
④;
②
22.
(1)3Fe+2O2
Fe3O4
(2)钢丝棉很细,与氧气接触更充分,遇明火易燃
23.
(1)肺;
D;
吸气时,膈肌收缩、横膈膜变得扁平的同时,肋间外肌收缩,肋间内肌舒张,肋骨向上、向外移动。
此时,胸腔体积增大,内压力减小,空气顺着呼吸道进入肺中,人就吸气
(2)二氧化碳
24.
(1)2CO+2NO
N2+2CO2
(2)A、B、D(3)分子构成不同
25.
(1)在一定温度范围内,叶片光合作用每小时合成有机物的质量随温度的升高而增加
(2)20℃(3)适当增加光照,降低温度
26.
(1)氧;
硫;
氢;
碳
(2)水;
二氧化碳
三、实验探究题
27.
(1)CuO
(2)Cu(OH)2
CuO+H2O(3)对照;
收集25mL氧气所需的时间
;
>
28.
(1)便于观察和收集产生的气体
(2)准备相同的两组实验装置分别加入等量、生长状况一致的金鱼藻,一组予以光照,一组遮光;
用带火星木条检验试管中收集到的气体,判断植物是否进行了光合作用
29.
(1)A
(2)使二氧化碳充分溶解(3)0.6
30.
(1)用手紧握试管
(2)AB(3)A
31.
(1)他们的解题思路和方法都正确,因为小丽用的是“根据化学方程式的计算”,小明用的是“根据元素的质量分数的计算”。
(2)本题不能用小明的方法解答,因为过氧化氢完全分解后,氧元素没有都在氧气中,还有一部分在水中,设产生氧气的质量为x
2H2O2
2H2O+O2↑
68
32
34g
x
x=16g
(3)根据质量守恒定律,小丽的解法在任何情况下都能使用。
小明的方法只有在花儿无分解后,所求元素的质量没有被分解其他物质中的时候才能使用。
32.
(1)解:
根据质量守恒定律,二氧化碳的质量为:
25.0g+200.0g﹣216.2g=8.8
答:
生成二氧化碳的质量为8.8g
(2)解:
该该石灰石样品中碳酸钙的质量为x,生成氯化钙的质量为y
CaCO3+
2HCl═
CaCl2+H2O+
CO2↑
100
111
44
x
y
8.8g
=
x=20.0g
y=22.2g
石灰石样品中碳酸钙的质量分数为
×
100%=80%
石灰石样品中碳酸钙的质量分数为80%
(3)解:
反应后所得溶液中溶质的质量分数
100%≈10.5%
反应后所得溶液中溶质的质量分数为10.5%
33.
(1)3;
(2)85%
设与6.8g碳酸钙反应生成二氧化碳的质量为x.
6.8g
x=2.992g
8克该样品与足量稀盐酸反应后可产生二氧化碳的质量为2.992g
34.
(1)32.5
第一加入稀硫酸生成氢气的质量为:
100g+50g﹣149.6g=0.4g
设参加反应的稀硫酸的质量为y
Zn+
H2SO4═ZnSO4+
H2↑
98
2
0.4g
y=19.6g
所以稀硫酸中溶质的质量分数为:
100%=39.2%
35.
(1)1.8
(2)用天平测量反应前后试管及内部固体的总质量,相减便是产生的气体质量(3)B
(4)
2KMnO4
K2MnO4
MnO2
O2↑
316
15.8g
x=1.6g
(5)锰酸钾继续分解产生氧气