最新高一化学必修一知识点归纳总结Word格式文档下载.docx
《最新高一化学必修一知识点归纳总结Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《最新高一化学必修一知识点归纳总结Word格式文档下载.docx(18页珍藏版)》请在冰豆网上搜索。
Cl-AgNO3、稀HNO3产生白色沉淀Cl-+Ag+=AgCl↓
SO42-稀HCl、BaCl2白色沉淀SO42-+Ba2+=BaSO4↓
四.除杂
注意事项:
为了使杂质除尽,加入的试剂不能是“适量”,而应是“过量”;
但过量的试剂必须在后续操作中便于除去。
五、物质的量的单位――摩尔
1.物质的量(n)是表示含有一定数目粒子的集体的物理量。
2.摩尔(mol):
把含有6.02×
1023个粒子的任何粒子集体计量为1摩尔。
3.阿伏加德罗常数:
把6.02×
1023mol-1叫作阿伏加德罗常数。
4.物质的量=物质所含微粒数目/阿伏加德罗常数n=N/NA
5.摩尔质量(M)
(1)定义:
单位物质的量的物质所具有的质量叫摩尔质量.
(2)单位:
g/mol或g.mol-1(3)数值:
等于该粒子的相对原子质量或相对分子质量.
6.物质的量=物质的质量/摩尔质量(n=m/M)
六、气体摩尔体积
1.气体摩尔体积(Vm)
(1)定义:
单位物质的量的气体所占的体积叫做气体摩尔体积.
(2)单位:
L/mol
2.物质的量=气体的体积/气体摩尔体积n=V/Vm
3.标准状况下,Vm=22.4L/mol
七、物质的量在化学实验中的应用
1.物质的量浓度.
(1)定义:
以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的浓度。
(2)单位:
mol/L(3)物质的量浓度=溶质的物质的量/溶液的体积CB=nB/V
2.一定物质的量浓度的配制
(1)基本原理:
根据欲配制溶液的体积和溶质的物质的量浓度,用有关物质的量浓度计算的方法,求出所需溶质的质量或体积,在容器内将溶质用溶剂稀释为规定的体积,就得欲配制得溶液.
(2)主要操作
a.检验是否漏水.b.配制溶液1计算.2称量.3溶解.4转移.5洗涤.6定容.7摇匀8贮存溶液.
A选用与欲配制溶液体积相同的容量瓶.B使用前必须检查是否漏水.C不能在容量瓶内直接溶解.D溶解完的溶液等冷却至室温时再转移.E定容时,当液面离刻度线1―2cm时改用滴管,以平视法观察加水至液面最低处与刻度相切为止.
3.溶液稀释:
C(浓溶液)•V(浓溶液)=C(稀溶液)•V(稀溶液)
第二章:
化学物质及其变化
一、物质的分类
把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,叫分散系。
被分散的物质称作分散质(可以是气体、液体、固体),起容纳分散质作用的物质称作分散剂(可以是气体、液体、固体)。
溶液、胶体、浊液三种分散系的比较
分散质粒子大小/nm外观特征能否通过滤纸有否丁达尔效应实例
溶液小于1均匀、透明、稳定能没有NaCl、蔗糖溶液
胶体在1—100之间均匀、有的透明、较稳定能有Fe(OH)3胶体
浊液大于100不均匀、不透明、不稳定不能没有泥水
二、物质的化学变化
1、物质之间可以发生各种各样的化学变化,依据一定的标准可以对化学变化进行分类。
(1)根据反应物和生成物的类别以及反应前后物质种类的多少可以分为:
A、化合反应(A+B=AB)B、分解反应(AB=A+B)
C、置换反应(A+BC=AC+B)
D、复分解反应(AB+CD=AD+CB)
(2)根据反应中是否有离子参加可将反应分为:
A、离子反应:
有离子参加的一类反应。
主要包括复分解反应和有离子参加的氧化还原反应。
B、分子反应(非离子反应)
(3)根据反应中是否有电子转移可将反应分为:
A、氧化还原反应:
反应中有电子转移(得失或偏移)的反应
实质:
有电子转移(得失或偏移)
特征:
反应前后元素的化合价有变化
B、非氧化还原反应
2、离子反应
(1)、电解质:
在水溶液中或熔化状态下能导电的化合物,叫电解质。
酸、碱、盐都是电解质。
在水溶液中或熔化状态下都不能导电的化合物,叫非电解质。
注意:
①电解质、非电解质都是化合物,不同之处是在水溶液中或融化状态下能否导电。
②电解质的导电是有条件的:
电解质必须在水溶液中或熔化状态下才能导电。
③能导电的物质并不全部是电解质:
如铜、铝、石墨等。
④非金属氧化物(SO2、SO3、CO2)、大部分的有机物为非电解质。
(2)、离子方程式:
用实际参加反应的离子符号来表示反应的式子。
它不仅表示一个具体的化学反应,而且表示同一类型的离子反应。
复分解反应这类离子反应发生的条件是:
生成沉淀、气体或水。
书写方法:
写:
写出反应的化学方程式
拆:
把易溶于水、易电离的物质拆写成离子形式
删:
将不参加反应的离子从方程式两端删去
查:
查方程式两端原子个数和电荷数是否相等
(3)、离子共存问题
所谓离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;
若离子之间能发生反应,则不能大量共存。
A、结合生成难溶物质的离子不能大量共存:
如Ba2+和SO42-、Ag+和Cl—、Ca2+和CO32-、Mg2+和OH-等
B、结合生成气体或易挥发性物质的离子不能大量共存:
如H+和CO32-,HCO3-,SO32-,OH-和NH4+等
C、结合生成难电离物质(水)的离子不能大量共存:
如H+和OH-、CH3COO-,OH-和HCO3-等。
D、发生氧化还原反应、水解反应的离子不能大量共存(待学)
题干中的条件:
如无色溶液应排除有色离子:
Fe2+、Fe3+、Cu2+、MnO4-等离子,酸性(或碱性)则应考虑所给离子组外,还有大量的H+(或OH-)。
(4)离子方程式正误判断(六看)
一、看反应是否符合事实:
主要看反应能否进行或反应产物是否正确
二、看能否写出离子方程式:
纯固体之间的反应不能写离子方程式
三、看化学用语是否正确:
化学式、离子符号、沉淀、气体符号、等号等的书写是否符合事实
四、看离子配比是否正确
五、看原子个数、电荷数是否守恒
六、看与量有关的反应表达式是否正确(过量、适量)
3、氧化还原反应中概念及其相互关系如下:
失去电子——化合价升高——被氧化(发生氧化反应)——是还原剂(有还原性)
得到电子——化合价降低——被还原(发生还原反应)——是氧化剂(有氧化性)
第三章:
金属及其化合物
一、
金属活动性Na>Mg>Al>Fe。
二、金属一般比较活泼,容易与O2反应而生成氧化物,可以与酸溶液反应而生成H2,特别活泼的如Na等可以与H2O发生反应置换出H2,特殊金属如Al可以与碱溶液反应而得到H2。
三、
A12O3为两性氧化物,Al(OH)3为两性氢氧化物,都既可以与强酸反应生成盐和水,也可以与强碱反应生成盐和水。
四、
五、Na2CO3和NaHCO3比较
碳酸钠碳酸氢钠
俗名纯碱或苏打小苏打
色态白色晶体细小白色晶体
水溶性易溶于水,溶液呈碱性使酚酞变红易溶于水(但比Na2CO3溶解度小)溶液呈碱性(酚酞变浅红)
热稳定性较稳定,受热难分解受热易分解
2NaHCO3=Na2CO3+CO2↑+H2O
与酸反应CO32—HCO3—H+
CO3-+H+==CO2↑+H2O
HCO3-+H+==CO2↑+H2O
相同条件下放出CO2的速度NaHCO3比Na2CO3快
与碱反应Na2CO3+Ca(OH)2==CaCO3↓+2NaOH
反应实质:
CO32-与金属阳离子的复分解反应NaHCO3+NaOH==Na2CO3+H2O
HCO3—+OH-==H2O+CO32—
与H2O和CO2的反应Na2CO3+CO2+H2O==2NaHCO3CO32-+H2O+CO2==HCO3-
与盐反应CaCl2+Na2CO3==CaCO3↓+2NaClCa2++CO32—==CaCO3↓
主要用途玻璃、造纸、制皂、洗涤发酵、医药、灭火器
六、.合金:
两种或两种以上的金属(或金属与非金属)熔合在一起而形成的具有金属特性的物质。
合金的特点;
硬度一般比成分金属大而熔点比成分金属低,用途比纯金属要广泛。
第四章:
非金属及其化合物
一、硅元素:
无机非金属材料中的主角,在地壳中含量26.3%,次于氧。
是一种亲氧元
素,以熔点很高的氧化物及硅酸盐形式存在于岩石、沙子和土壤中,占地壳质量90%以上。
位于第3周期,第ⅣA族碳的下方。
Si对比C
最外层有4个电子,主要形成四价的化合物。
二、二氧化硅(SiO2)
天然存在的二氧化硅称为硅石,包括结晶形和无定形。
石英是常见的结晶形二氧化硅,其中无色透明的就是水晶,具有彩色环带状或层状的是玛瑙。
二氧化硅晶体为立体网状结构,基本单元是[SiO4],因此有良好的物理和化学性质被广泛应用。
(玛瑙饰物,石英坩埚,光导纤维)
物理:
熔点高、硬度大、不溶于水、洁净的SiO2无色透光性好
化学:
化学稳定性好、除HF外一般不与其他酸反应,可以与强碱(NaOH)反应,是酸性氧化物,在一定的条件下能与碱性氧化物反应
SiO2+4HF==SiF4↑+2H2O
SiO2+CaO===(高温)CaSiO3
SiO2+2NaOH==Na2SiO3+H2O
不能用玻璃瓶装HF,装碱性溶液的试剂瓶应用木塞或胶塞。
三、硅酸(H2SiO3)
酸性很弱(弱于碳酸)溶解度很小,由于SiO2不溶于水,硅酸应用可溶性硅酸盐和其他酸性比硅酸强的酸反应制得。
Na2SiO3+2HCl==H2SiO3↓+2NaCl
硅胶多孔疏松,可作干燥剂,催化剂的载体。
四、硅酸盐
硅酸盐是由硅、氧、金属元素组成的化合物的总称,分布广,结构复杂化学性质稳定。
一般不溶于水。
(Na2SiO3、K2SiO3除外)最典型的代表是硅酸钠Na2SiO3:
可溶,其水溶液称作水玻璃和泡花碱,可作肥皂填料、木材防火剂和黏胶剂。
常用硅酸盐产品:
玻璃、陶瓷、水泥
四、硅单质
与碳相似,有晶体和无定形两种。
晶体硅结构类似于金刚石,有金属光泽的灰黑色固体,熔点高(1410℃),硬度大,较脆,常温下化学性质不活泼。
是良好的半导体,应用:
半导体晶体管及芯片、光电池、
五、氯元素:
位于第三周期第ⅦA族,原子结构:
容易得到一个电子形成
氯离子Cl-,为典型的非金属元素,在自然界中以化合态存在。
六、氯气
物理性质:
黄绿色气体,有刺激性气味、可溶于水、加压和降温条件下可变为液态(液氯)和固态。
制法:
MnO2+4HCl(浓)MnCl2+2H2O+Cl2
闻法:
用手在瓶口轻轻扇动,使少量氯气进入鼻孔。
化学性质:
很活泼,有毒,有氧化性,能与大多数金属化合生成金属氯化物(盐)。
也能与非金属反应:
2Na+Cl2===(点燃)2NaCl2Fe+3Cl2===(点燃)2FeCl3Cu+Cl2===(点燃)CuCl2
Cl2+H2===(点燃)2HCl现象:
发出苍白色火焰,生成大量白雾。
燃烧不一定有氧气参加,物质并不是只有在氧气中才可以燃烧。
燃烧的本质是剧烈的氧化还原反应,所有发光放热的剧烈化学反应都称为燃烧。
Cl2的用途:
①自来水杀菌消毒Cl2+H2O==HCl+HClO2HClO===(光照)2HCl+O2↑
1体积的水溶解2体积的氯气形成的溶液为氯水,为浅黄绿色。
其中次氯酸HClO有强氧化性和漂泊性,起主要的消毒漂白作用。
次氯酸有弱酸性,不稳定,光照或加热分解,因此久置氯水会失效。
②制漂白液、漂白粉和漂粉精
制漂白液Cl2+2NaOH=NaCl+NaClO+H2O,其有效成分NaClO比HClO稳定多,可长期存放制漂白粉(有效氯35%)和漂粉精(充分反应有效氯70%)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
③与有机物反应,是重要的化学工业物质。
④用于提纯Si、Ge、Ti等半导体和钛
⑤有机化工:
合成塑料、橡胶、人造纤维、农药、染料和药品
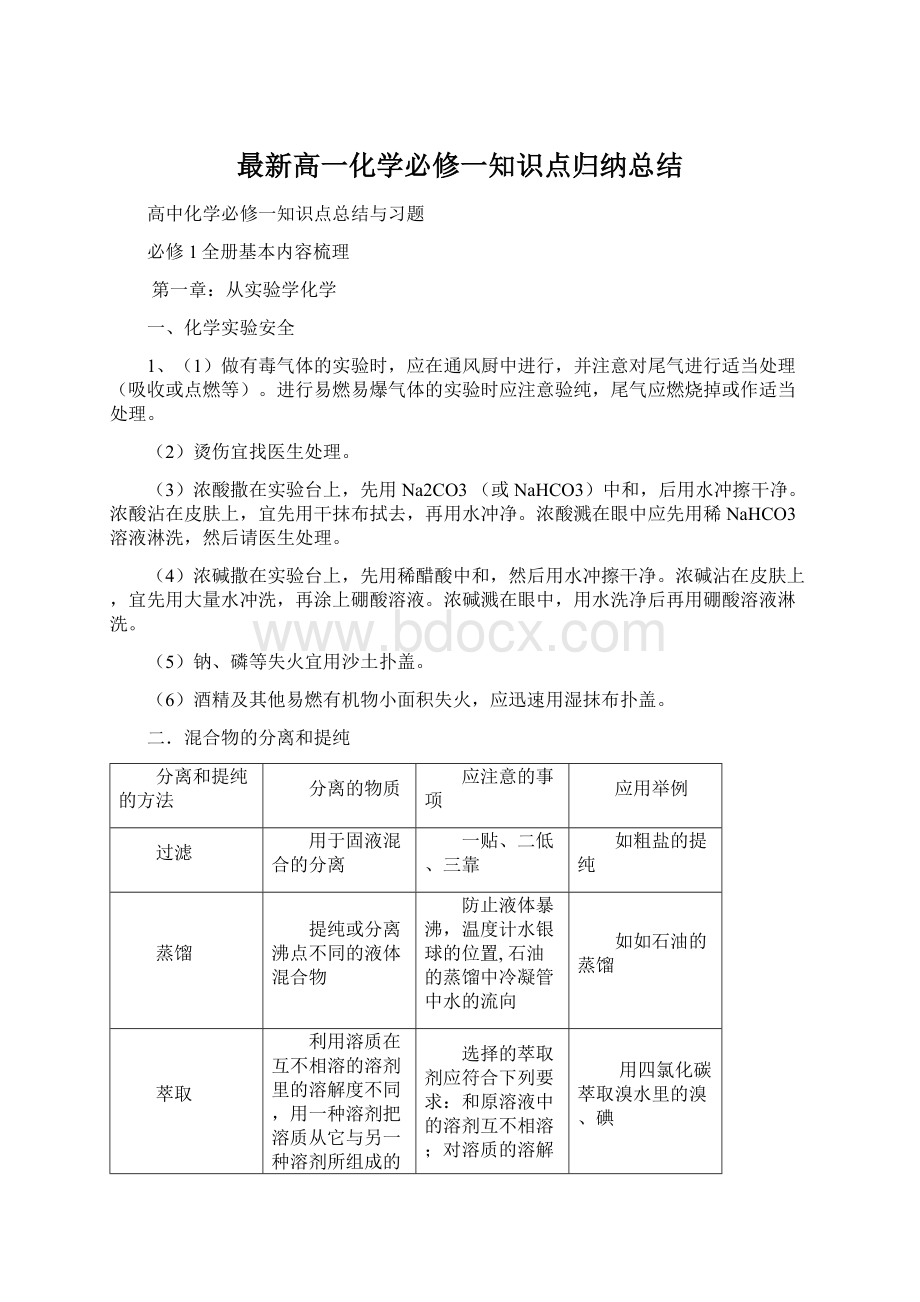
七、氯离子的检验
使用硝酸银溶液,并用稀硝酸排除干扰离子(CO32-、SO32-)
HCl+AgNO3==AgCl↓+HNO3
NaCl+AgNO3==AgCl↓+NaNO3
Na2CO3+2AgNO3==Ag2CO3↓+2NaNO3
Ag2CO3+2HNO3==2AgNO3+CO2↑+H2O
Cl-+Ag+==AgCl↓
八、二氧化硫
制法(形成):
硫黄或含硫的燃料燃烧得到(硫俗称硫磺,是黄色粉末)
S+O2===(点燃)SO2
无色、刺激性气味、容易液化,易溶于水(1:
40体积比)
有毒,溶于水与水反应生成亚硫酸H2SO3,形成的溶液酸性,有漂白作用,遇热会变回原来颜色。
这是因为H2SO3不稳定,会分解回水和SO2
SO2+H2OH2SO3因此这个化合和分解的过程可以同时进行,为可逆反应。
可逆反应——在同一条件下,既可以往正反应方向发生,又可以向逆反应方向发生的化学反应称作可逆反应,用可逆箭头符号连接。
九、一氧化氮和二氧化氮
一氧化氮在自然界形成条件为高温或放电:
N2+O2==(高温或放电)2NO,生成的一氧化氮很不稳定,在常温下遇氧气即化合生成二氧化氮:
2NO+O2==2NO2
一氧化氮的介绍:
无色气体,是空气中的污染物,少量NO可以治疗心血管疾病。
二氧化氮的介绍:
红棕色气体、刺激性气味、有毒、易液化、易溶于水,并与水反应:
3NO2+H2O==2HNO3+NO这是工业制硝酸的方法。
十、大气污染
SO2、NO2溶于雨水形成酸雨。
防治措施:
①从燃料燃烧入手。
②从立法管理入手。
③从能源利用和开发入手。
④从废气回收利用,化害为利入手。
(2SO2+O2==2SO3SO3+H2O==H2SO4)
十一、硫酸
无色粘稠油状液体,不挥发,沸点高,密度比水大。
具有酸的通性,浓硫酸具有脱水性、吸水性和强氧化性。
是强氧化剂。
C12H22O11======(浓H2SO4)12C+11H2O放热
2H2SO4(浓)+C==CO2↑+2H2O+SO2↑
还能氧化排在氢后面的金属,但不放出氢气。
2H2SO4(浓)+Cu==CuSO4+2H2O+SO2↑
稀硫酸:
与活泼金属反应放出H2,使酸碱指示剂紫色石蕊变红,与某些盐反应,与碱性氧化物反应,与碱中和
十二、硝酸
无色液体,易挥发,沸点较低,密度比水大。
具有一般酸的通性,浓硝酸和稀硝酸都是强氧化剂。
4HNO3(浓)+Cu==Cu(NO3)2+2NO2↑+4H2O
8HNO3(稀)+3Cu==3Cu(NO3)2+2NO↑+4H2O
反应条件不同,硝酸被还原得到的产物不同,可以有以下产物:
N(+4)O2,HN(+3)O2,N(+2)O,N(+1)2O,N(0)2,N(-3)H3△硫酸和硝酸:
浓硫酸和浓硝酸都能钝化某些金属(如铁和铝)使表面生成一层致密的氧化保护膜,隔绝内层金属与酸,阻止反应进一步发生。
因此,铁铝容器可以盛装冷的浓硫酸和浓硝酸。
硝酸和硫酸都是重要的化工原料和实验室必备的重要试剂。
可用于制化肥、农药、炸药、染料、盐类等。
硫酸还用于精炼石油、金属加工前的酸洗及制取各种挥发性酸。
十三、氨气及铵盐
氨气的性质:
无色气体,刺激性气味、密度小于空气、极易溶于水(且快)1:
700体积比。
溶于水发生以下反应使水溶液呈碱性:
NH3+H2O==NH3•H2ONH4++OH-可作红色喷泉实验。
生成的一水合氨NH3•H2O是一种弱碱,很不稳定,会分解,受热更不稳定:
NH3•H2O===(△)NH3↑+H2O
浓氨水易挥发除氨气,有刺激难闻的气味。
氨气能跟酸反应生成铵盐:
NH3+HCl==NH4Cl(晶体)
氨是重要的化工产品,氮肥工业、有机合成工业及制造硝酸、铵盐和纯碱都离不开它。
氨气容易液化为液氨,液氨气化时吸收大量的热,因此还可以用作制冷剂。
铵盐的性质:
易溶于水(很多化肥都是铵盐),受热易分解,放出氨气:
NH4Cl==△NH3↑+HCl↑
NH4HCO3==△NH3↑+H2O↑+CO2↑
可以用于实验室制取氨气:
(干燥铵盐与和碱固体混合加热)
NH4NO3+NaOH==NaNO3+H2O+NH3↑
2NH4Cl+Ca(OH)2==CaCl2+2H2O+2NH3↑
用向下排空气法收集,红色石蕊试纸检验是否收集满
习题
第一章从实验学化学
1、化学实验基本方法
化学实验包括:
(一)气体的制备、净化与干燥、收集和尾气处理。
(二)物质的分离与提纯:
1、物理方法:
溶解、过滤,蒸发浓缩法,结晶、重结晶法、蒸馏法、分馏法、萃取法、分液法,吸附法,升华法,水洗法,液化法,渗析法,盐析法;
2、化学方法:
酸、碱处理法,热分解法,吸收法,转化法,沉淀法,氧化还原法,离子交换法,电解法。
(三)化学实验方案设计。
例题1给50mL某液体加热的操作中,以下仪器必须用到的是
①试管②烧杯③酒精灯④试管夹⑤石棉网⑥铁架台⑦泥三角⑧坩埚⑨铁三脚架
A.②③⑤⑧B.③⑥⑦⑧C.①③④⑥D.②③⑤⑥
练习1:
加热固体试剂时,不能使用的仪器是
A.试管B.烧杯C.蒸发皿D.坩埚
例题2某学生发现滴瓶中的溶液有悬浮物,拟用右图所示操作进行过滤,操
作上错误的地方有
A.4处B.3处
C.2处D.1处
例题3:
为了除去氯化钠溶液中少量的溴化钠,常用的方法是往溶液中加入少量的氯水,然后加入苯或四氯化碳,经振荡、静置、分液,将氯化钠溶液加热排除溶解在水中的氯分子,得到氯化钠溶液。
分析判断,正确的是
A.加入苯或四氯化碳操作叫萃取B.苯层在下层或四氯化碳在上层
C.可以用酒精代替苯或四氯化碳D.氯水是氯化剂
练习2:
萃取和分液都要使用的仪器是
A.漏斗和烧杯B.分液漏斗和烧杯
C.容量瓶和烧杯D.锥形瓶和烧杯
2、化学计量在实验中的应用
n、N、NA之间的关系:
n、m、M之间的关系:
n=
标准状况(0℃,101Pa)下,气体:
溶液中n(B)、c(B)、V的关系:
Vm=22.4L/molc(B)=
例题4:
下列关于阿佛加德罗常数(NA)的说法中正确的是:
A、2.3克Na由原子变为Na+时,共失去的电子数为0.1NA
B、18克H2O所含有的电子数为8NA
C、28克氮气所含的原子数为NA
D、在20℃,1.01×
105Pa时,11.2LO2所含的原子数为NA
练习3:
4gNaOH溶于水配成1L的溶液,该氢氧化钠溶液的物质的量浓度;
将3.65gHCl通入此溶液中反应后,求所得溶液的物质的量溶度。
练习4:
实验室欲配制80mL2mol/L的KCl溶液,就配制该溶液的过程,请回答:
(1)不需要的仪器是。
A.烧杯B.100mL容量瓶C.量筒D.胶头滴管E.玻璃棒F.50mL容量瓶
(2)配制时应称取KClg。
(3)下列操作的顺序是(用字母表示)。
A.冷却B.称量C.洗涤D.定容E.溶解F.摇匀G.转移
(4)若容量瓶未干燥即用来配制溶液,实验结果将,若定容时俯视刻度线,实验结果将。
(5)将配制好的溶液稀释至400mL,则该溶液浓度为。
第二章化学物质及变化
例题5:
按照无机物的分类方法,下列各组物质中,属于不同类型的物质是
A.火碱、烧碱、生石灰B.生石灰、冰、干冰
C.熟石灰、苛性钠、氢氧化钾D.纯碱、硫酸钠、胆矾
练习5:
生活中的下列物质,属于氧化物的是
A.水B.食盐C.纯碱D.酒精
练习6:
下列物质在一定条件下能导电,但不是电解质的是
A.铝B.食盐C.硫酸D.蔗糖
1、离子反应
例题6:
下列离子方程式书写正确的是
A.石灰石和盐酸反应CO32-+2H+=CO2↑+H2O
B.氯气与H2O反应:
Cl2+H2O==2H++Cl-+ClO-
C.钠与水反应:
2Na+2H2O==2Na++2OH-+H2↑
D.硫酸铜溶液与Ba(OH)2反应:
Ba2++SO42-==BaSO4↓
练习7:
下列各离子组可在同一溶液中大量共存,且形成无色溶液的是()
A.K+、Na+、OH-、NO3-B.Cu2+、Ba2+、Cl-、NO3-
C.Na+、Mg2+、OH-、SO42-D.Fe2+、H+、NO3-、ClO-
练习8:
向含有Cl-、Br-、I-、Fe2+的溶液中,加入足量的溴水,反应后溶液中离子数量明显减少的是;
离子数量基本不变的是。
练习9:
写出下列物质在水溶液中的电离方程式:
硫酸铁:
氢氧化钡:
碳酸钠:
硫酸:
氯化铜:
2、氧化还原反应
例题7:
下列说法中不正确的是
A.置换反应一定都是氧化还原反应;
B.化合反应不一定都是氧化还原反应
C.复分解反应一定都不是氧化还原反应D.氧化还原反应都量置换反应
例题8:
下列变化中,需加氧化剂能发生的是
A、Cl-→Cl2B、Fe2+
→Fe3+
C、I2→I-D、CO32-→CO2
练习10:
在SiO2+3C=SiC+2CO反应中,氧化剂和还原剂的质量比是()
A.60:
36B.36:
60C.2:
1D.1:
2
练习11:
在稀硫酸与锌的反应中,硫酸是:
A.是氧化剂B.是还原剂C.被氧化D.催化剂
第三章金属及其化合物
知识要点:
1、钠及其重要化合物之间的转化关系
Na2O2←Na→NaOH→Na2CO3←NaHCO3
2、铝及其化合物之间的转化关系
Al