三年高考真题分类汇编化学 专题15 工艺流程题 教师版Word格式.docx
《三年高考真题分类汇编化学 专题15 工艺流程题 教师版Word格式.docx》由会员分享,可在线阅读,更多相关《三年高考真题分类汇编化学 专题15 工艺流程题 教师版Word格式.docx(31页珍藏版)》请在冰豆网上搜索。
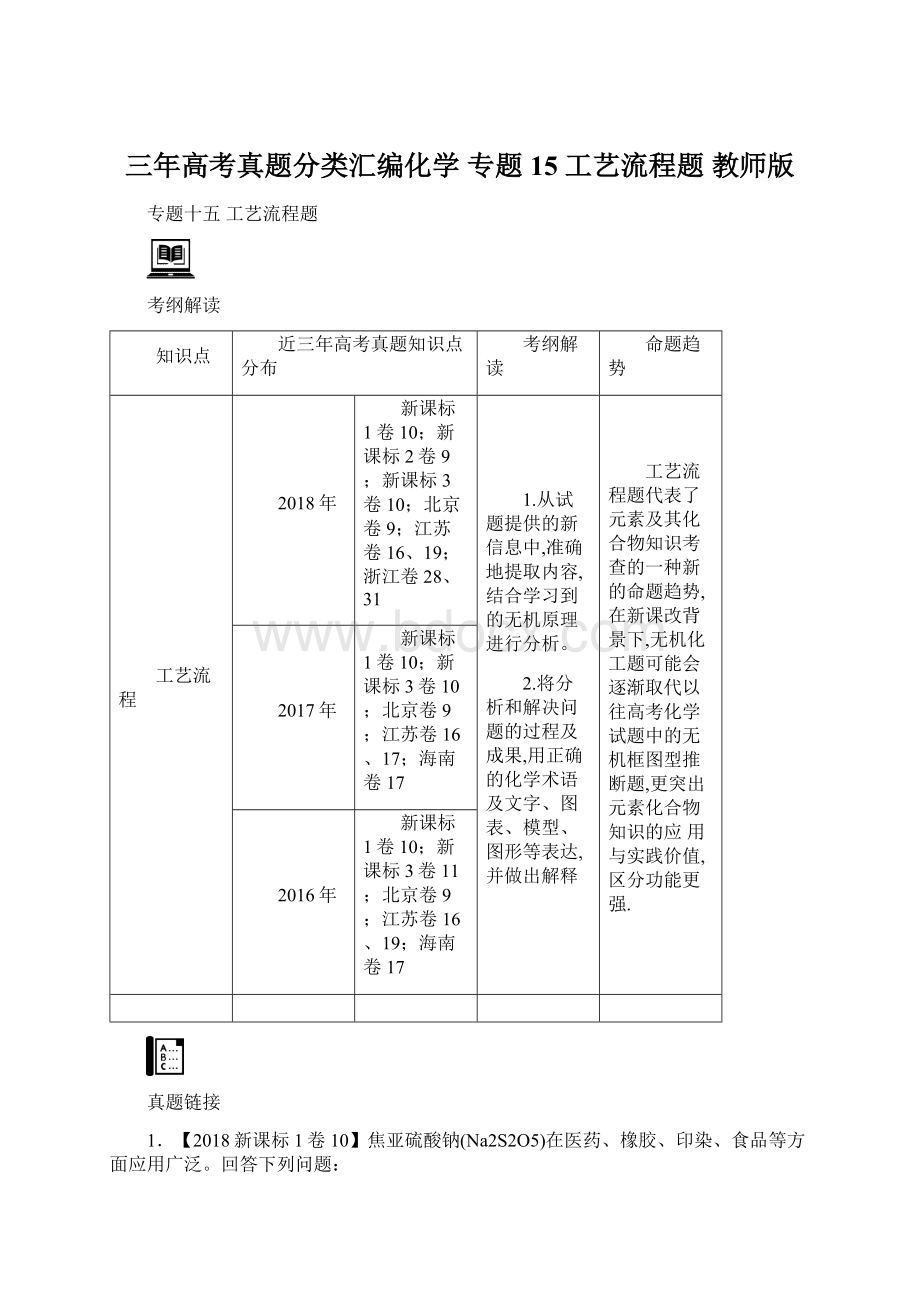
滴定反应的离子方程式为_____________,该样品中Na2S2O5的残留量为____________g·
L−1(以SO2计)。
【答案】
(1)2NaHSO3=Na2S2O5+H2O
(2)①NaHSO3②得到NaHSO3过饱和溶液
(3)2H2O-4e-=4H++O2↑a(4)S2O52-+2I2+3H2O=2SO42-+4I-+6H+0.128
【解析】
(1)亚硫酸钠过饱和溶液脱水生成焦亚硫酸钠,根据原子守恒可知反应的方程式为2NaHSO3=Na2S2O5+H2O
(2)①碳酸钠饱和溶液吸收SO2后的溶液显酸性,说明生成物是酸式盐,即Ⅰ中为NaHSO3;
②要制备焦亚硫酸钠,需要制备亚硫酸氢钠过饱和溶液,因此工艺中加入碳酸钠固体、并再次充入二氧化硫的目的是得到NaHSO3过饱和溶液;
(3)阳极发生失去电子的氧化反应,阳极区是稀硫酸,氢氧根放电,则电极反应式为2H2O-4e-=4H++O2↑。
阳极区氢离子增大,通过阳离子交换膜进入a室与亚硫酸钠结合生成亚硫酸钠。
阴极是氢离子放电,氢氧根浓度增大,与亚硫酸氢钠反应生成亚硫酸钠,所以电解后a室中亚硫酸氢钠的浓度增大。
(4)单质碘具有氧化性,能把焦亚硫酸钠氧化为硫酸钠,反应的方程式为S2O52-+2I2+3H2O=2SO42-+4I-+6H+;
消耗碘的物质的量是0.0001mol,所以焦亚硫酸钠的残留量(以SO2计)是
。
2.【2017新课标1卷10】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。
由图可知,当铁的浸出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以
形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·
xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/℃
30
35
40
45
50
TiO2·
xH2O转化率%
92
95
97
93
88
分析40℃时TiO2·
xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×
10-5mol/L,此时是否有Mg3(PO4)2沉淀生成?
(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×
10-22、1.0×
10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式。
【答案】
(1)100℃、2h,90℃,5h
(2)FeTiO3+4H++4Cl−=Fe2++
+2H2O
(3)低于40℃,TiO2·
xH2O转化反应速率随温度升高而增加;
超过40℃,双氧水分解与氨气逸出导致TiO2·
xH2O转化反应速率下降(4)4
(5)Fe3+恰好沉淀完全时,c(PO43-)=
mol·
L−1=1.3×
10–17mol·
L−1,c3(Mg2+)×
c2(
)=(0.01)3×
(1.3×
10–17)2=1.7×
10–40<Ksp[Mg3(PO4)2],因此不会生成Mg3(PO4)2沉淀。
(6)2FePO4+Li2CO3+H2C2O4
2LiFePO4+H2O↑+3CO2↑
(1)由图示可知,“酸浸”时铁的净出率为70%时,则应选择在100℃、2h,90℃,5h下进行;
(2)“酸浸”时用盐酸溶解FeTiO3生成TiOCl42-时,发生反应的离子方程式FeTiO3+4H++4Cl−=Fe2++
(3)温度是影响速率的主要因素,但H2O2在高温下易分解、氨水易挥发,即原因是低于40℃,TiO2·
xH2O转化反应速率下降;
(4)Li2Ti5O15中Li为+1价,O为–2价,Ti为+4价,过氧根(O22-)中氧元素显–1价,设过氧键的数目为x,根据正负化合价代数和为0,可知(+1)×
2+(+4)×
5+(–2)×
(15–2x)+(–1)×
2x=0,解得:
x=4;
(5)Ksp[FePO4]=c(Fe3+)×
c(
)=1.3×
10–2,则c(PO43-)=
=1.3×
10–17mol/L,Qc[Mg3(PO4)2]=c3(Mg2+)×
c2(PO43-)=(0.01)3×
10–17)2=1.69×
10–40<1.0×
10–24,则无沉淀。
(6)高温下FePO4与Li2CO3和H2C2O4混合加热可得LiFePO4,根据电子守恒和原子守恒可得此反应的化学方程式为2FePO4+Li2CO3+H2C2O4
2LiFePO4+H2O↑+3CO2↑。
3.【2016新课标1卷10】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式_______。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。
“电解”中阴极反应的主要产物是______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。
此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是_________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:
每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。
NaClO2的有效氯含量为____。
(计算结果保留两位小数)
(1)+3;
(2)2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4;
(3)NaOH溶液;
Na2CO3溶液;
ClO2−(或NaClO2);
(4)2:
1;
O2;
(5)1.57。
【解析】试题分析:
(1)在NaClO2中Na为+1价,O为-2价,根据正负化合价的代数和为0,可得Cl的化合价为+3
(2)NaClO3和SO2在H2SO4酸化条件下生成ClO2,其中NaClO2是氧化剂,还原产物为NaCl,根据得失电子守恒和原子守恒,此反应的化学方程式为2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4(3)食盐溶液中混有Mg2+和Ca2+,可利用过量NaOH溶液除去Mg2+,利用过量Na2CO3溶液除去Ca2+;
向NaC1溶液中加入ClO2进行电解,阳极发生反应2Cl--2e=Cl2↑,反应产生Cl2,阴极发生反应产生NaClO2,可见“电解”中阴极反应的主要产物是NaClO2;
(4)根据图示可知:
利用含有过氧化氢的NaOH溶液吸收ClO2气体,产物为NaClO2,则此吸收反应中,氧化剂为ClO2,还原产物为NaClO2,还原剂是H2O2,氧化产物是O2,每1mol的H2O2转移2mol电子,反应方程式是:
2NaOH+2ClO2+H2O2=2NaClO2+O2+2H2O,可知氧化剂和还原剂的物质的量之比为2:
1,该反应中氧化产物为O2。
(5)每克NaClO2的物质的量n(NaClO2)=1g÷
90.5g/mol=
mol,其获得电子的物质的量是
n(e−)=
mol×
4=4/90.5mol,1molCl2获得电子的物质的量是2mol,根据电子转移数目相等,可知其相对于氯气的物质的量为n=
4÷
2=
mol,则氯气的质量为
71g/mol=1.57g。
4.【2018新课标2卷9】我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
相关金属离子[c0(Mn+)=0.1mol·
L-1]形成氢氧化物沉淀的pH范围如下:
金属离子
Fe3+
Fe2+
Zn2+
Cd2+
开始沉淀的pH
1.5
6.3
6.2
7.4
沉淀完全的pH
2.8
8.3
8.2
9.4
(1)焙烧过程中主要反应的化学方程式为_______________________。
(2)滤渣1的主要成分除SiO2外还有___________;
氧化除杂工序中ZnO的作用是____________,若不通入氧气,其后果是________________。
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为_________________。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为______________;
沉积锌后的电解液可返回_______工序继续使用。
【答案】
(1)2ZnS+3O2
2ZnO+2SO2。
(2)PbSO4;
调节溶液的pH;
无法除去杂质Fe2+
(3)Zn+Cd2+
Zn2++Cd(4)Zn2++2e-
Zn溶浸
精准分析:
焙烧时硫元素转化为SO2,然后用稀硫酸溶浸,生成硫酸锌、硫酸亚铁和硫酸镉,二氧化硅与稀硫酸不反应转化为滤渣,由于硫酸铅不溶于水,因此滤渣1中还含有硫酸铅。
由于沉淀亚铁离子的pH较大,需要将其氧化为铁离子,通过控制pH得到氢氧化铁沉淀;
滤液中加入锌粉置换出Cd,最后将滤液电解得到金属锌。
则
(1)由于闪锌矿的主要成分是ZnS,因此焙烧过程中主要反应的化学方程式为2ZnS+3O2
(2)由于硫酸铅不溶于水,因此滤渣1的主要成分除SiO2外还有PbSO4;
要测定铁离子,需要调节溶液的pH,又因为不能引入新杂质,所以需要利用氧化锌调节pH,即氧化除杂工序中ZnO的作用是调节溶液的pH。
根据表中数据可知沉淀亚铁离子的pH较大,所以若不通入氧气,其后果是无法除去杂质Fe2+。
(3)溶液中的Cd2+可用锌粉除去,反应的离子方程式为Zn+Cd2+=Zn2++Cd。
(4)电解硫酸锌溶液制备单质锌时,阴极发生得到电子的还原反应,因此阴极是锌离子放电,则阴极的电极反应式为Zn2++2e-=Zn;
阳极是氢氧根放电,破坏水的电离平衡,产生氢离子,所以电解后还有硫酸产生,因此沉积锌后的电解液可返回溶浸工序继续使用。
考点定位:
本题主要是考查物质制备的工艺流程分析,涉及方程式书写、滤渣成分判断、试剂作用分析、电解原理的应用等知识。
5.【2018新课标3卷10】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。
(1)KIO3的化学名称是_______。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:
“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。
“逐Cl2”采用的方法是________。
“滤液”中的溶质主要是_______。
“调pH”中发生反应的化学方程式为__________。
(3)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式______。
②电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有______________(写出一点)。
(1)碘酸钾
(2)加热KClKH(IO3)2+KOH
2KIO3+H2O或(HIO3+KOH
KIO3+H2O)
(3)①2H2O+2e-
2OH-+H2↑②K+a到b③产生Cl2易污染环境等
精准分析:
(1)根据氯酸钾(KClO3)可以推测KIO3为碘酸钾
(2)将溶解在溶液中的气体排岀的一般方法是将溶液加热,原因是气体的溶解度是随温度上升而下减小。
第一步反应得到的产品中氯气在“逐Cl2”时除去,根据图示,碘酸钾在最后得到,所以过滤时KH(IO3)2应该在滤渣中,所以滤液中主要为KCl。
“调pH”的主要目的是将KH(IO3)2转化为KIO3,所以方程式为KH(IO3)2+KOH
2KIO3+H2O
(3)①由图示,阴极为氢氧化钾溶液,所以反应为水电离的氢离子得电子,反应为2H2O+2e-=2OH-+H2↑。
②电解时,溶液中的阳离子应该向阴极迁移,明显是溶液中大量存在的钾离子迁移,方向为由左向右,即由a到b。
③KClO3氧化法的最大不足之处在于,生产中会产生污染环境的氯气。
本题考查的是化学工业以及电化学的相关知识,涉及物质名称、流程分析、反应条件控制、电极反应式、交换膜作用分析以及实验方案评价等。
6.【2017新课标3卷10】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·
Cr2O3,还含有硅、铝等杂质。
制备流程如图所示:
(1)步骤①的主要反应为:
FeO·
Cr2O3+Na2CO3+NaNO3
Na2CrO4+Fe2O3+CO2+NaNO2
上述反应配平后FeO·
Cr2O3与NaNO3的系数比为_______。
该步骤不能使用陶瓷容器,原因是_____。
(2)滤渣1中含量最多的金属元素是_______,滤渣2的主要成分是__________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是_____________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。
向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。
冷却到___________(填标号)得到的K2Cr2O7固体产品最多。
a.80℃b.60℃c.40℃d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1kg铬铁矿粉(含Cr2O340%)制备K2Cr2O7,最终得到产品m2kg,产率为_____________。
(1)2∶7陶瓷在高温下会与Na2CO3反应
(2)铁Al(OH)3
(3)小2
+2H+
+H2O(4)d复分解反应(5)
×
100%
(1)FeO•Cr2O3是还原剂,氧化产物为Na2CrO4和Fe2O3,每摩尔转移7mol电子,而NaNO3是氧化剂,还原产物为NaNO2,每摩尔转移2mol电子,根据转移电子守恒可知,FeO·
Cr2O3与NaNO3的系数比为2:
7;
陶瓷在高温下会与Na2CO3反应,则熔融不能使用陶瓷容器。
(2)熔块中氧化铁不溶于水,过滤后进入滤渣1,则滤渣1中含量最多的金属元素是铁;
滤液1中含有AlO2-、SiO32-、CrO4-,调节溶液pH并过滤后得滤渣2为Al(OH)3及含硅杂质
(3)滤液2调节pH的目的是提高溶液的酸性,pH变小;
因为溶液中存在2CrO42-+2H+
Cr2O72-+H2O,增大溶液中H+浓度,可促进平衡正向移动,提高溶液中Cr2O72-的浓度。
(4)由图示可知,在10℃左右时,得到K2Cr2O7的固体最多;
2KCl+Na2Cr2O7=K2Cr2O7↓+2NaCl的反应类型为复分解反应。
(5)样品中Cr2O3的质量为m1×
40%kg,则生成K2Cr2O7的理论质量为m1×
40%kg×
,则所得产品的产率为m2kg÷
(m1×
)×
100%=
100%。
7.【2016新课标3卷11】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。
从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。
废钒催化剂的主要成分为:
物质
V2O5
V2O4
K2SO4
SiO2
Fe2O3
Al2O3
质量分数/%
2.2~2.9
2.8~3.1
22~28
60~65
1~2
<1
以下是一种废钒催化剂回收工艺路线:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。
“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124−形式存在于溶液中。
“废渣2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:
4ROH+V4O124−
R4V4O12+4OH−(ROH为强碱性阴离子交换树脂)。
为了提高洗脱效率,淋洗液应该呈_____性(填“酸”、“碱”或“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
(1)V2O5+2H+=2VO2++H2O;
SiO2;
(2)0.5;
(3)Fe(OH)3、Al(OH)3;
(4)碱;
(5)K+;
(6)2NH4VO3
V2O5+H2O+2NH3↑。
试题分析:
(1)“酸浸”时V2O5转化为VO2+,V元素化合价不变,说明不是氧化还原反应,根据原子守恒可知反应的离子方程式为V2O5+2H+=2VO2++H2O;
二氧化硅与酸不反应,则“废渣1”的主要成分是二氧化硅。
(2)氧化”中欲使3mol的VO2+变为VO2-,V元素化合价从+4价升高到+5价,而氧化剂KClO3中氯元素化合价从+5价降低到-1价,则根据电子得失守恒可知需要氯酸钾的物质的量为3mol÷
6=0.5mol
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中,同时生成氢氧化铁、氢氧化铝沉淀,则“废渣2”中含有Fe(OH)3、Al(OH)3
(4)根据方程式可知为了提高洗脱效率,反应应该向逆反应方向进行,因此淋洗液应该呈碱性。
(5)由于前面加入了氯酸钾和氢氧化钾,则“流出液”中阳离子最多的是钾离子。
(6)根据原子守恒可知偏钒酸铵(NH4VO3)“煅烧”生成五氧化二钒、氨气和水,发生反应的化学方程式为2NH4VO3
8.【2018北京卷9】磷精矿湿法制备磷酸的一种工艺流程如下:
已知:
磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
溶解度:
Ca5(PO4)3(OH)<
CaSO4·
0.5H2O
(1)上述流程中能加快反应速率的措施有__________。
(2)磷精矿粉酸浸时发生反应:
2Ca5(PO4)3(OH)+3H2O+10H2SO4
10CaSO4·
0.5H2O+6H3PO4
①该反应体现出酸性关系:
H3PO4__________H2SO4(填“>
”或“<
”)。
②结合元素周期律解释①中结论:
P和S电子层数相同,__________。
(3)酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。
写出生成HF的化学方程式:
__________。
(4)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。
相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。
80℃后脱除率变化的原因:
____________________。
(5)脱硫时,CaCO3稍过量,充分反应后仍有SO42−残留,原因是__________;
加入BaCO3可进一步提高硫的脱除率,其离子方程式是____________________。
(6)取ag所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用bmol·
L−1NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液cmL,精制磷酸中H3PO4的质量分数是________。
(已知:
H3PO4摩尔质量为98g·
mol−1)
(1)研磨、加热
(2)①<②核电荷数P<S,原子半径P>S,得电子能力P<S,非金属性P<S(3)2Ca5(PO4)3F+10H2SO4+5H2O
0.5H2O+6H3PO4+2HF↑
(4)80℃后,H2O2分解速率大,浓度显著降低
(5)CaSO4微溶BaCO3+SO42-+2H3PO4
BaSO4+CO2↑+H2O+2H2PO4-(6)
【解析】精准分析:
(1)研磨能増大反应物的接触面积,加快反应速率,加热,升高温度加快反应速率;
流程中能加快反应速率的措施有:
硏磨、加热。
(2)①依据反应方程式,根据“强酸制弱酸”的复分解反应规律,酸性:
H3PO4<
H2SO4。
②用元素周期律解释酸性:
H3PO4<
H2SO4,P和S电子层数相同,核电荷数P<
S,原子半径P>
S,得电子能力P<
S,非金属性P<
S。
(3)根据“强酸制弱酸”的复分解反应规律,Ca5(PO4)3F与H2SO4反应生成HF、磷石膏和磷酸,生成HF的化学方程式为2Ca5(PO4)3F+10H2SO4+5H2O=10CaSO4·
0.5H2O+6H3PO4+2HF↑。
(4)图示是相同投料比、相同反应时间,不同温度下的有机碳脱除率,80℃前温度升高反应速率加快,相同时间内有机碳脱除率增大;
80℃后温度升高,H2O2分解速率大,H2O2浓度显著降低,反应速率减慢,相同条件下有机碳脱除率减小。
(5)脱硫时,CaCO3稍过量,充分反应